Изучение адсорбции комплексов никеля, меди и железа с основаниями Шиффа на поверхности углеродных материалов и ее влияние на стру
Содержание
- 2. Цель работы - изучение закономерностей адсорбции комплексов никеля, меди и железа с основаниями Шиффа на углеродных
- 3. Научная новизна Впервые получены количественные данные по адсорбции комплексов никеля (II), меди (II) и железа (III)
- 4. Практическая значимость Показана возможность прогнозирования структуры и свойств полимерных пленок комплексов никеля (II), меди (II), железа
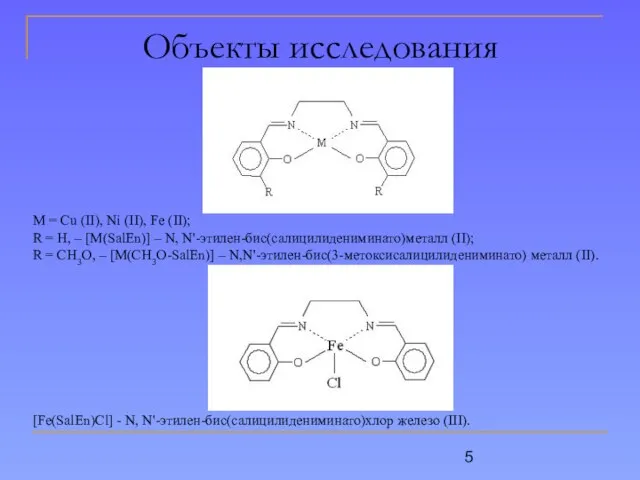
- 5. Объекты исследования М = Cu (II), Ni (II), Fe (II); R = H, – [M(SalEn)] –
- 6. Изучение адсорбции комплексов на поверхности чешуйчатого графита C0 и C - концентрации комплексов в исходном растворе
- 7. Изотерма адсорбции комплекса [Ni(SalEn)] Изотерма адсорбции комплекса [Ni(SalEn)] на чешуйчатом графите при температуре (25 ± 3)оС;
- 8. Изотерма адсорбции комплекса [Ni(CH3O-SalEn)] Изотерма адсорбции комплекса [Ni(CH3O-SalEn)], полученная на чешуйчатом графите при температуре (25 ±
- 9. Вычисление термодинамических параметров, характеризующих адсорбцию комплексов металлов
- 10. Адсорбционные параметры для комплексов никеля (II) Термодинамические параметры, характеризующие адсорбцию комплексов [Ni(SalEn)] и [Ni(CH3O-SalEn)] на поверхности
- 11. Метод спектроскопии фарадеевского импеданса Cdl – емкость ДЭС; fmax – значение частоты, выраженное в Гц; Rct
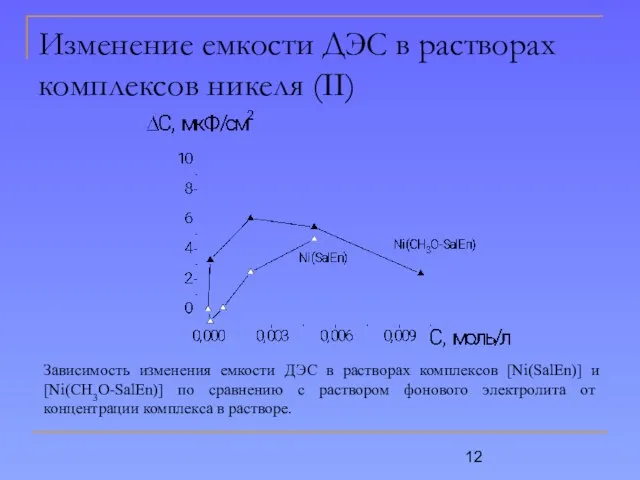
- 12. Изменение емкости ДЭС в растворах комплексов никеля (II) Зависимость изменения емкости ДЭС в растворах комплексов [Ni(SalEn)]
- 13. Стековая модель строения полимерных комплексов поли-[M(Schiff)]
- 14. АСМ-изображения поверхности стеклоуглерода а) чистого и б) с адсорбированным мономером [Ni(SalEn)], С = 5×10-3 моль/л (режим
- 15. АСМ-изображения поверхности стеклоуглерода а) чистого и б) с адсорбированным мономером [Ni(CH3O-SalEn)], С = 5×10-3 моль/л (режим
- 16. Исследование морфологии пленок поли-[Ni(SalEn)] Электронная микрофотография углеродного материала, модифицированного полимерным комплексом поли-[Ni(SalEn)], C = 1×10-4 моль/л;
- 17. Исследование морфологии пленок поли-[Ni(CH3O-SalEn)] Электронная микрофотография углеродного материала, модифицированного полимерным комплексом поли-[Ni(CH3O-SalEn)], C = 1×10-3 моль/л;
- 18. Изотерма адсорбции комплекса [Cu(SalEn)] Изотерма адсорбции комплекса [Cu(SalEn)], полученная на чешуйчатом графите при температуре (25 ±
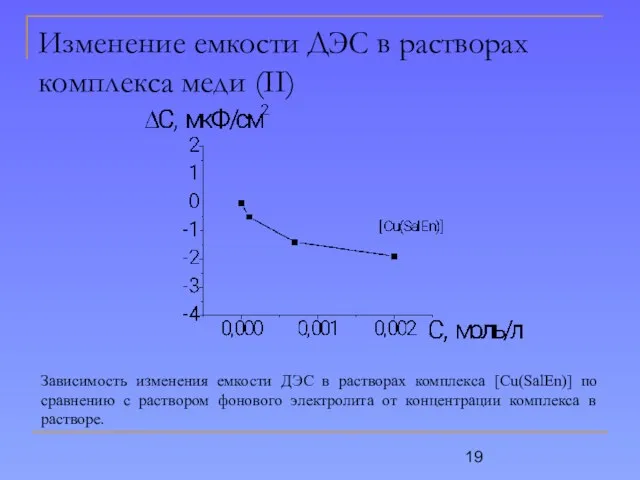
- 19. Изменение емкости ДЭС в растворах комплекса меди (II) Зависимость изменения емкости ДЭС в растворах комплекса [Cu(SalEn)]
- 20. а) б) АСМ-изображения поверхности стеклоуглерода а) чистого и б) с адсорбированным мономером [Cu(SalEn)], С = 2×10-3
- 21. Исследование морфологии пленок поли-[Cu(SalEn)] Электронная микрофотография углеродного материала, модифицированного полимерным комплексом поли-[Cu(SalEn)], C = 1×10-4 моль/л;
- 22. Изотерма адсорбции комплекса [Fe(SalEn)Cl] Изотерма адсорбции комплекса [Fe(SalEn)Cl] на чешуйчатом графите при температуре (25 ± 3)оС.
- 23. Изменение емкости ДЭС в растворах комплексов железа (II) и железа (III) Зависимость изменения емкости ДЭС в
- 24. Вольтамперограмма комплекса [Fe(SalEn)Cl] Циклические вольтамперограммы комплекса [Fe(Salen)Cl] (Ск = 1·10-3 моль/л) в 0,1 моль/л растворе (Et4N)BF4
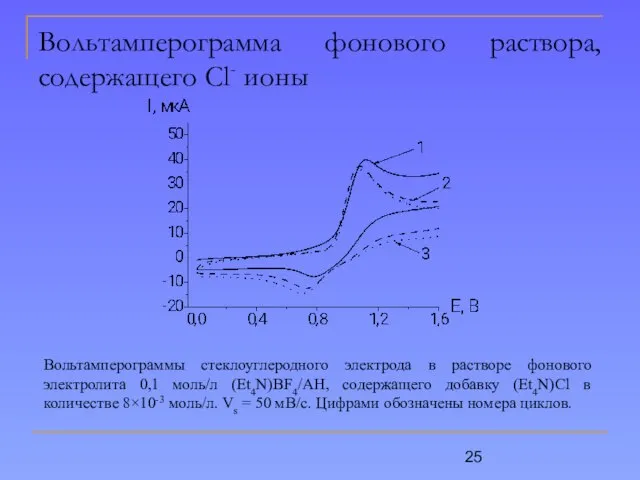
- 25. Вольтамперограмма фонового раствора, содержащего Cl- ионы Вольтамперограммы стеклоуглеродного электрода в растворе фонового электролита 0,1 моль/л (Et4N)BF4/АН,
- 26. Вольтамперограммы комплекса [Ni(SalEn)] Вольтамперограммы, зафиксированные на поверхности стеклоуглеродного электрода (0,07 см2) в растворе 1×10-3 моль/л комплекса
- 27. Итоги работы и выводы 1. Получены количественные данные, характеризующие адсорбцию комплексов [Ni(SalEn)], [Ni(CH3O-SalEn)], [Cu(SalEn)] и [Fe(SalEn)Cl]
- 28. Итоги работы и выводы 4. Предложена модель строения поверхностного слоя, образующегося при адсорбции мономерных комплексов [Ni(SalEn)],
- 30. Скачать презентацию




![Изотерма адсорбции комплекса [Ni(SalEn)] Изотерма адсорбции комплекса [Ni(SalEn)] на чешуйчатом графите при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-6.jpg)
![Изотерма адсорбции комплекса [Ni(CH3O-SalEn)] Изотерма адсорбции комплекса [Ni(CH3O-SalEn)], полученная на чешуйчатом графите](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-7.jpg)

![Адсорбционные параметры для комплексов никеля (II) Термодинамические параметры, характеризующие адсорбцию комплексов [Ni(SalEn)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-9.jpg)

![Стековая модель строения полимерных комплексов поли-[M(Schiff)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-12.jpg)
![АСМ-изображения поверхности стеклоуглерода а) чистого и б) с адсорбированным мономером [Ni(SalEn)], С](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-13.jpg)
![АСМ-изображения поверхности стеклоуглерода а) чистого и б) с адсорбированным мономером [Ni(CH3O-SalEn)], С](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-14.jpg)
![Исследование морфологии пленок поли-[Ni(SalEn)] Электронная микрофотография углеродного материала, модифицированного полимерным комплексом поли-[Ni(SalEn)],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-15.jpg)
![Исследование морфологии пленок поли-[Ni(CH3O-SalEn)] Электронная микрофотография углеродного материала, модифицированного полимерным комплексом поли-[Ni(CH3O-SalEn)],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-16.jpg)
![Изотерма адсорбции комплекса [Cu(SalEn)] Изотерма адсорбции комплекса [Cu(SalEn)], полученная на чешуйчатом графите](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-17.jpg)

![Исследование морфологии пленок поли-[Cu(SalEn)] Электронная микрофотография углеродного материала, модифицированного полимерным комплексом поли-[Cu(SalEn)],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-20.jpg)
![Изотерма адсорбции комплекса [Fe(SalEn)Cl] Изотерма адсорбции комплекса [Fe(SalEn)Cl] на чешуйчатом графите при температуре (25 ± 3)оС.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-21.jpg)

![Вольтамперограмма комплекса [Fe(SalEn)Cl] Циклические вольтамперограммы комплекса [Fe(Salen)Cl] (Ск = 1·10-3 моль/л) в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-23.jpg)
![Вольтамперограммы комплекса [Ni(SalEn)] Вольтамперограммы, зафиксированные на поверхности стеклоуглеродного электрода (0,07 см2) в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-25.jpg)
![Итоги работы и выводы 1. Получены количественные данные, характеризующие адсорбцию комплексов [Ni(SalEn)],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405752/slide-26.jpg)

 My family (Моя семья)
My family (Моя семья) Презентация на тему Календарь природы
Презентация на тему Календарь природы История Хеттов
История Хеттов  Термическая обработка сталей и чугунов
Термическая обработка сталей и чугунов The problems of cultural genesis
The problems of cultural genesis Элемент периодической системы химических элементов Д.И.Менделеева -АЛЮМИНИЙ
Элемент периодической системы химических элементов Д.И.Менделеева -АЛЮМИНИЙ The Moscow State University
The Moscow State University Тема 7Лекция 5
Тема 7Лекция 5 БРОШЮРЫ И ИНФОРМАЦИОННЫЕ БЮЛЛЕТЕНИО.А. Сперанская"Эко-Согласие"
БРОШЮРЫ И ИНФОРМАЦИОННЫЕ БЮЛЛЕТЕНИО.А. Сперанская"Эко-Согласие" Факторы поведения индивидуального уровня (часть 2)
Факторы поведения индивидуального уровня (часть 2) Начальник Аналитического управления ФТС России В.В. Ивин «О возможностях сотрудничества российских и финляндских таможенных орг
Начальник Аналитического управления ФТС России В.В. Ивин «О возможностях сотрудничества российских и финляндских таможенных орг prezentatsia_17_10
prezentatsia_17_10 Презентация ко Дню знаний (1 сентября)
Презентация ко Дню знаний (1 сентября) Великомученик Феодор Стратилат
Великомученик Феодор Стратилат Художественные послания предков
Художественные послания предков Нападающий удар
Нападающий удар Разработка природоподобной технологии формирования концентраций полезных компонентов внутри ехногенных отвалов
Разработка природоподобной технологии формирования концентраций полезных компонентов внутри ехногенных отвалов Как вести себя в конфликтной ситуации: способы решения конфликтов
Как вести себя в конфликтной ситуации: способы решения конфликтов 24 Мая
24 Мая Братья Карамазовы
Братья Карамазовы Декоративное цветоводство
Декоративное цветоводство Презентация на тему Экология
Презентация на тему Экология  Презентация на тему Не просто говорить о Шукшине
Презентация на тему Не просто говорить о Шукшине Презентация к уроку Блок
Презентация к уроку Блок 20140217_po_moryam_po_volnam
20140217_po_moryam_po_volnam Жизненный цикл физкультурно-спортивного товара. Понятие, формы, этапы
Жизненный цикл физкультурно-спортивного товара. Понятие, формы, этапы Интерактивный калькулятор
Интерактивный калькулятор Сбалансированная система показателей в Agile: KPI с человеческим лицом Вольфсон Борис
Сбалансированная система показателей в Agile: KPI с человеческим лицом Вольфсон Борис