Муниципальное образовательное учреждение средняя общеобразовательная школа №1 г.Ворсма Работа по теме: «Классификация химичес
Содержание
- 2. Классификация реакций в неорганической химии
- 3. Оглавление: Введение I.Классификация химических реакций 1).По числу и составу реагирующих веществ 2).По изменению степеней окисления химических
- 4. Химические реакции – химические процессы, в результате которых из одних веществ образуются другие , отличающиеся от
- 5. По числу и составу реагирующих веществ: Реакции, идущие без изменения состава веществ В неорганической химии к
- 6. Аллотропия серы: S (ромбическая) S (пластическая)
- 7. Аллотропия фосфора: Р (красный) Р (белый)
- 8. Реакции, идущие с изменением состава вещества Реакции соединения – это такие реакции, при которых из двух
- 9. Реакция соединения кислотного оксида фосфора(V) с водой: Р2 О5 + 3H2O = 2 H3PO4
- 10. 2. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых
- 11. Разложение перманганата калия при нагревании: Разгорание тлеющей лучины свидетельствует от том, что происходит выделение кислорода: 2KMnO4
- 12. 3. Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь
- 13. Взаимодействие щелочного металла натрия с водой: 2Na + 2H2O = 2NaOH + H2⭡
- 14. Взаимодействие щелочного металла кальция с водой: Са + 2Н2О = Са(ОН)2 + H2⭡
- 15. 4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями
- 16. Взаимодействие сульфата хрома(III) с гидроксидом калия: Cr2(SO4)3 + 6KOH = 2Cr(OH)3 + 3K2SO4
- 17. 2. По изменению степеней окисления химических элементов, образующих вещества: Окислительно-восстановительные реакции: Окислительно-восстановительные реакции – реакции, идущие
- 18. Окислительно-восстановительная реакция: горение магния Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса 0 0 +2
- 19. Не окислительно-восстановительные реакции: К ним относятся все реакции ионного обмена, например: Na2CO3 + 2HCl = 2NaCl
- 20. 3. По участию катализатора: Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость
- 21. Каталитическая реакция взаимодействия алюминия с йодом: H2O 4Al + 3I2 ⭢ 2AlI3
- 22. 4. По агрегатному состоянию реагирующих веществ (фазовому составу): Гетерогенные реакции: Гетерогенные реакции – реакции, в которых
- 23. 5. По тепловому эффекту: Экзотермические реакции: Экзотермические реакции – реакции, протекающие с выделением энергии во внешнюю
- 24. Эндотермические реакции: Эндотермические реакции – реакции, протекающие с поглощением энергии из внешней среды. К ним относятся
- 25. 6. По направлению: Необратимые реакции: Необратимые реакции протекают в данных условиях только в одном направлении. К
- 26. Обратимые реакции: Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее
- 27. 3. НАИБОЛЕЕ ИНТЕРЕСНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ, ПРОВОДИМЫЕ В ШКОЛЬНЫХ ЛАБОРАТОРИЯХ Горение кальция на воздухе Реакция обмена между
- 28. Реакция горения кальция на воздухе:
- 29. Реакция обмена между оксидом меди и серной кислотой.
- 30. Взаимодействие кислот с солями
- 31. Взаимодействие хлора с фосфором
- 32. Восстановление меди из оксида меди водородом.
- 33. 3.Роль химических реакций в организме человека Пищеварение — сложный физиологический процесс, обеспечивающий переваривание пищи и её
- 35. Скачать презентацию
































 Искусство. Опрос. 4 класса
Искусство. Опрос. 4 класса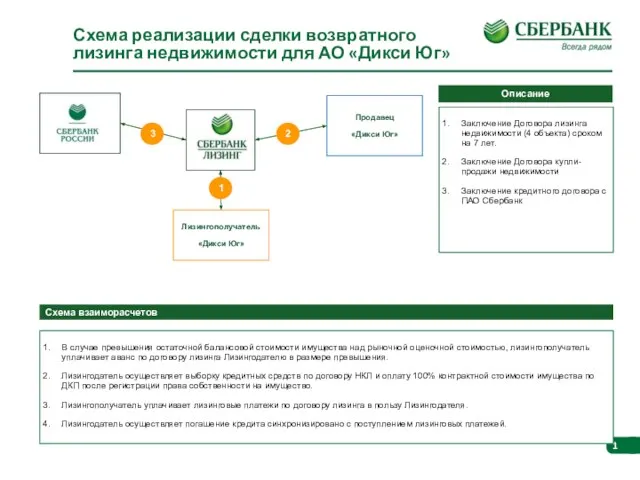 Схема реализации сделки возвратного лизинга недвижимости для АО Дикси Юг
Схема реализации сделки возвратного лизинга недвижимости для АО Дикси Юг Презентация на тему Оборона Сталинграда
Презентация на тему Оборона Сталинграда  Стиральные машины
Стиральные машины Эмоции и чувства. Занятие для первоклассников
Эмоции и чувства. Занятие для первоклассников Давление. Сила давления
Давление. Сила давления Зимние виды спорта
Зимние виды спорта Kursovoy_proekt_Kuzovkin_M_A_EE-19-3b (1)
Kursovoy_proekt_Kuzovkin_M_A_EE-19-3b (1) Практический экзамен по физической культуре в 9 классе
Практический экзамен по физической культуре в 9 классе Демонология романа "Мастер и Маргарита"
Демонология романа "Мастер и Маргарита" Киселевский художник - Селищев Михаил Григорьевич
Киселевский художник - Селищев Михаил Григорьевич Презентация на тему Профессия Экономист
Презентация на тему Профессия Экономист История Олимпийских игр
История Олимпийских игр Индустрия питания. Предприятия общественного питания
Индустрия питания. Предприятия общественного питания Уральское таможенное управление_
Уральское таможенное управление_ Сказкотерапия как инновационная технология духовно-нравственного воспитания средствами авторской сказки
Сказкотерапия как инновационная технология духовно-нравственного воспитания средствами авторской сказки Настурция
Настурция Бешбармак по-казахски
Бешбармак по-казахски Презентация на тему Сахалин
Презентация на тему Сахалин  Плавание и его воздействие на развитие системы опорно-двигательного аппарата
Плавание и его воздействие на развитие системы опорно-двигательного аппарата Образование. Приоритетность (преобладающее значение) образования
Образование. Приоритетность (преобладающее значение) образования Презентация на тему Объединение земель
Презентация на тему Объединение земель Явление радиоактивности
Явление радиоактивности Как дружить без ссоры
Как дружить без ссоры Выразительность произведений великих художников Ивана Айвазовского и Ореста Адамовича Кипрейского
Выразительность произведений великих художников Ивана Айвазовского и Ореста Адамовича Кипрейского ПРЕЗЕНТАЦИЯ 7 «б» классаНАШИ ДОСТИЖЕНИЯ
ПРЕЗЕНТАЦИЯ 7 «б» классаНАШИ ДОСТИЖЕНИЯ «Использование компьютерных презентаций на уроках иностранного языка»
«Использование компьютерных презентаций на уроках иностранного языка» Идеальная бровь
Идеальная бровь