Содержание
- 2. ЦЕЛЬ: сформировать представление учащихся о кислороде, как химическом элементе и простом веществе. Задачи урока: - продолжить
- 3. Кислород. Оксиды. Горение. Общая характеристика. Химический знак – О Атомная масса Аr =16 Химическая формула О2
- 4. Нахождение в природе: Кислород – самый распространенный элемент в природе. В воздухе содержится – 20,9% В
- 5. История открытия Английский ученый Д. Пристли в 1774 году, изучая газы, проделал опыты с разложением оксида
- 6. Получение В лаборатории получают при реакции разложения сложных веществ: 2Н2 О ---- 2 Н2 + О2
- 7. Физические свойства Бесцветный газ, без вкуса, запаха, малорастворим в воде. При температуре -183 С –сжижается, а
- 8. Участвует в реакциях горения: С + О2 ----- С О 2 S + O2 ----- S
- 9. Оксиды Взаимодействие веществ с кислородом относится к реакциям окисления, образует оксиды. Оксиды – сложные вещества, которые
- 10. Применение кислорода В разных отраслях химической промышленности: Металлургии Сварка и резка металлов Ракетных двигателях Используется в
- 11. Обобщение урока
- 13. Скачать презентацию










 MadameTussaud’s Музей Восковых фигур Мадам Тюссо
MadameTussaud’s Музей Восковых фигур Мадам Тюссо Место учебного исследования в программе Intel «Обучение для будущего»
Место учебного исследования в программе Intel «Обучение для будущего» Потребительские кредиты
Потребительские кредиты Организация пастбищного содержания животных
Организация пастбищного содержания животных А
А Структура ВС РФ
Структура ВС РФ Северная Америка
Северная Америка «Как продолжается детство»
«Как продолжается детство» Молодые менеджеры и предприниматели Кубани
Молодые менеджеры и предприниматели Кубани Презентация на тему Углекислый газ СО2
Презентация на тему Углекислый газ СО2  Солнце воздух и вода – наши лучшие друзья
Солнце воздух и вода – наши лучшие друзья Лапта. История развития
Лапта. История развития Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз
Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз Презентация на тему Экологические кризисы и экологические катастрофы
Презентация на тему Экологические кризисы и экологические катастрофы История Громова Процессы на постсоветском пространстве
История Громова Процессы на постсоветском пространстве Шамшур
Шамшур Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности»
Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности» Тема урока
Тема урока Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс
Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс Презентация на тему Свет и его законы
Презентация на тему Свет и его законы  Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК
Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК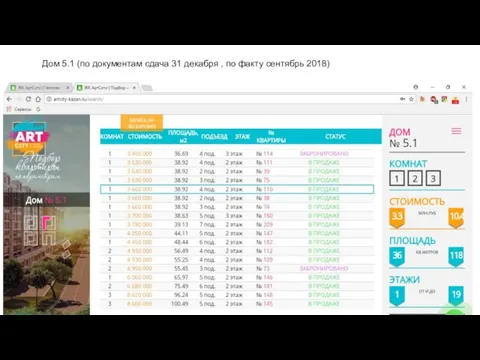 Art City. Подбор квартиры
Art City. Подбор квартиры Фалсафа - 5
Фалсафа - 5 врол
врол Бабаево – взгляд с любовью (городской путеводитель)
Бабаево – взгляд с любовью (городской путеводитель) Бесприборные тесты для подтверждения ВИЧ-Инфекции
Бесприборные тесты для подтверждения ВИЧ-Инфекции Техника безопасностииорганизация рабочего места
Техника безопасностииорганизация рабочего места Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).
Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).