- Главная
- Разное
- . ТЕОРЕТИЧЕСКОЕ РАССМОТРЕНИЕ ЭЛЕКТРОННОГО СТРОЕНИЯ АТОМА УГЛЕРОДА И ОТДЕЛЬНЫХ ОРГАНИЧЕСКИХ МОЛЕКУЛ

Содержание
- 2. вероятность нахождения электрона около ядра для различных атомных орбиталей: 1s орбиталь имеет один максимум, расстояние максимума
- 3. Молекулярные орбтали способность образовывать устойчивые соединения зависит от величины интеграла перекрытия ψ1(r), ψ2(r) — невозмущенные атомные
- 5. Гибридизация АО в С. Валентности атома С в различных соединениях (алканы, алкены, алкины). В основном состоянии
- 6. еще одно возбужденное состояние углерода связанно с sp2 гибридизацией. Гибридизация в этом случае происходит между 2
- 7. 2p 2sp рассмотрим последнее возбужденное состояние атома углерода — sp гибридизованное. В этом случае s орбиталь
- 8. главной особенностью атома С (также как и О и N) является способность к гибридизации и к
- 9. Несомненный интерес представляет бор(2s, 2р орбиталь c одним электроном), поскольку при образовании молекул в нем тоже
- 10. Ароматические углеводороды (с делокализованной системой - электронов) Результаты рентгеноструктурного и спектрального анализа показали, что все длины
- 11. Ароматические углеводороды с симметрией D 2h (осевой)— полиацены бензол C 6H 6- E g =6 эВ
- 12. Графит и графен В каждом слое расстояние между атомами одинаково и равно 1.42 Ǻ, расстояние между
- 13. Нанотрубки Нанотрубки- свернутые спиралью слои графита Стенки- гексагены, Шапочки- пентагоны и гексагены. Очень прочные (в электронном
- 14. Физические эксперименты, подтверждающие наличие делокализованной системы электронов в ароматических соединениях Физические эксперименты, подтверждающие наличие делокализованной системы
- 15. - сама молярная магнитная восприимчивость, связанна с кольцевым током, для бензола в перпендикулярном магнитном поле равна
- 17. Скачать презентацию
Слайд 2вероятность нахождения электрона около ядра для различных атомных орбиталей: 1s орбиталь имеет
вероятность нахождения электрона около ядра для различных атомных орбиталей: 1s орбиталь имеет

Радиальные волновые функции и плотность вероятности нахождения электрона для 2р и 3р атомных орбиталей.
в атоме кремния последней заполненной орбиталью является трехкратно вырожденная 3р орбиталь, вероятность нахождения электрона около ядра для этой орбитали имеет 2 максимума и один узел
Слайд 3 Молекулярные орбтали
способность образовывать устойчивые соединения зависит от величины интеграла перекрытия
ψ1(r),
Молекулярные орбтали
способность образовывать устойчивые соединения зависит от величины интеграла перекрытия
ψ1(r),

Слайд 5 Гибридизация АО в С. Валентности атома С в различных соединениях (алканы,
Гибридизация АО в С. Валентности атома С в различных соединениях (алканы,

В основном состоянии атом С двухвалентен — может образовывать ковалентную связь с двумя атомами Н, однако CH2 является нестабильным соединением, более стабильным оказывается метан — CH4. Как можно это обьяснить?
Наличие потенциала возмущения при образовании МО (от соседних атомов) приводит к гибридизации 2s и 2р АО. Гибридизация — способ образования АО с учетом отталкивания электронных пар валентной оболочки Ослабление отталкивания между электронными парами валентной оболочки достигается максимально возможным удалением этих пар друг от друга (две пары электронов в атоме располагаются под углом 180 между парами, три пары — под углом 120 и т.д.) Гибридизация 2s и всех трех 2р АО приводит к образованию 4 гибридных орбиталей с одинаковой энергией — каждая из них обозначается 2sp3 (2 означает главное квантовое число, а sp3 -указывает на то что орбиталь состоит на 1/4 из 2s-орбитали и на 3/4 из 2р-орбитали). Это приводит к 4 эквивалентным орбиталям с углами 109.5 между ними. Такая гибридизация обеспечивает минимальное отталкивание между 4 связывающими парами электронов в метане. гибридизация — это способ с помощью которого молекула принимает геометрию, обусловленную отталкиванием электронных пар валентной оболочки.
Класс соединеий, в которых С выступает в 2sp3 гибридизованном состоянии называется алканы (Сn H2n+2), к ним относятся метан (CH4), пропан полиэтилен, а также алмаз
Слайд 6 еще одно возбужденное состояние углерода связанно с sp2 гибридизацией. Гибридизация в
еще одно возбужденное состояние углерода связанно с sp2 гибридизацией. Гибридизация в
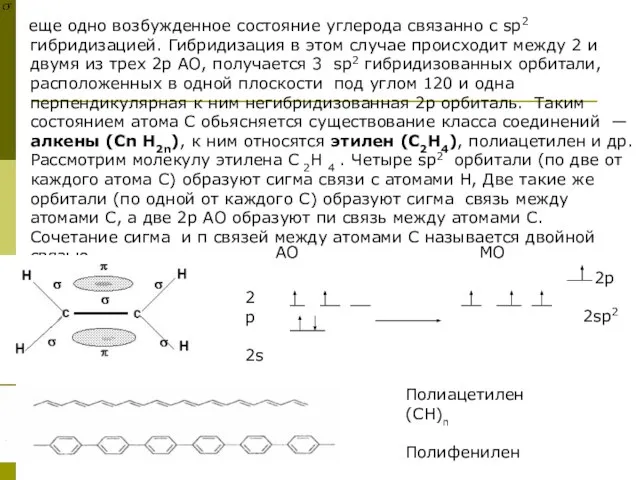
еще одно возбужденное состояние углерода связанно с sp2 гибридизацией. Гибридизация в этом случае происходит между 2 и двумя из трех 2р АО, получается 3 sp2 гибридизованных орбитали, расположенных в одной плоскости под углом 120 и одна перпендикулярная к ним негибридизованная 2р орбиталь. Таким состоянием атома С обьясняется существование класса соединений — алкены (Сn H2n), к ним относятся этилен (C2H4), полиацетилен и др. Рассмотрим молекулу этилена C 2H 4 . Четыре sp2 орбитали (по две от каждого атома С) образуют сигма связи с атомами Н, Две такие же орбитали (по одной от каждого С) образуют сигма связь между атомами С, а две 2р АО образуют пи связь между атомами С. Сочетание сигма и π связей между атомами С называется двойной связью.
2р
2s
2p
2sp2
Полиацетилен (СН)n
Полифенилен
АО МО
Слайд 72p
2sp
рассмотрим последнее возбужденное состояние атома углерода — sp гибридизованное. В этом случае
2p
2sp
рассмотрим последнее возбужденное состояние атома углерода — sp гибридизованное. В этом случае
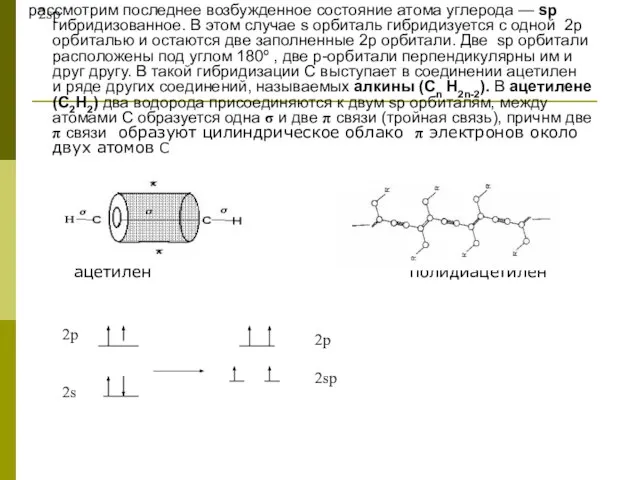
ацетилен полидиацетилен
2p
2sp
2p
2s
Слайд 8главной особенностью атома С (также как и О и N) является способность
главной особенностью атома С (также как и О и N) является способность
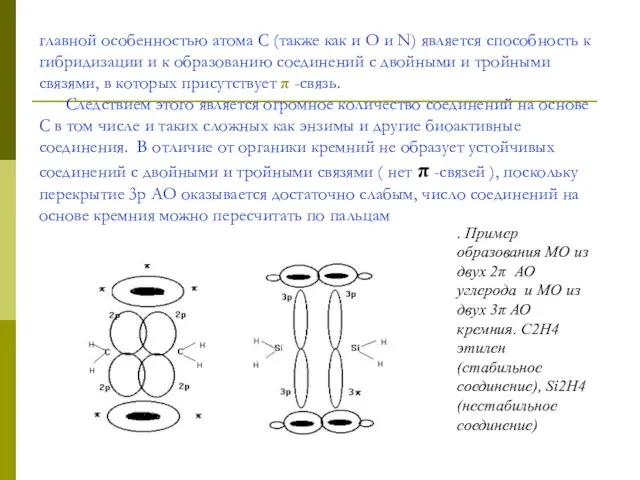
. Пример образования МО из двух 2π АО углерода и МО из двух 3π АО кремния. С2Н4 этилен (стабильное соединение), Si2Н4 (нестабильное соединение)
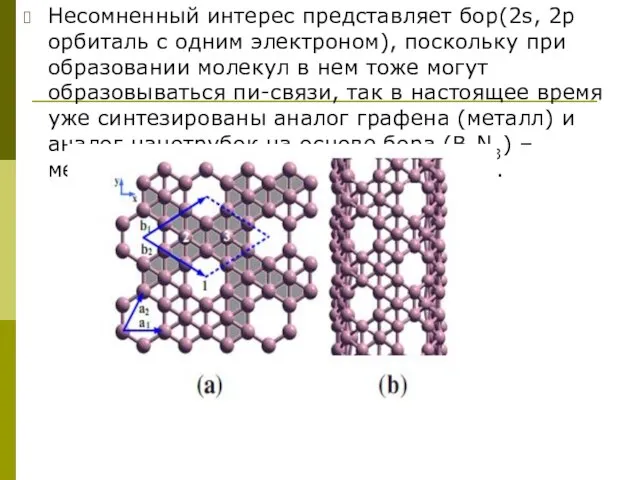
Слайд 9Несомненный интерес представляет бор(2s, 2р орбиталь c одним электроном), поскольку при образовании
Несомненный интерес представляет бор(2s, 2р орбиталь c одним электроном), поскольку при образовании
Слайд 10Ароматические углеводороды
(с делокализованной системой - электронов)
Результаты рентгеноструктурного и спектрального анализа показали, что
Ароматические углеводороды
(с делокализованной системой - электронов)
Результаты рентгеноструктурного и спектрального анализа показали, что

Метод ЛКАО дает 3 связывающих -орбитали (основных уровней) и 3 разрыхляющих орбитали. Связывающие орбитали по принципу Паули заполнены электронами с противоположными спинами. Зазор между ними равный ширине запрещенной зоны или двойному интегралу перекрытия -2t составляет 6 эВ.
Слайд 11Ароматические углеводороды с симметрией D 2h (осевой)— полиацены
бензол C 6H 6- E
Ароматические углеводороды с симметрией D 2h (осевой)— полиацены
бензол C 6H 6- E
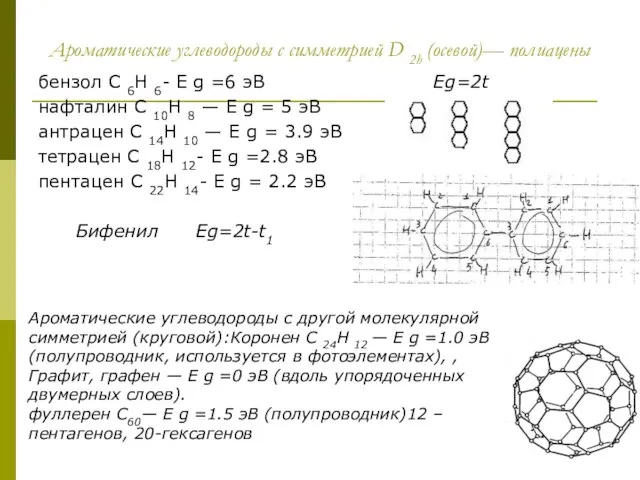
нафталин C 10H 8 — E g = 5 эВ
антрацен C 14H 10 — E g = 3.9 эВ
тетрацен C 18H 12- E g =2.8 эВ
пентацен C 22H 14- E g = 2.2 эВ
Бифенил Eg=2t-t1
Ароматические углеводороды с другой молекулярной симметрией (круговой):Коронен C 24H 12 — E g =1.0 эВ (полупроводник, используется в фотоэлементах), ,
Графит, графен — E g =0 эВ (вдоль упорядоченных двумерных слоев).
фуллерен C60— E g =1.5 эВ (полупроводник)12 –пентагенов, 20-гексагенов
Слайд 12Графит и графен
В каждом слое расстояние между атомами одинаково и равно 1.42
Графит и графен
В каждом слое расстояние между атомами одинаково и равно 1.42
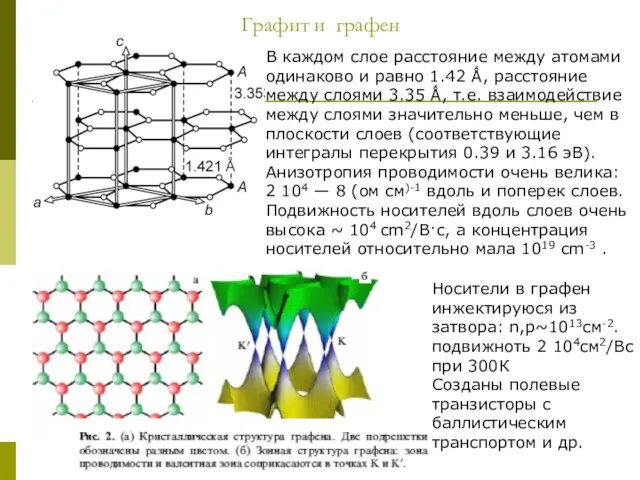
Носители в графен инжектируюся из затвора: n,р~1013см-2. подвижноть 2 104см2/Вс при 300К
Созданы полевые транзисторы с баллистическим транспортом и др.
Слайд 13Нанотрубки
Нанотрубки- свернутые спиралью слои графита Стенки- гексагены, Шапочки- пентагоны и гексагены. Очень
Нанотрубки
Нанотрубки- свернутые спиралью слои графита Стенки- гексагены, Шапочки- пентагоны и гексагены. Очень
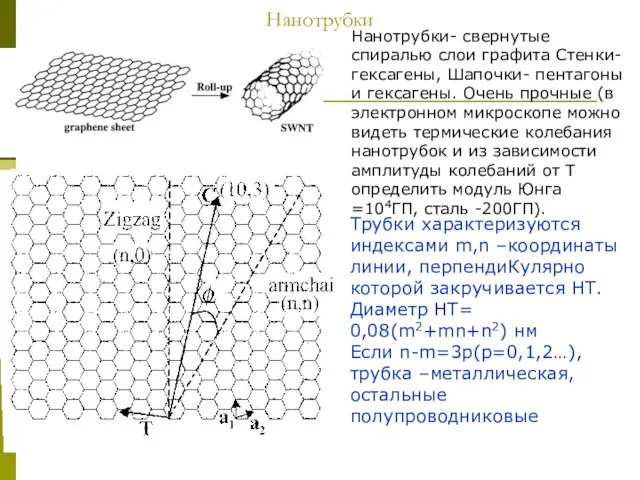
Трубки характеризуются индексами m,n –координаты линии, перпендиКулярно которой закручивается НТ.
Диаметр НТ=
0,08(m2+mn+n2) нм
Если n-m=3p(p=0,1,2…), трубка –металлическая, остальные полупроводниковые
Слайд 14Физические эксперименты, подтверждающие наличие делокализованной системы электронов в ароматических соединениях
Физические эксперименты, подтверждающие
Физические эксперименты, подтверждающие наличие делокализованной системы электронов в ароматических соединениях
Физические эксперименты, подтверждающие

ЯМР на бензоле
Самым распространенным критерием ароматичности является возникновение кольцевого тока при приложении внешнего магнитного поля. В молекуле бензола (вследствие делокализации электронов в виде колец над плоскостью молекулы и под ней) во внешнем магнитном поле Н0 возбуждается кольцевой ток, π −электроны начинают двигаться по замкнутому кругу
(Рис. 2.8). Этот ток в свою очередь, возбуждает аксиальное магнитное поле. В результате атомы Н находятся в более сильном поле и вступают в ЯМР (ядерный магнитный резонанс) при меньшем внешнем поле, что приводит к сдвигу соотвествуюшей линии ЯМР.
Величина сдвига δ, связанная с наличием кольцевого тока радиуса R:
,
где χ⊥ — магнитная восприимчивость в направлении перпендикулярном приложенному магнитному полю. Этот сдвиг для бензола равен1.46 м.д. (миллионные доли от рабочей частоты спектрометра) и соответствует теории при R=1.6Å (что равно радиусу молекулы бензола).
Слайд 15-
сама молярная магнитная восприимчивость, связанна с кольцевым током, для бензола в перпендикулярном
-
сама молярная магнитная восприимчивость, связанна с кольцевым током, для бензола в перпендикулярном
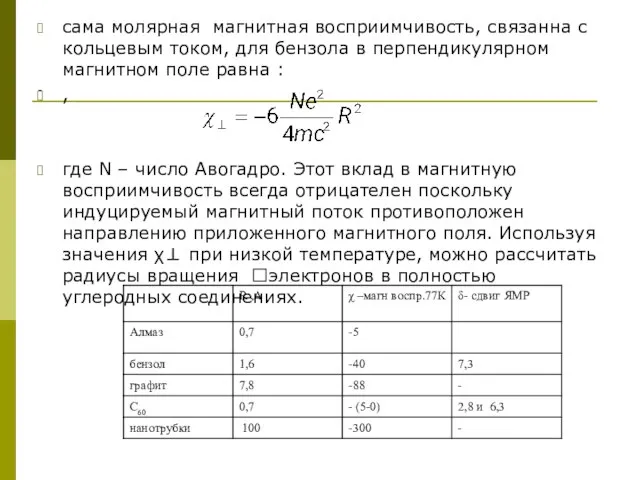
,
где N – число Авогадро. Этот вклад в магнитную восприимчивость всегда отрицателен поскольку индуцируемый магнитный поток противоположен направлению приложенного магнитного поля. Используя значения χ⊥ при низкой температуре, можно рассчитать радиусы вращения электронов в полностью углеродных соединениях.
 И.С.Тургенев: жизнь и творчество
И.С.Тургенев: жизнь и творчество Начальные годы создания Русского государства — Киевской Руси — можно соотнести с 862-882 гг.
Начальные годы создания Русского государства — Киевской Руси — можно соотнести с 862-882 гг. Учебно-методический пакет Здравствуй, лес, дремучий лес, Полный сказок и чудес!
Учебно-методический пакет Здравствуй, лес, дремучий лес, Полный сказок и чудес!  Реле переменного тока. Реле выдержки времени
Реле переменного тока. Реле выдержки времени Ипотечные ценные бумаги: перспективное направление развития рынка коллективных инвестиций.
Ипотечные ценные бумаги: перспективное направление развития рынка коллективных инвестиций. 20140928_prilozhenie
20140928_prilozhenie Анализ и качество автомобильной аудиотехники, реализуемой в торговом предприятии М-Видео
Анализ и качество автомобильной аудиотехники, реализуемой в торговом предприятии М-Видео Воронцова Елена Геннадьевна учитель русского языка и литературы Высшей квалификационной категории МОУ «Сиверская СОШ №3»
Воронцова Елена Геннадьевна учитель русского языка и литературы Высшей квалификационной категории МОУ «Сиверская СОШ №3» Государственный Эрмитаж
Государственный Эрмитаж Картограмма доступности маршрутной сети
Картограмма доступности маршрутной сети 2011 Год Италии в России
2011 Год Италии в России Презентация на тему Салтыков-Щедрин "Сказки"
Презентация на тему Салтыков-Щедрин "Сказки" Проект подготовлен учащейся І-А курса Чейлях Мариной.
Проект подготовлен учащейся І-А курса Чейлях Мариной. Как встречают Новый Год люди всех земных широт. История главного праздника в разных странах
Как встречают Новый Год люди всех земных широт. История главного праздника в разных странах Финансовый клуб ВШМ. Карьерные пути в финансах, введение в Investment Banking
Финансовый клуб ВШМ. Карьерные пути в финансах, введение в Investment Banking Бюджетирование, ориентированное на результат (БОР), и программно-целевые методы бюджетного планирования
Бюджетирование, ориентированное на результат (БОР), и программно-целевые методы бюджетного планирования Подчинительная связь слов в словосочетании
Подчинительная связь слов в словосочетании Искусственные Спутники Земли
Искусственные Спутники Земли Северный модерн
Северный модерн Типовые технологические процессы изготовления готовой продукции
Типовые технологические процессы изготовления готовой продукции Ландшафтный дизайн участка
Ландшафтный дизайн участка Годовой отчет группы Звездочка за 2020-21 уч. год
Годовой отчет группы Звездочка за 2020-21 уч. год Возможности человека
Возможности человека Презентация на тему Переход прилагательных в существительные
Презентация на тему Переход прилагательных в существительные Cisco Solution Technology Integrator Сетевая безопасность для вертикальных рынков Решения для банков и кредитно-финансовых организаций СТАНДАРТ С
Cisco Solution Technology Integrator Сетевая безопасность для вертикальных рынков Решения для банков и кредитно-финансовых организаций СТАНДАРТ С Колебания и волны
Колебания и волны Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Отчет о деятельности за 2011 год
Отчет о деятельности за 2011 год