Содержание
- 2. 1879р. Англійський хімік і фізик У. Крукс відкрив катодні промені, які пізніше були ідентифіковані як потік
- 3. 1895р. Німецький фізик Вільгельм Конрад Рентген (Нобелівський лауреат 1901) відкрив Х-промені, які виявились електромагнітним випромінюванням з
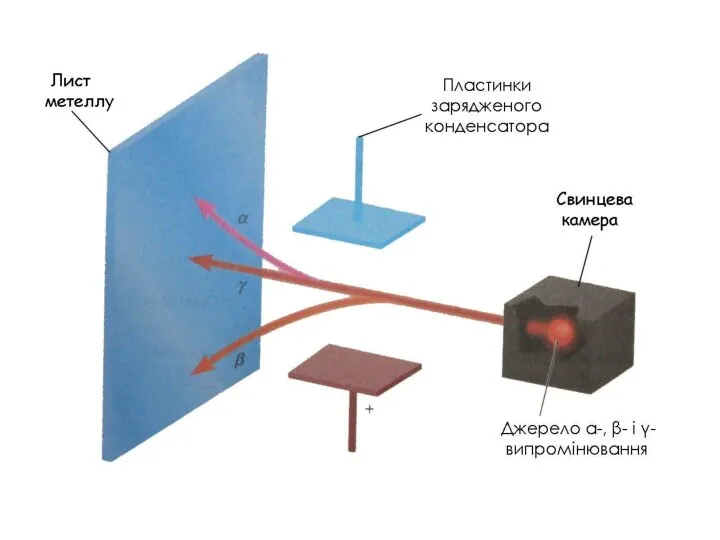
- 4. 1896р. Французький фізик Антуан Анрі Беккерель (Нобелівський лауреат 1903) відкрив явище природного радіоактивного розпаду і розділив
- 6. 1897р. Англійський фізик Джозеф Джон Томпсон відкрив електрон і за відхиленням пучка катодних променів у електричному
- 7. 1903р. Джон Томпсон запропонував кавуноподібну модель атома 1909р. Роберт Маллікен визначив заряд і масу електрону e
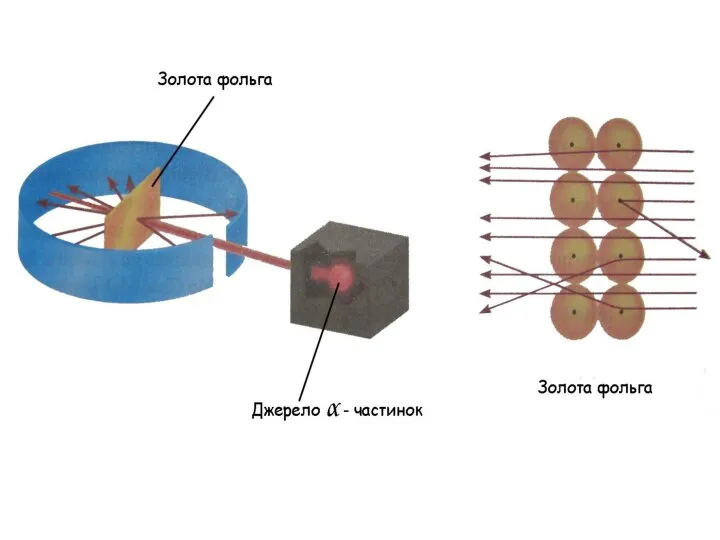
- 8. 1911р. Aнглійський фізик Ернест Резерфорд (Нобелівський лауреат 1918) використав α - промені для вивчення будови атому
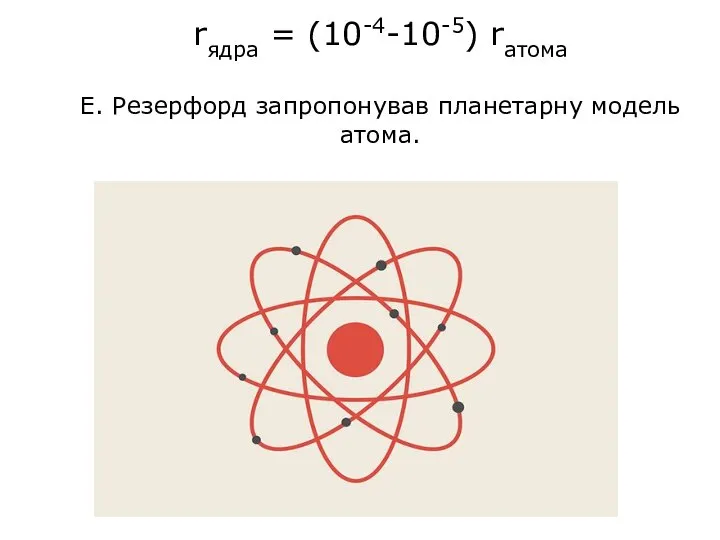
- 10. rядра = (10-4-10-5) rатома Е. Резерфорд запропонував планетарну модель атома.
- 11. Але дуже швидко теорія Резерфорда прийшла в протиріччя з багатьма експериментами. Чому електрон не падає на
- 12. 1913р. Видатний датський фізик–теоретик (Нобелівський лауреат 1922) запропонував на прикладі атому гідрогену модель атому, використавши для
- 13. E = h ∙ ν h = 6,67 ∙ 10-34 Дж/с (стала Планка) М.Планк – німецький
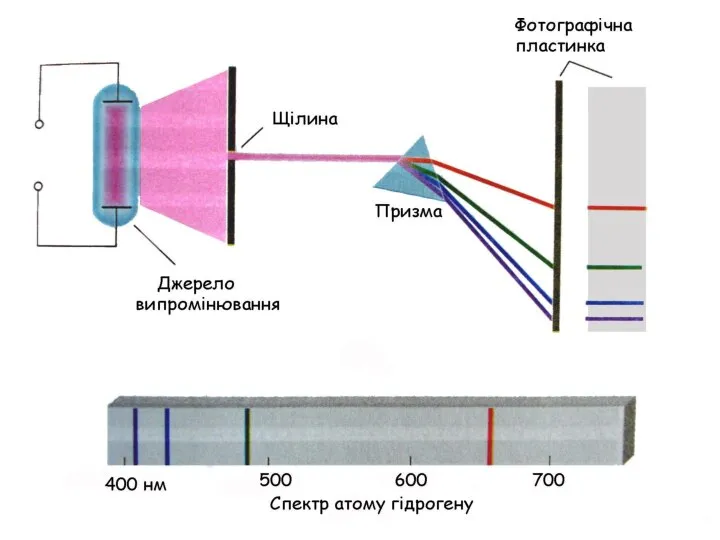
- 14. Поняття про спектр
- 18. Основні положення теорії Бора Атоми мають кулясту форму, електрони розміщуються навколо ядра атома шарами на стаціонарних
- 19. Перший постулат Бора: Електрон в атомі може обертатися лише по тих орбітах, на яких коловий момент
- 20. Другий постулат Бора: Під час стрибкоподібного переходу електрона з більш віддаленого квантового рівня на ближчу до
- 22. Теорія Н. Бора пояснила спектр атома Н, але виявилася неспроможною пояснити спектри більш складних атомів.
- 24. Хвильовий характер електрона 1924р. Французький вчений Луї де Бройль (Нобелівський лауреат 1929) висловив ідею про хвильову
- 25. М. Планк Енштейн
- 26. Студент m = 50кг v = 10 м/с Хвильовими властивостями великих об`єктів можна знехтувати. rатома ≈
- 27. Принцин невизначеності Гейзенберга Для мікрочастинок існує обмеження точності визначення положення Δх та імпульсу Δр. Визначити точно
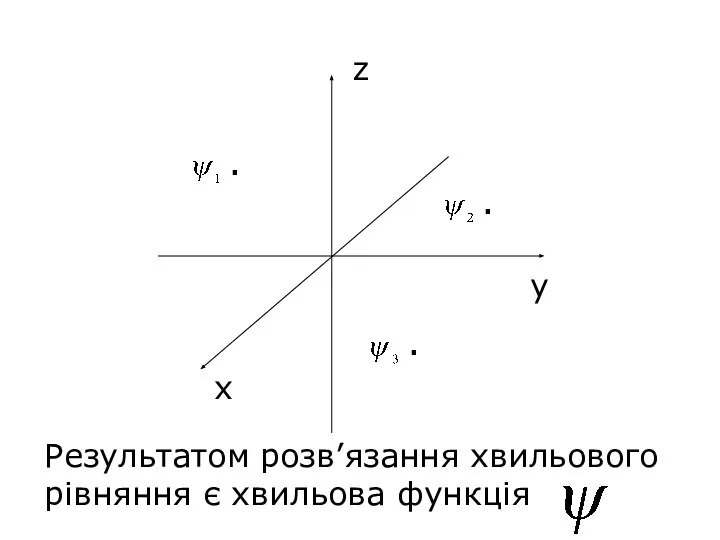
- 28. Хвильова механіка (теорія руху мікрочастинок) 1926р. Австрійський фізик Е. Шредінгер (Нобелівський лауреат 1933) запропонував описувати стан
- 29. х у z Результатом розв’язання хвильового рівняння є хвильова функція
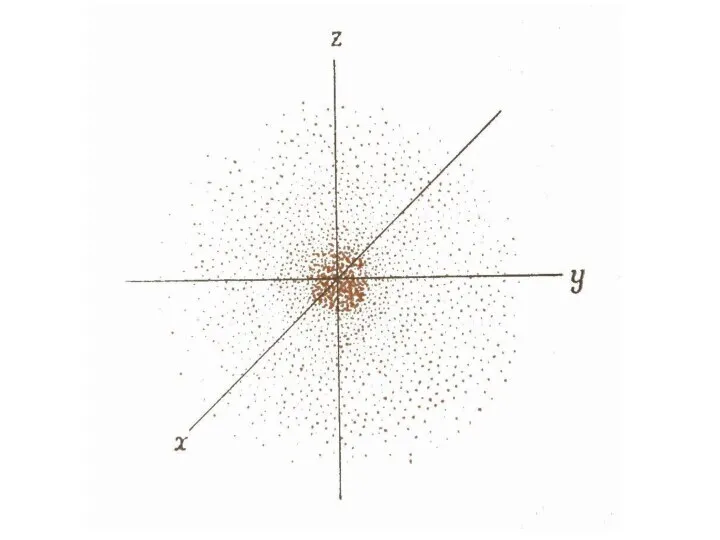
- 30. показує ймовірність (вірогідність) знаходження електрона в певному об’ємі простору навколо ядра, тобто електронну густину
- 31. Хвильова механіка не вказує швидкості руху електрону і його траєкторію, а лише ймовірність знаходження електрона в
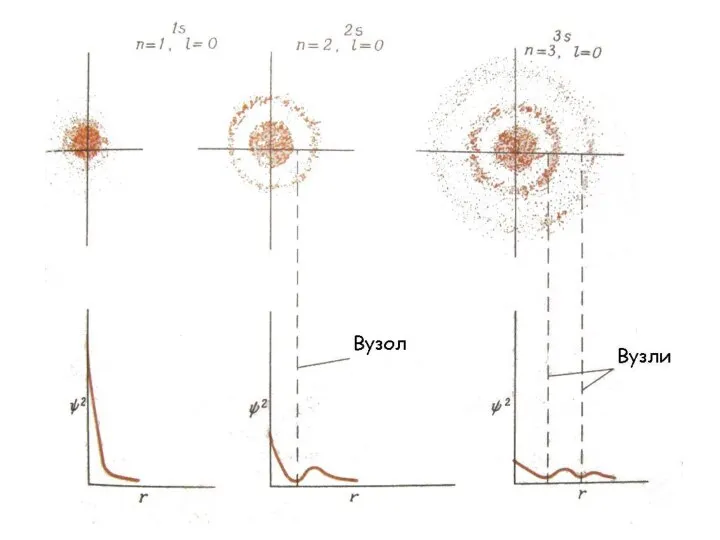
- 32. Хвильове рівняння має багато рішень, але стаціонарному стану електрона відповідає тільки одна дозволена комбінація трьох квантових
- 35. Квантові числа Головне квантове число n Головне квантове число n визначає енергетичний рівень та загальний запас
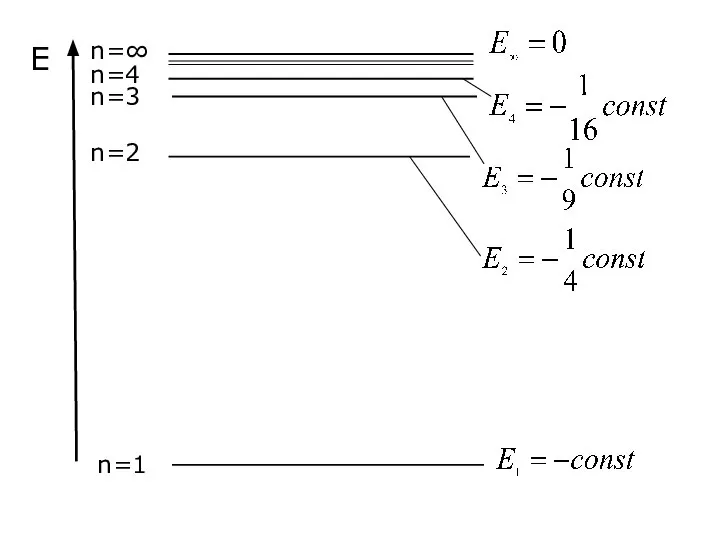
- 36. Залежність енергії електрона від головного квантового числа Е – це та енергія, яку необхідно витратити, щоб
- 37. Const для кожного атома своя і залежить від зряду ядра (Z) для атому Н
- 38. Е змінюється дискретно, оскільки n змінюється дискретно ......................................
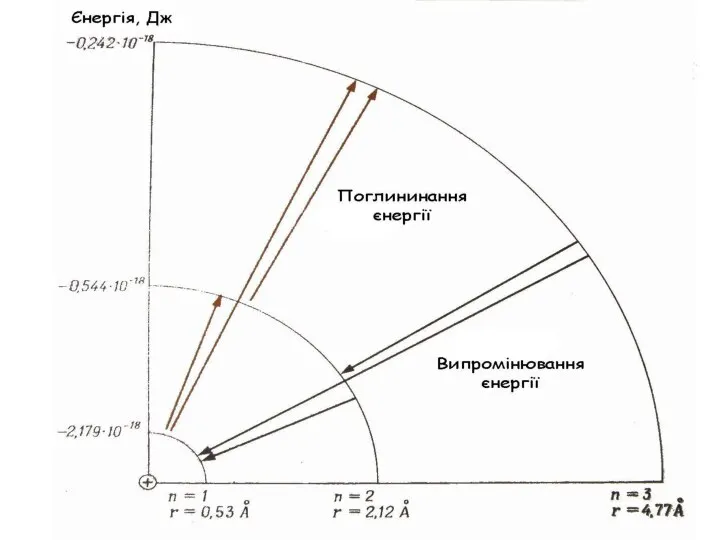
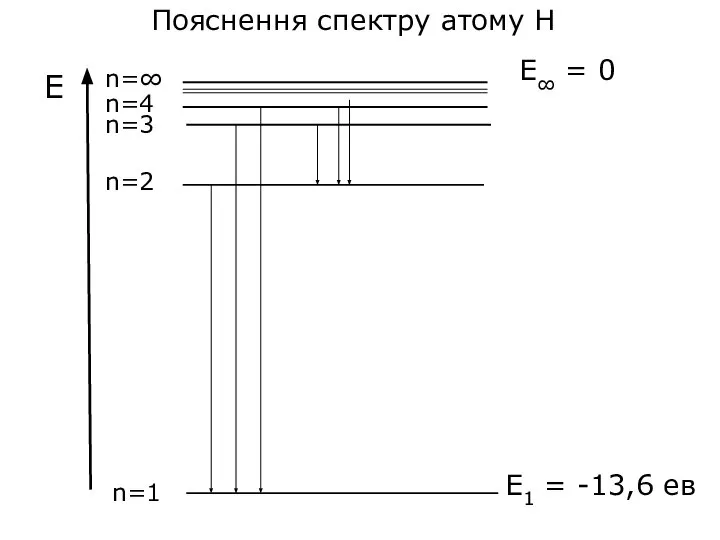
- 40. Пояснення спектру атому Н E∞ = 0 E1 = -13,6 ев
- 41. Переходи на К-рівень (2→1, 3→1, 4→1,...) К-серія ліній (Серія Лаймана) для Н знаходиться в ультрафіолетовій частині
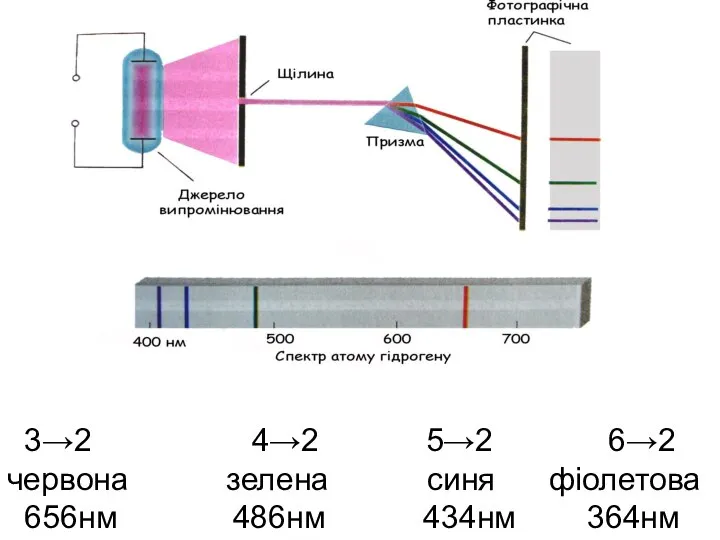
- 42. 3→2 4→2 5→2 6→2 червона зелена синя фіолетова 656нм 486нм 434нм 364нм
- 43. Для багатоелектронних атомів спектри виявлялися мультиплетними, а це означає, що енергія електрона залежить не тільки від
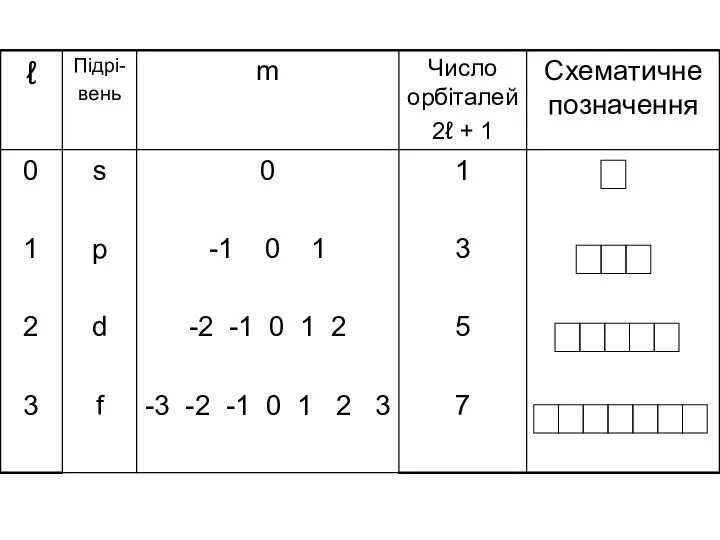
- 44. Орбітальне квантове число ℓ Орбітальне квантове число ℓ визначає підрівень. Орбітальне квантове число ℓ пов'язане з
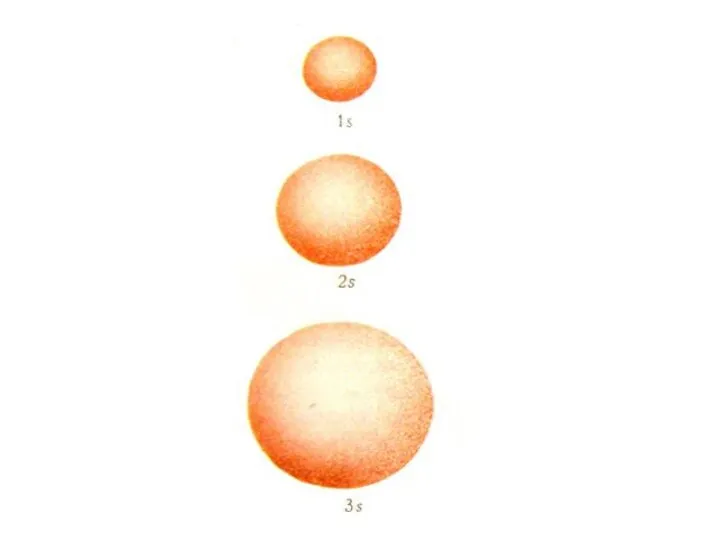
- 45. Від орбітального квантового числа залежить форма і енергія орбіталі n = 1 ℓ = 0(1s) n
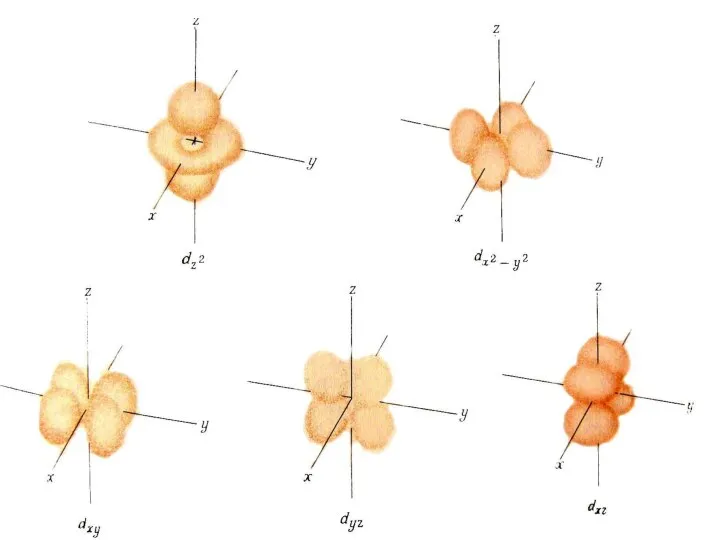
- 47. ℓ = 1 p- орбіталь
- 48. Магнітне квантове число m Магнітне квантове число m пов'язане з просторовою орієнтацією електронних орбіталей атома. Воно
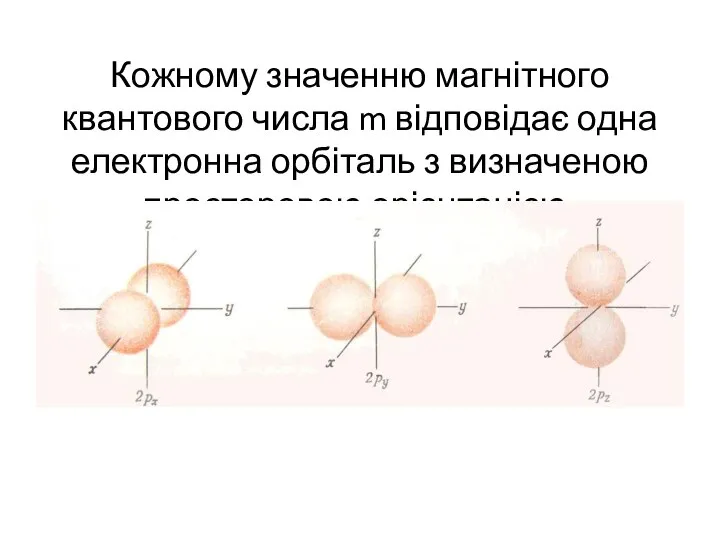
- 50. Кожному значенню магнітного квантового числа m відповідає одна електронна орбіталь з визначеною просторовою орієнтацією.
- 52. Кожній орбіталі певного підрівня відповідає визначений набір трьох квантових чисел { n, ℓ, m} 3p n
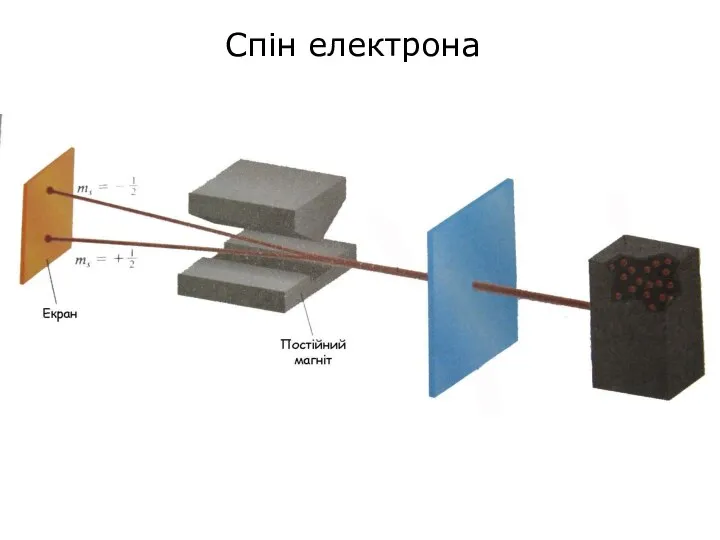
- 53. Спін електрона
- 54. Було встановлено, що електрон в атомі має власну фундаментальну властивість, яку назвали спіном. Спін виявляється в
- 55. Принцип Паулі 1924р. Німецький фізик В. Паулі сформулював важливий квантово-механічний закон, названий принципом заборони Паулі :
- 56. Фізичний зміст цього принципу полягає в тому, що в одному й тому самому місці простору два
- 58. Скачать презентацию


















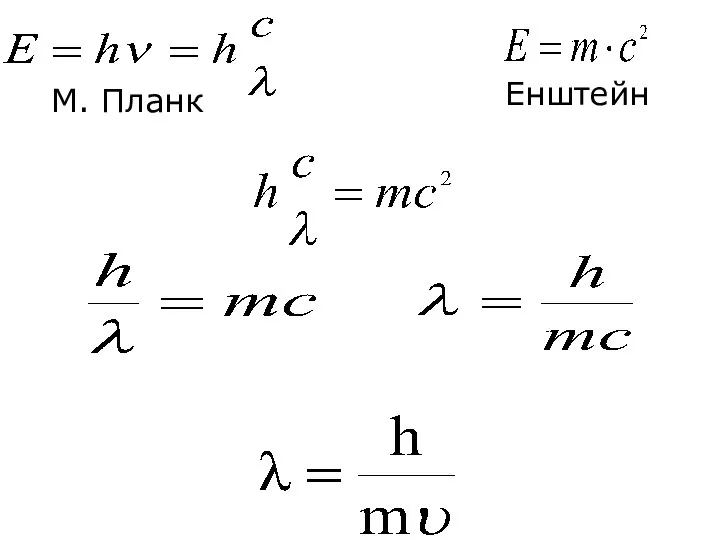














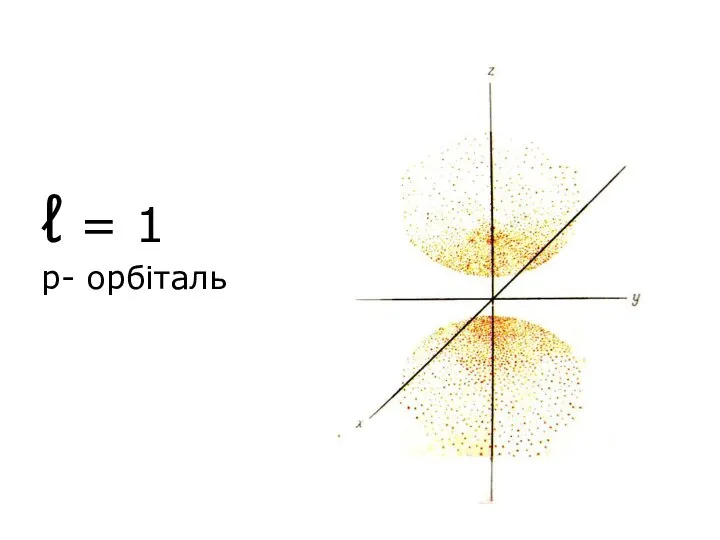





 Money, Banking, and Financial Institutions
Money, Banking, and Financial Institutions Немой кинематограф. Вклад Александра Петровича Довженко
Немой кинематограф. Вклад Александра Петровича Довженко Проектирование и экспертиза образовательных систем
Проектирование и экспертиза образовательных систем Грибы-паразиты и меры борьбы с ними
Грибы-паразиты и меры борьбы с ними Права людини
Права людини Дизайн
Дизайн Управление собственностью. Стратегический менеджмент
Управление собственностью. Стратегический менеджмент культуры клеток
культуры клеток Перспективы ядерной энергетики
Перспективы ядерной энергетики Геометрические тела и окружающий мир
Геометрические тела и окружающий мир Творчество Евгения Рачёва
Творчество Евгения Рачёва Презентация на тему Промышленные загрязнения
Презентация на тему Промышленные загрязнения  Аналитика: Управленческая отчетность руководителя
Аналитика: Управленческая отчетность руководителя Здравствуй, школа!
Здравствуй, школа! Строевая подготовка
Строевая подготовка Мониторинг здоровья у занимающихся физической культурой − путь к успеху
Мониторинг здоровья у занимающихся физической культурой − путь к успеху Palkin_G_A_novaya
Palkin_G_A_novaya Пушкин "У лукоморья дуб зеленый"
Пушкин "У лукоморья дуб зеленый" Структура комплекса энтомофагов опыленной сливово-злаковой тли (Hyalopterus pruni) в условиях Беларуси
Структура комплекса энтомофагов опыленной сливово-злаковой тли (Hyalopterus pruni) в условиях Беларуси Основы финансовых вычислений
Основы финансовых вычислений Обучение работе с Microsoft Excel
Обучение работе с Microsoft Excel Буллинг в школе
Буллинг в школе Сокращение дробей
Сокращение дробей НАШИ БЛИЖАЙШИЕ СОСЕДИ
НАШИ БЛИЖАЙШИЕ СОСЕДИ Квалификационные требования к специалистам и проектным организациям в
Квалификационные требования к специалистам и проектным организациям в  Презентация на тему Стили речи
Презентация на тему Стили речи Косметическая линейка ватной продукции и влажных салфеток
Косметическая линейка ватной продукции и влажных салфеток Галактики. Многообразие галактик
Галактики. Многообразие галактик