Содержание
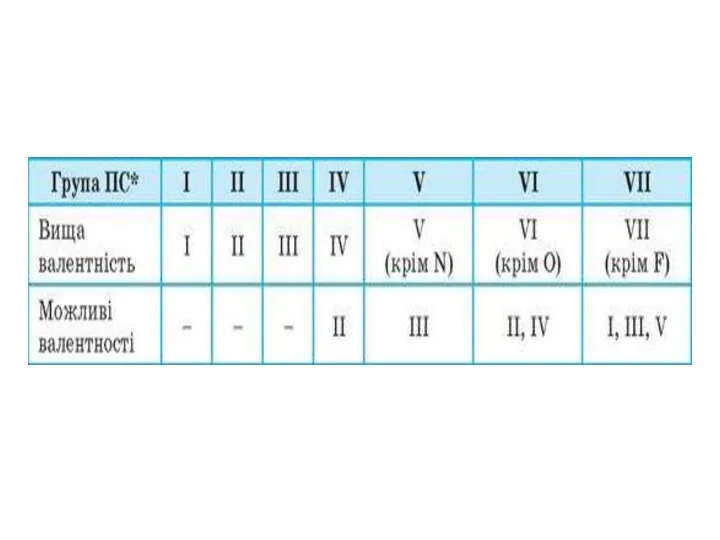
Слайд 2Скільки електронів може максимально перебувати на: а) одній атомній орбіталі; б) s-підрівні;
Скільки електронів може максимально перебувати на: а) одній атомній орбіталі; б) s-підрівні;

в) р-підрівні; г) d-підрівні?
Дайте визначення принципу найменшої енергії, правила Хунда, принципу Паулі. Схарактеризуйте їхнє значення для визначення розподілу електронів в електронній оболонці.
Що називають «неспареним електроном», «електронною парою»?
Чому перший енергетичний рівень заповнюється раніше за другий?
Наведіть порядок заповнення електронами підрівнів для перших чотирьох енергетичних рівнів.
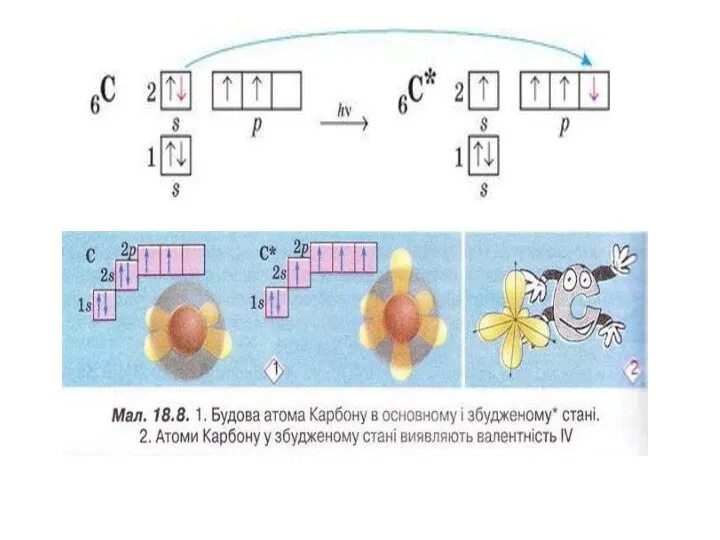
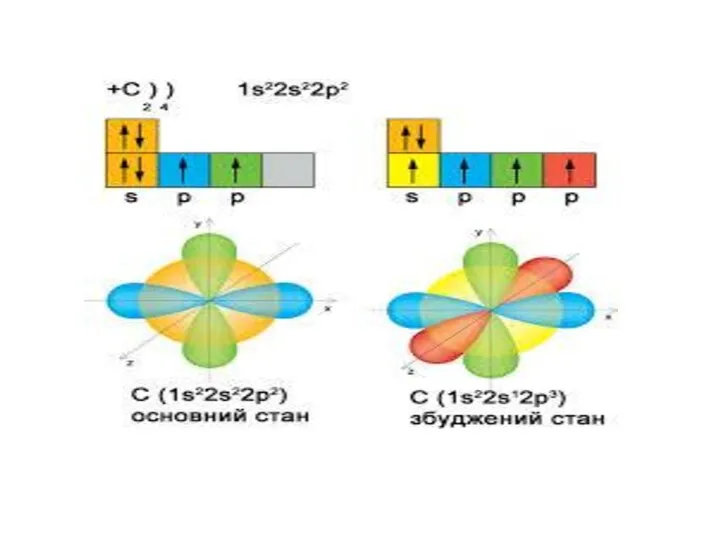
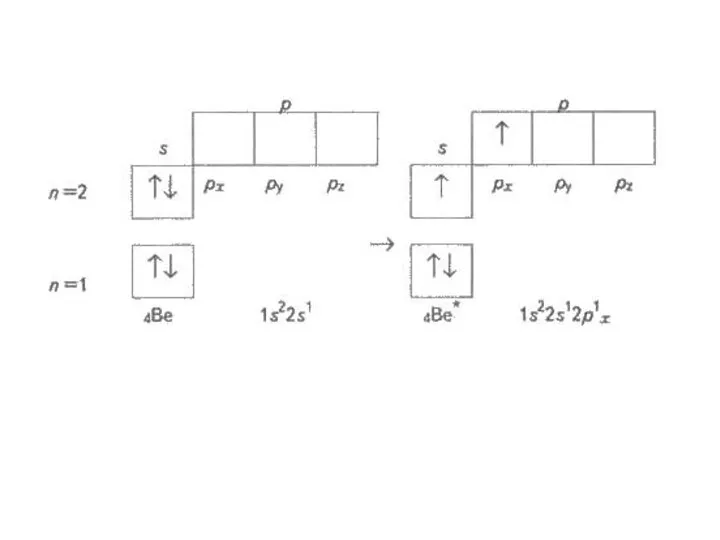
Чому в атомах Берилію електрони другого енергетичного рівня перебувають на s-орбіталі, а не на р-орбіталі?
Скільки енергетичних рівнів зайнято електронами в атомах: а) Натрію; б) Кальцію; в) Брому?
Дайте визначення принципу найменшої енергії, правила Хунда, принципу Паулі. Схарактеризуйте їхнє значення для визначення розподілу електронів в електронній оболонці.
Що називають «неспареним електроном», «електронною парою»?
Чому перший енергетичний рівень заповнюється раніше за другий?
Наведіть порядок заповнення електронами підрівнів для перших чотирьох енергетичних рівнів.
Чому в атомах Берилію електрони другого енергетичного рівня перебувають на s-орбіталі, а не на р-орбіталі?
Скільки енергетичних рівнів зайнято електронами в атомах: а) Натрію; б) Кальцію; в) Брому?
Слайд 3Пригадаємо, що таке:
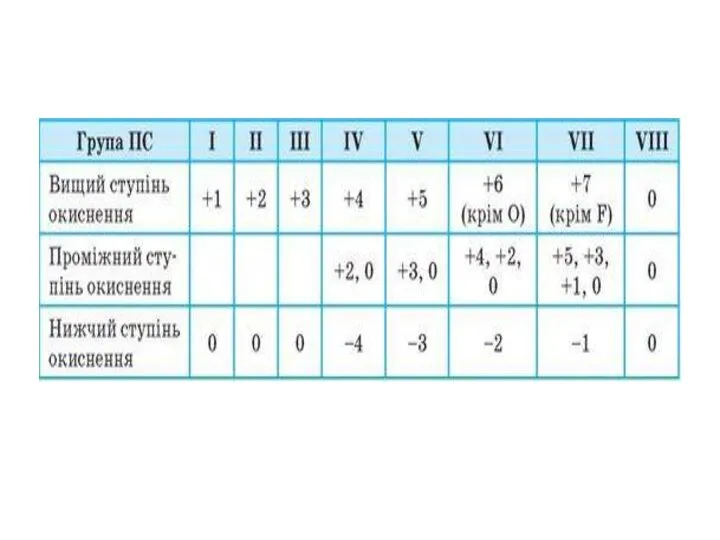
Валентність –
Ступінь окиснення –
Електронегативність -
Пригадаємо, що таке:
Валентність –
Ступінь окиснення –
Електронегативність -

- Предыдущая
Федеральные меры поддержки субъектов МСПСледующая -
Задачи с дробями
























 Подснежник для мамы
Подснежник для мамы Внутрикорпоративный имидж и его влияние на приверженность сотрудников организации на примере ООО «Милко»
Внутрикорпоративный имидж и его влияние на приверженность сотрудников организации на примере ООО «Милко» Циклы и кризисы
Циклы и кризисы Рождество в разных странах. Традиции
Рождество в разных странах. Традиции Архетипы. Коллаж
Архетипы. Коллаж Основы фотографии и построения кадра
Основы фотографии и построения кадра Present Simple and so on
Present Simple and so on Вербальные и невербальные средства общения
Вербальные и невербальные средства общения Пирамида потребностей А. Маслоу и его вклад в развитие школы поведенческих наук
Пирамида потребностей А. Маслоу и его вклад в развитие школы поведенческих наук Презентация на тему Economic system (Экономическая система)
Презентация на тему Economic system (Экономическая система) Торнадо любви. Направление Личные Цели
Торнадо любви. Направление Личные Цели Pop art
Pop art Произведения, созданные в XIX веке, впечатлили меня сильнее литературы других времен
Произведения, созданные в XIX веке, впечатлили меня сильнее литературы других времен Правительство и конституция США
Правительство и конституция США Творчество Б.Л.Пастернака
Творчество Б.Л.Пастернака 1
1 Презентация на тему Колебательный контур, свободные и вынужденные колебания, резонанс
Презентация на тему Колебательный контур, свободные и вынужденные колебания, резонанс  Микросхемы CML для цифровой телефонии
Микросхемы CML для цифровой телефонии Слагаемые успеха в бизнесе
Слагаемые успеха в бизнесе Тренажер. Історічні дати (2 частина)
Тренажер. Історічні дати (2 частина) Эффективность освещения автомобиля
Эффективность освещения автомобиля Кинематика резания
Кинематика резания Деловые коммуникации
Деловые коммуникации Общевоинские уставы. Порядок хранения оружия и боеприпасов
Общевоинские уставы. Порядок хранения оружия и боеприпасов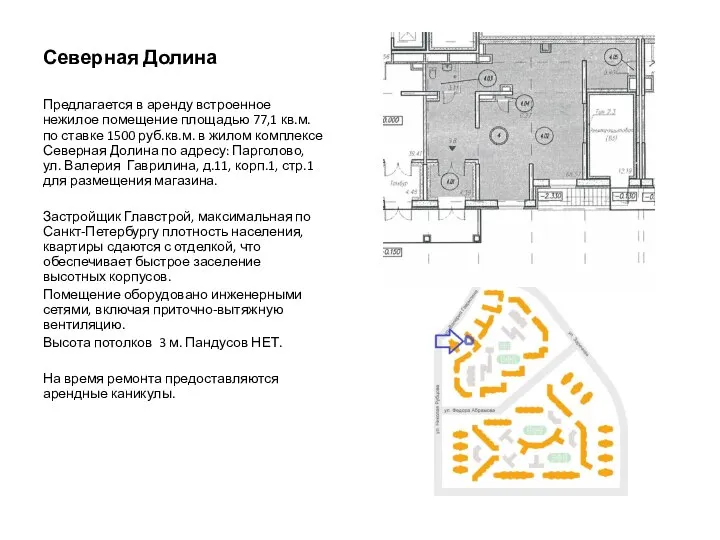 Северная Долина. Аренда встроенного нежилого помещения
Северная Долина. Аренда встроенного нежилого помещения История росписи по телу
История росписи по телу Агломерация как системный подход к развитию монопрофильных территорий
Агломерация как системный подход к развитию монопрофильных территорий Проценты в нашей жизни
Проценты в нашей жизни