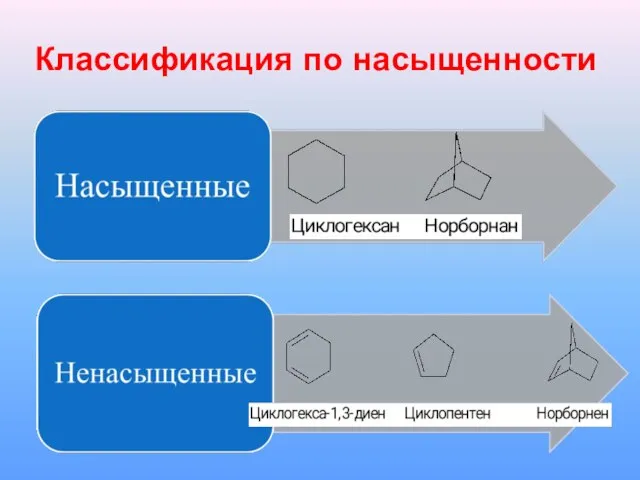
Слайд 2Классификация по насыщенности
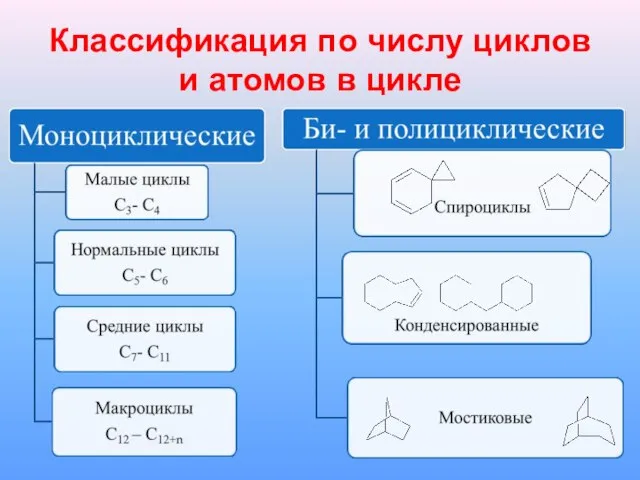
Слайд 3Классификация по числу циклов и атомов в цикле
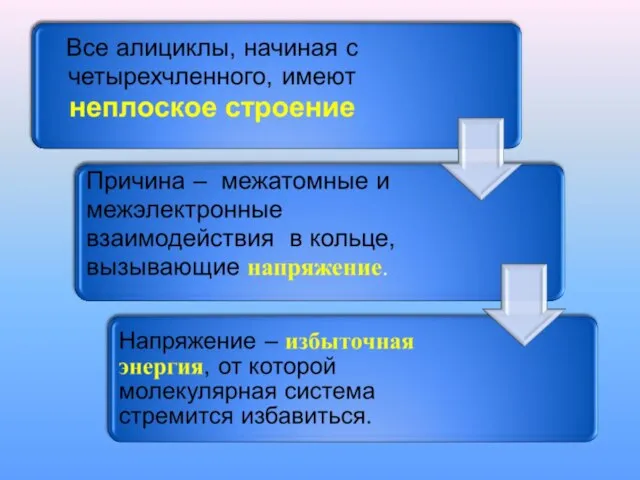
Слайд 6НАПРЯЖЕНИЕ В ЦИКЛОАЛКАНАХ
Энергия напряжения, кДж/моль
Циклопропан 37,7
Циклобутан 28,4
Циклопентан 5,0
Циклогексан 0
Циклогептан

3,7
Циклооктан 5,1
Циклононан 5,9
Циклодекан 5,0
Циклоундекан 4,2
Циклододекан 1,25
Циклотридекан 1,7
Циклотетрадекан 0
Циклопентадекан 0,4
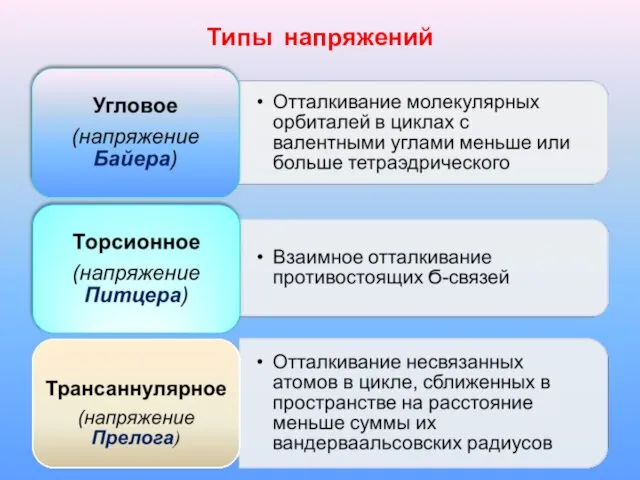
Слайд 8Угловое напряжение:
в циклопропане снимается за счет образования изогнутых банановых связей (орбитали перекрываются
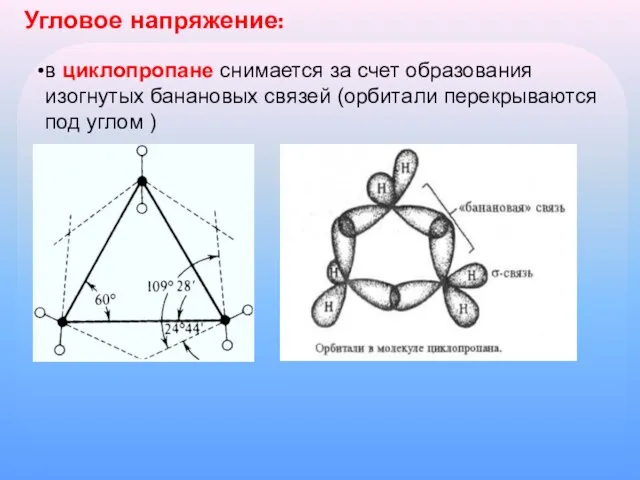
под углом )
Слайд 9Торсионное напряжение.
обусловлено взаимным отталкиванием противостоящих Ϭ-связей в циклах;
максимальное в заслоненной конформации
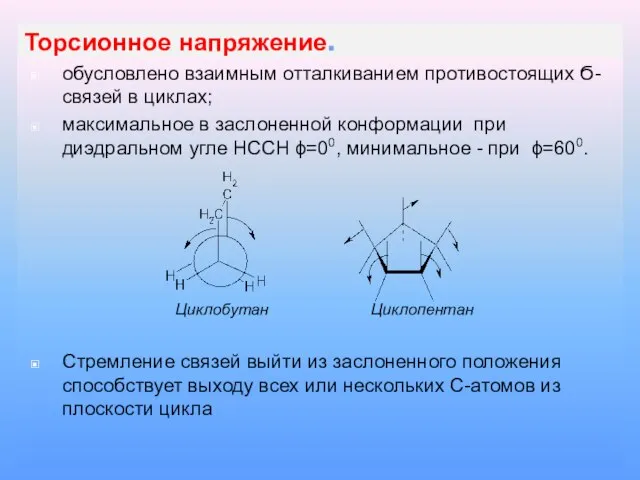
при диэдральном угле НССН ϕ=00, минимальное - при ϕ=600.
Циклобутан Циклопентан
Стремление связей выйти из заслоненного положения способствует выходу всех или нескольких С-атомов из плоскости цикла
Слайд 10
Для циклобутана
- характерно угловое, торсионное и трансаннулярное напряжения;
- выделяют складчатую и плоскую
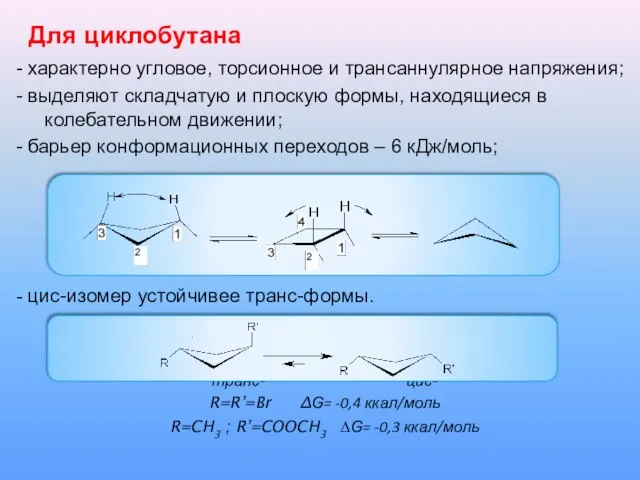
формы, находящиеся в колебательном движении;
- барьер конформационных переходов – 6 кДж/моль;
- цис-изомер устойчивее транс-формы.
транс- цис-
R=R’=Br ∆Ԍ= -0,4 ккал/моль
R=CH3 ; R’=COOCH3 ∆Ԍ= -0,3 ккал/моль
Слайд 11
Для циклопентана
характерно торсионное и несущественное угловое напряжение;
- различают форму конверта
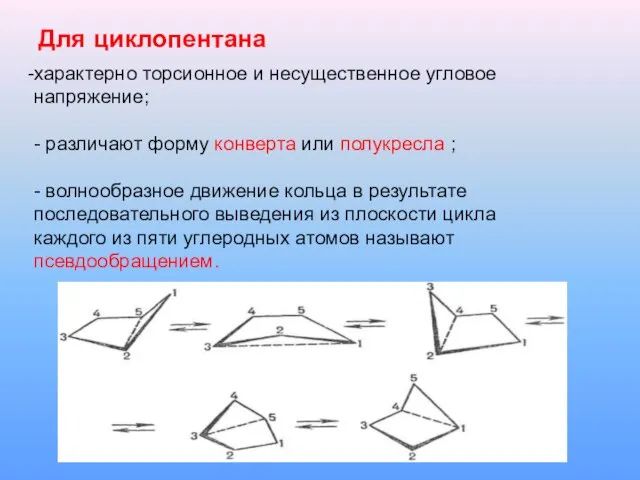
или полукресла ;
- волнообразное движение кольца в результате последовательного выведения из плоскости цикла
каждого из пяти углеродных атомов называют псевдообращением.
Слайд 12Для циклогексана
характерна инверсия конформаций “кресло – кресло”, при этом аксиальные связи становятся
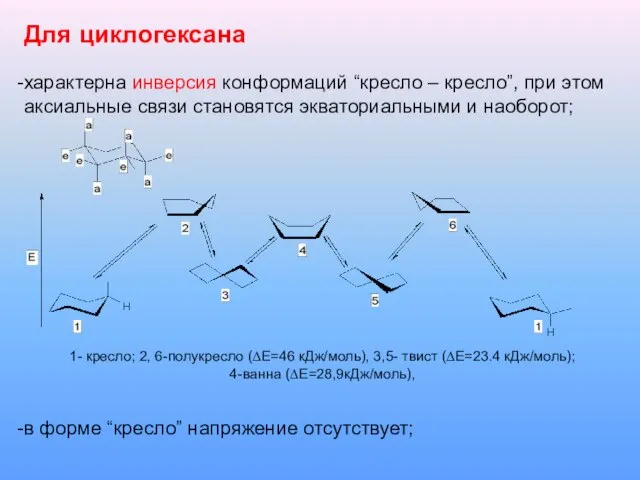
экваториальными и наоборот;
1- кресло; 2, 6-полукресло (∆Е=46 кДж/моль), 3,5- твист (∆Е=23.4 кДж/моль);
4-ванна (∆Е=28,9кДж/моль),
в форме “кресло” напряжение отсутствует;
Слайд 13Для циклогексана
пребывание заместителя в аксиальном положении невыгодно из-за вандерваальсовского напряжения з
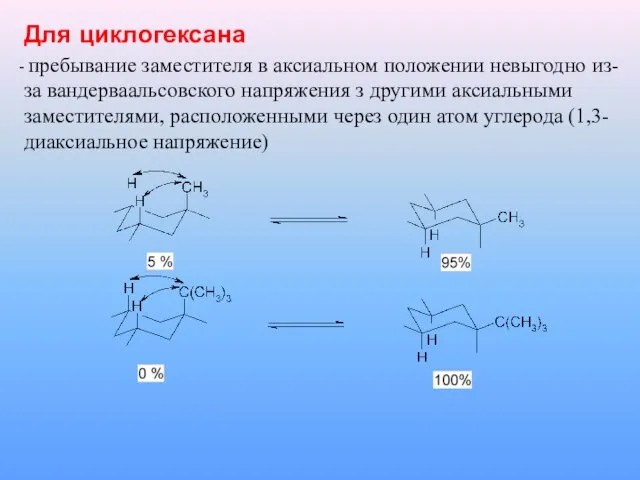
другими аксиальными заместителями, расположенными через один атом углерода (1,3-диаксиальное напряжение)
Слайд 14Для циклогептана
- выделяют четыре конформации;
«Кресло» «Твист-кресло» «Твист-ванна» «Ванна»
- наиболее стабильна форма
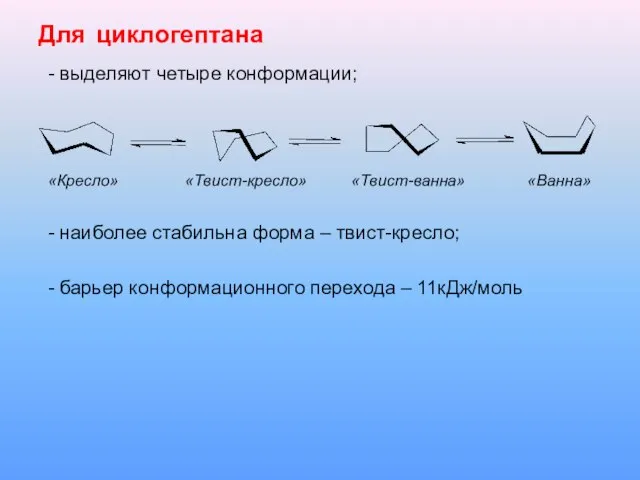
– твист-кресло;
- барьер конформационного перехода – 11кДж/моль
Слайд 15Методы получения циклоалканов
1. Внутримолекулярная реакция Вюрца.
С хорошими выходами получают циклопропан,
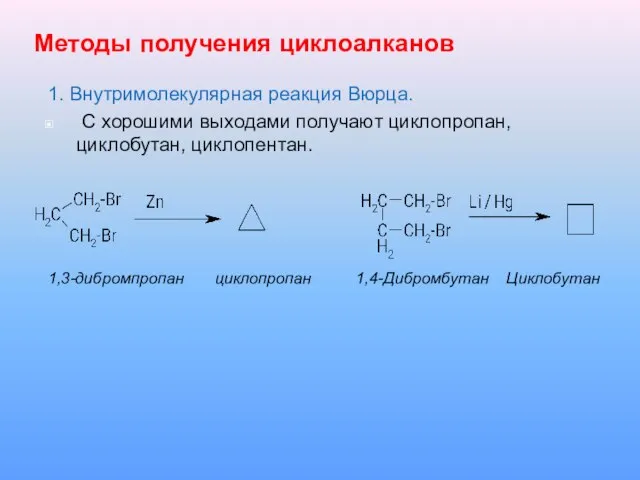
циклобутан, циклопентан.
1,3-дибромпропан циклопропан 1,4-Дибромбутан Циклобутан
Слайд 16Методы получения циклоалканов
2. Реакция Перкина. Взаимодействие натрий малонового эфира с α,ω-дигалогеналканами.
2 С2Н5ОNa
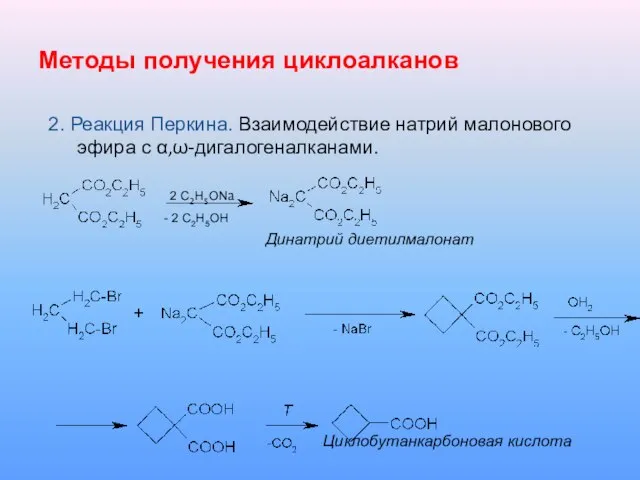
- 2 С2Н5ОН
Динатрий диетилмалонат
Циклобутанкарбоновая кислота
Слайд 17Методы получения циклоалканов
3. Метод Ружичка. Декарбоксилирование бариевых, ториевых или кальциевых солей дикарбоновых
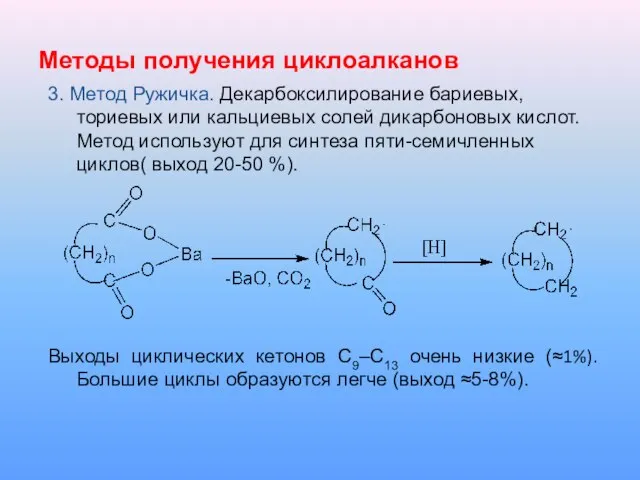
кислот. Метод используют для синтеза пяти-семичленных циклов( выход 20-50 %).
Выходы циклических кетонов С9–С13 очень низкие (≈1%). Большие циклы образуются легче (выход ≈5-8%).
Слайд 18Методы получения циклоалканов
4. Циклизация динитрилов по Торпу-Циглеру. Метод удобен для синтеза циклических
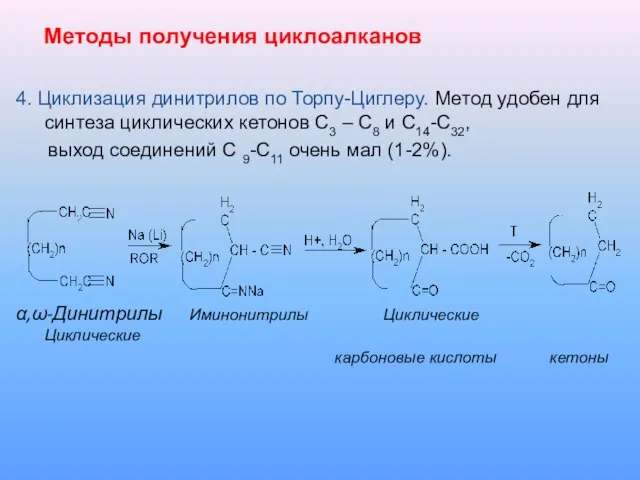
кетонов С3 – С8 и С14-С32,
выход соединений С 9-С11 очень мал (1-2%).
α,ω-Динитрилы Иминонитрилы Циклические Циклические
карбоновые кислоты кетоны
Слайд 19Методы получения циклоалканов
5. Сложноэфирная внутримолекулярная конденсация Дикмана. Эфиры α,ω-дикарбоновых кислот в присутствии
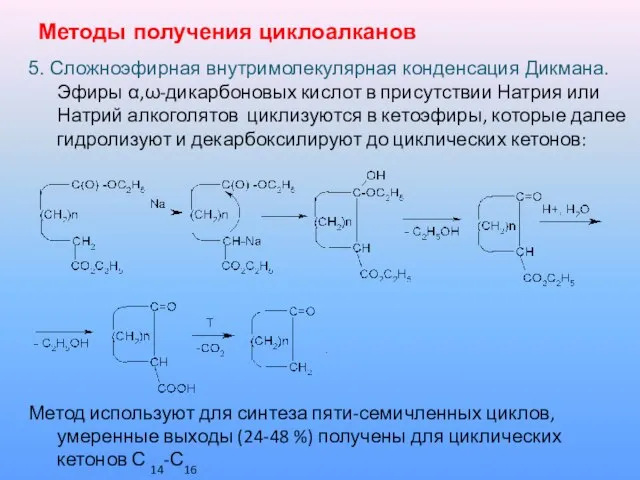
Натрия или Натрий алкоголятов циклизуются в кетоэфиры, которые далее гидролизуют и декарбоксилируют до циклических кетонов:
Метод используют для синтеза пяти-семичленных циклов, умеренные выходы (24-48 %) получены для циклических кетонов С 14-С16
Слайд 20Методы получения циклоалканов
6. Ацилоиновая конденсация. Эфиры α,ω-дикарбоновых кислот в присутствии избытка Натрия
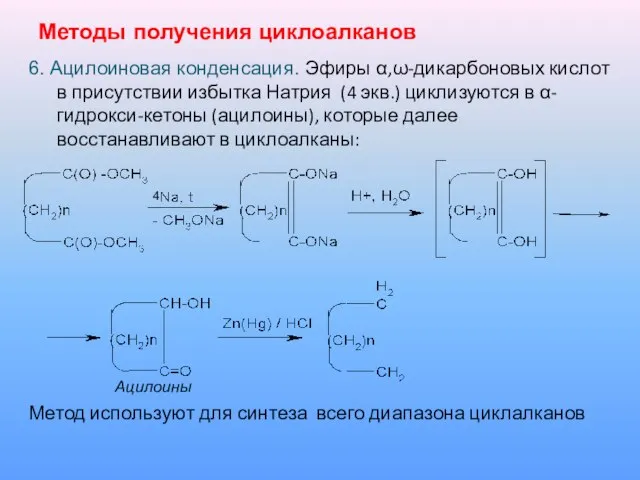
(4 экв.) циклизуются в α-гидрокси-кетоны (ацилоины), которые далее восстанавливают в циклоалканы:
4
Ацилоины
Метод используют для синтеза всего диапазона циклалканов
Слайд 21Методы получения циклоалканов
7. Разширение циклов в циклокетонах. Реакция внедрения метиленкарбена по циклической
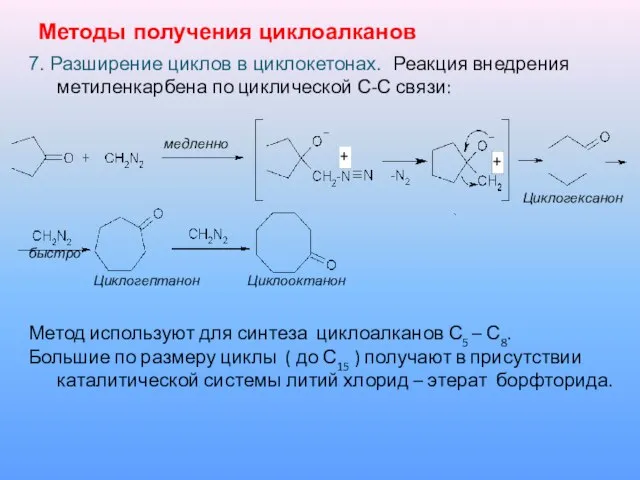
С-С связи:
медленно
Циклогексанон
быстро
Циклогептанон Циклооктанон
Метод используют для синтеза циклоалканов С5 – С8.
Большие по размеру циклы ( до С15 ) получают в присутствии каталитической системы литий хлорид – этерат борфторида.
Слайд 22Химические свойства циклоалканов
Циклопропан в химических процессах напоминает этилен, вступая в реакции присоединения

с раскрытием цикла.
Для циклобутана и других гомологов характерны реакции радикального замещения с разрывом С-Н связей (нитрование, галогенирование, сульфохлорирование), исключение - процесс гидрирования с раскрытием цикла.
Все циклоалканы устойчивы к действию окислителей и окисляются лишь в жестких условиях
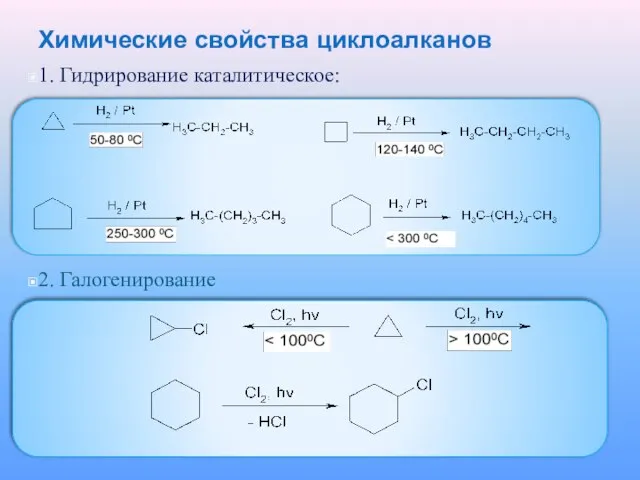
Слайд 23Химические свойства циклоалканов
1. Гидрирование каталитическое:
2. Галогенирование
Слайд 24Химические свойства циклоалканов
3.Гидрогалогенирование циклопропана.
Для замещенных циклопропанов процесс протекает формально по правилу
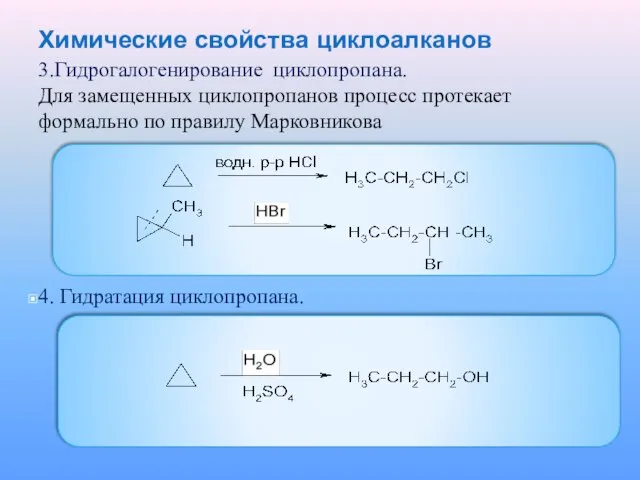
Марковникова
4. Гидратация циклопропана.
Слайд 25Химические свойства циклоалканов
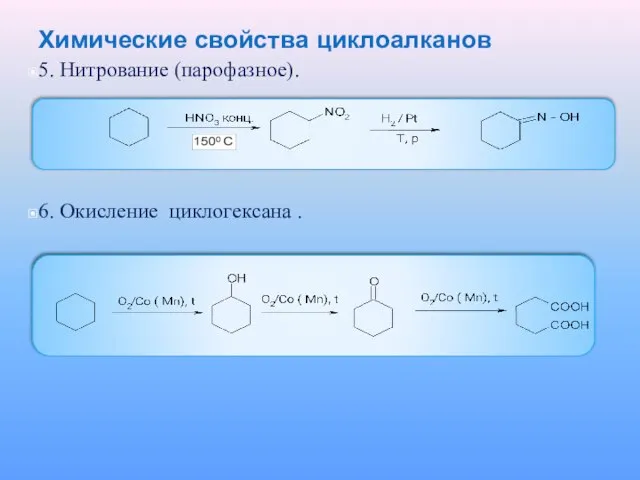
5. Нитрование (парофазное).
6. Окисление циклогексана .





















 Восприятие (перцепция)
Восприятие (перцепция) Презентация на тему Здоровьесберегающая среда классной комнаты
Презентация на тему Здоровьесберегающая среда классной комнаты Этапы развития жизни на Земле
Этапы развития жизни на Земле Программы повышения результативности персонала
Программы повышения результативности персонала Основные документы
Основные документы Кружок «Юный музеевед»
Кружок «Юный музеевед» Содержание и проблемы реализации государственной программы Доступная среда для инвалидов и людей с ограниченными возможностями
Содержание и проблемы реализации государственной программы Доступная среда для инвалидов и людей с ограниченными возможностями Решения FTTx
Решения FTTx Игуана
Игуана Презентация на тему Лагеря смерти
Презентация на тему Лагеря смерти  Портал (правки)
Портал (правки) Цель Конкурса – выявление и распространение инновационного педагогического опыта в области преподавания физической культуры и ф
Цель Конкурса – выявление и распространение инновационного педагогического опыта в области преподавания физической культуры и ф Пожертвования
Пожертвования Политика качества
Политика качества Односоставные предложения в произведениях Ивана Алексеевича Бунина
Односоставные предложения в произведениях Ивана Алексеевича Бунина Азаматтық іс жүргізудегі үшінші түлғалар
Азаматтық іс жүргізудегі үшінші түлғалар Каток под открытым небом
Каток под открытым небом От повышения качества обучения школьников к повышению доходов педагогов
От повышения качества обучения школьников к повышению доходов педагогов Основные факторы, влияющие на электоральное поведение граждан
Основные факторы, влияющие на электоральное поведение граждан Исследовательский проект«Река Ихаланийоки»
Исследовательский проект«Река Ихаланийоки» Углы, связанные с окружностью
Углы, связанные с окружностью Презентация на тему Фольклор урок
Презентация на тему Фольклор урок  ЦЕНТР МЕЖДУНАРОДНОГООБРАЗОВАНИЯ (ЦМО) СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
ЦЕНТР МЕЖДУНАРОДНОГООБРАЗОВАНИЯ (ЦМО) СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Органы государственной власти
Органы государственной власти Фотография. Искусство фотопейзажа и интерьера. Видео. Правила съёмки пейзажа
Фотография. Искусство фотопейзажа и интерьера. Видео. Правила съёмки пейзажа Презентация на тему Киевское и Черниговское княжества
Презентация на тему Киевское и Черниговское княжества Семинар Мобильные приложения 4.10.22
Семинар Мобильные приложения 4.10.22 Презентация на тему Происхождение и эволюция человека
Презентация на тему Происхождение и эволюция человека