Содержание
- 2. Содержание Алкены Номенклатура Изомерия Физические свойства Строение алкенов Химические свойства (Химические свойства (реакции присоединения: галогенирование, Химические
- 3. Алкены Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну двойную связь и
- 4. Номенклатура Название алкенов по систематической номенклатуре образуют из названий аналогично построенных алканов, заменяя суффиксы –ан на
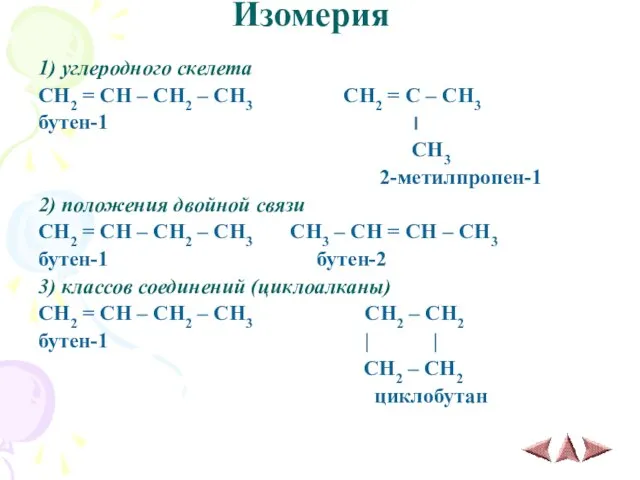
- 5. Изомерия 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 = C – CH3
- 6. 4) пространственная CH3 H H H \ / \ / C = C C = C
- 7. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 –
- 8. Строение алкенов Углеродные атомы в молекуле этилена находятся в состоянии sp2-гибридизации, т.е. в гибридизации участвуют одна
- 9. Каждая оставшаяся гибридная орбиталь атомов углерода перекрывается с s- орбиталью атомов водорода, приводя к образованию в
- 10. Длина связи λ – расстояние между центрами ядер связанных друг с другом атомов (нм). Энергия связи
- 11. σ-связь – плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. π–связь – плотность электронного облака
- 12. π- Связь менее прочна, чем σ- связь, так как p- орбитали с параллельными осями перекрываются значительно
- 13. Химические свойства Для алкенов наиболее типичными являются реакции присоединения. 1) Галогенирование. Алкены при обычных условиях присоединяют
- 14. 2) Гидрирование. Легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя предельные углеводороды. CH3–CH=CH2 +
- 15. Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется
- 16. 4) Гидратация. В присутствии минеральных кислот олефины присоединяют воду, образуя спирты. H+ CH3−C=CH2 + H2O →
- 17. Окисление Алкены легко окисляются. В зависимости от условий проведения реакции образуются различные продукты. 1) При сжигании
- 18. 3) При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция
- 19. Реакция полимеризации. Реакцией полимеризации называется процесс образования высокомолекулярного соединения (полимера) путем соединения друг с другом молекул
- 20. Получение 1) Дегидрогенизация алканов при повышенной температуре с катализатором. CH3–CH2–CH2–CH3 ––300°C,Cr2O3 → CH2=CH–CH2–CH3(бутен-1) + H2 CH3–CH2–CH2–CH3
- 21. Порядок дегидратации вторичных и третичных спиртов определяется правилом А.М.Зайцева: при образовании воды атом водорода отщепляется от
- 22. 4) Реакция дегалогенирования (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными
- 23. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 24. Литература 1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник для вузов./ Под ред. Петрова
- 26. Скачать презентацию






















 Мусор
Мусор Архітектурні пам’ятки Городенківщини
Архітектурні пам’ятки Городенківщини Минимальный ликбез по нормативной документации при проектировании обогатительных фабрик
Минимальный ликбез по нормативной документации при проектировании обогатительных фабрик 11 апреля 1945 года
11 апреля 1945 года Школа проектов (для новичков)
Школа проектов (для новичков) Видеоэтюд в пейзаже и портрете. 8 класс
Видеоэтюд в пейзаже и портрете. 8 класс Презентация по английскому Читаем с удовольствием
Презентация по английскому Читаем с удовольствием Виды и формы бизнеса
Виды и формы бизнеса Особо охраняемые природные территории Липецкой области
Особо охраняемые природные территории Липецкой области Авторитарное государство
Авторитарное государство Презентация на тему Формы земной поверхности (2 класс)
Презентация на тему Формы земной поверхности (2 класс) Мы сюда пришли учиться
Мы сюда пришли учиться Личностно-ориентированное обучение в начальной школе
Личностно-ориентированное обучение в начальной школе Соединение деталей машин
Соединение деталей машин Сущность культуры. Культура и природа
Сущность культуры. Культура и природа Культурно-исторический и деятельностный подходы к психическому развитию человека. Лекция 3
Культурно-исторический и деятельностный подходы к психическому развитию человека. Лекция 3 Общие вопросы анестезиологии
Общие вопросы анестезиологии Педагогическая концепция
Педагогическая концепция Достопримечательности Вены
Достопримечательности Вены Вводная презентация учителя
Вводная презентация учителя Цель доклада
Цель доклада Ратные страницы истории Отечества
Ратные страницы истории Отечества узагальнення досвіду роботи
узагальнення досвіду роботи О взаимодействии муниципальных органов управления и поисковых отрядов в патриотическом воспитании подрастающего поколения
О взаимодействии муниципальных органов управления и поисковых отрядов в патриотическом воспитании подрастающего поколения Организация работы станционного технологического центра, обработка поездной информации и перевозочных документов
Организация работы станционного технологического центра, обработка поездной информации и перевозочных документов Система расчетов с населением за коммунальные услуги
Система расчетов с населением за коммунальные услуги Тетрадь по Дзюдо
Тетрадь по Дзюдо Презентация на тему Семья и школа
Презентация на тему Семья и школа