Слайд 2Алкины
Определение
алкинов
Изомерия
Номенклатура
Химические
свойства
Получение
Применение
Физические
свойства
Назад

Слайд 3Алкины (ацетиленовые УВ)
Алкины – это углеводороды, в молекулах которых два атома углерода

находятся в состоянии SP-гибридизации и связаны друг с другом тройной связью. Общая формула:CnH2n-2, n>2
Длина связи в алкинах равна
0,120 нм.
Назад
Слайд 4Изомерия
Углеродного скелета с «С» >5
CНΞС-СН2-СН2-СН3 СНΞС-СН –СН3
бутин-1 СН3

3-метилбутин-1
Положения тройной (кратной) связи
СНΞС-СН2-СН3 СН3-СΞС-СН3
бутин-1 бутин-2
Классов соединений (алкадиены)
СНΞС-СН2-СН3 СН2=СН-СН=СН2
бутин-1 бутадиен-1,3
Пространственной изомерии нет
Назад
Слайд 5Номенклатура
АН → ИН
Выбор главной цепи и начало нумерации определяется тройной связью
Правила

составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов.
Назад
Слайд 6Физические свойства
С2-С4-газы, С5-С16-жидкости,С>17 твердые вещества, растворимость в воде небольшая, но больше чем

у алкенов и алканов, р<1г/ см,
Ткип( Н) > Т кип (разв), с увеличением Мr Tкип увеличивается.
Назад
Слайд 7Химические свойства алкинов.
Алкины во многих реакциях обладают большей реакционной способностью,чем алкены. Для

алкинов,как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, алкины могут вступать в реакции двойного присоединения (присоединять 2 молекулы реагента по тройной связи). Присоединение несимметричных реагентов к несимметричным алкинам происходит по правилу Марковникова.
Слайд 8I.Реакции присоединения:
1.Присоединение водорода (гидрирование)
На I ступени образуются алкены, на II cтупени-
алканы:
С

2 H 2 + Н2 → СН2=СН2
(кат. Pt, Pd, Ni, t=150)
CН2=СН2 +Н2→СН3-СН3
Суммарное уравнение:
С 2Н 2+2Н2 →СН3-СН3
2.Присоединение галогенов (галогенирование)
На I ступени образуются дигалогеналкены, на II- тетрагалогеналканы:
С 4Н 6 + Br2→CН Br =С Br -СН2-СН3
бутин -1 ( Н2О) 1,2-дибромбутен-1
СНBr=СBr-СН2-СН3 +Br2---CHBr2-CBr2-CH2-CH3
( H2O) 1,1,2,2-тетрабромбутан
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается.
Слайд 93.Присоединение галогеноводородов (гидрогалогенирование)
На I ступени образуются моногалогеналкены,
на II –дигалогеналканы:
С 2Н 2 +

НCl →CH2=CHCl+HCl→CH3-CHCl2
хлорэтен 1,1-дихлорэтан
(Cu, Hg )
4.Присоединение воды (гидратация)
Происходит по правилу Марковникова. Ацетилен образует альдегид, его гомологи –кетоны (реакция М.Г. Кучерова):
С 2Н2 + НОН→ СН3-СОН
кат.Hg этаналь
С 3Н4 + НОН→ СН3-С-СН3
О пропанон (ацетон)
Слайд 10Реакция с KMnO4 является качественной реакцией на алкины. Раствор KMnO4 обесцвечивается.

Слайд 11 Кислотные свойства ацетиленовых углеводородов.
Атом водорода в ацетилене и его гомологах, содержащих

тройную связь на конце молекулы, довольно подвижен. Он может замещаться на металл, связанный с органическим остатком ионной связью. Продукты замещения можно отнести к классу солей, они называются ацетиленидами.
С 2Н2 + 2 Na--- C 2Na2 + H2 ( в присутствии NH3)
Реакция получения ацетиленидов серебра и меди (I) позволяет отличить алкины с концевой тройной связью от алканов, алкенов и алкинов с тройной связью в середине углеродной цепи.
С 2Н 2+ Ag2O --- C 2Ag 2 + H2O
(хлопья серого осадка)
Во влажном состоянии ацетиленид серебра безопасен, а при высыхании сильно взрывается от удара или поджигания.
Слайд 12III. Реакции полимеризации.
Очень длинные цепи молекулы ацетилена образуют с трудом, а вот

несколько молекул (от двух до пяти ) соединяются друг с другом относительно легко. Впервые подобную реакцию в 1866г. Осуществил М. Бертло. При нагревании ацетилена до 600 градусов С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Николай Дмитриевич Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). С тех пор эта реакция носит имя Н.Д.Зелинского.
3С2Н2-----С6Н6 бензол
Назад
Слайд 13!!!В 1955г. Д. Натта с сотрудниками синтезировал полиацетилен, представлявший собой смесь цис-,

трансизомеров: цис-полиацетилен, красного цвета, менее устойчив, транс- полиацетилен, синего цвета, более устойчив. Полиацетилен открыл новую эру токопроводящих полимеров. В 1976г. в лаборатории японского ученого Хидэки Сиракавы было сделано удивительное открытие. Если пленку из этого материала обработать иодом, получается золотистое покрытие с металлическим блеском, которое проводит электрический ток в миллиард раз лучше, чем сам полиацетилен! Эти материалы используются в сотнях электронных и звуковоспроизводящих устройств.
Слайд 14Получение алкинов
Пиролиз метана (метановый способ)
.В 1868 г. М. Бертло, пропуская через

метан электрический разряд, обнаружил в смеси образующихся газов ацетилен.
2СН4 →С2Н2 + 3Н2
Дегидрогалогенирование дигалогеналканов
В 60-х гг.XIXв. Молодым русским ученым М. Мясникову и В. Савичу удалось получить ацетилен взаимодействием 1,2-дибромэтана с кипящим спиртовым раствором гидроксида калия
СН2Br-CH2Br +KOH (спирт. р-р) →CH2=CHBr +KBr +H2O
CH2=CHBr + KOH (спирт.р-р) →С2Н2 +KBr + H2O
Карбидный способ
В 1836г. английский химик Э.Дэви получил бесцветный газ, горящий красноватым коптящим пламенем при действии воды на карбид кальция
CaC2 + 2 H2O → Ca(OH)2 +C2H2 (ацетилен)
Назад














 Lluvia
Lluvia Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах
Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах УД ПСИХОЛОГИЯ
УД ПСИХОЛОГИЯ Храмы России
Храмы России Оптическая микроскопия
Оптическая микроскопия Менеджмент
Менеджмент Кондитерский отдел
Кондитерский отдел Органы и службы стандартизации РФ
Органы и службы стандартизации РФ Вышел зайчик погулять Художник – В. Сергеев
Вышел зайчик погулять Художник – В. Сергеев Знакомство с точкой
Знакомство с точкой Состояние и задачи управления проектами в строительстве
Состояние и задачи управления проектами в строительстве Торцевой разрез. Материаловедение
Торцевой разрез. Материаловедение чайные истории
чайные истории Шпаргалка юного покупателя
Шпаргалка юного покупателя Учебно-методический комплекс "Живая география" Живая география - учебно-методический комплекс, позволяющий использовать геоинфор
Учебно-методический комплекс "Живая география" Живая география - учебно-методический комплекс, позволяющий использовать геоинфор Классификация реакций
Классификация реакций Организация хранения документов Архивного фонда Российской Федерации и других архивных документов
Организация хранения документов Архивного фонда Российской Федерации и других архивных документов Трансляция – биосинтез белка на рибосоме
Трансляция – биосинтез белка на рибосоме Инновационный подход к жизни
Инновационный подход к жизни DaCoPAn Software Engineering Project - Система динамической визуализации событий работы протоколов при обмене данными между двумя сетевыми ЭВМ — D
DaCoPAn Software Engineering Project - Система динамической визуализации событий работы протоколов при обмене данными между двумя сетевыми ЭВМ — D Урок – размышление по рассказу К.Г. Паустовского «Телеграмма»
Урок – размышление по рассказу К.Г. Паустовского «Телеграмма» Путешествие в мир животных
Путешествие в мир животных СПАСИБО, АЗБУКА!
СПАСИБО, АЗБУКА! Rave Cosmology Today Dying, Death & Bardo . RC3.8
Rave Cosmology Today Dying, Death & Bardo . RC3.8 Основные закономерности развития информационного пространства
Основные закономерности развития информационного пространства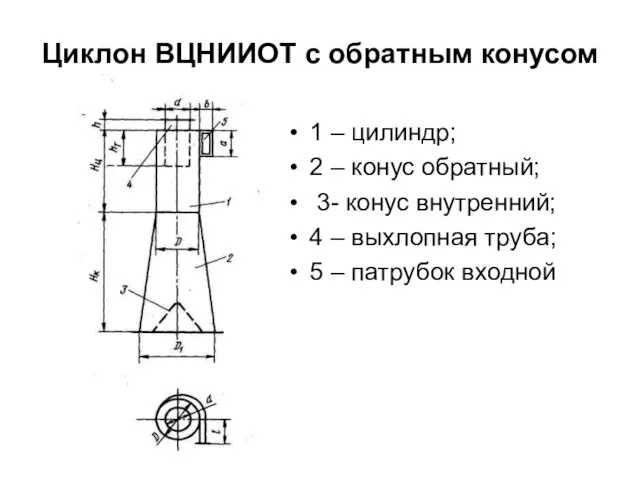 Циклон ВЦНИИОТ с обратным конусом
Циклон ВЦНИИОТ с обратным конусом  Квантовые компьютеры
Квантовые компьютеры Разработать рекламную кампанию в стиле шоу для молодежного интернет-издания Пи-Пермь (бюджет студенческой редакции)
Разработать рекламную кампанию в стиле шоу для молодежного интернет-издания Пи-Пермь (бюджет студенческой редакции)