Содержание
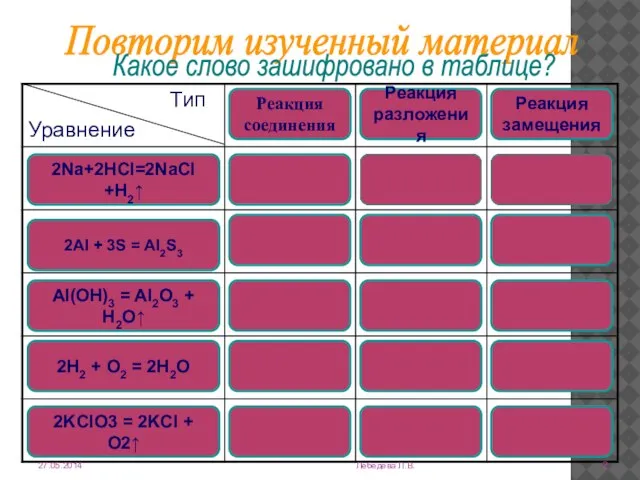
- 2. Лебедева Л.В. Повторим изученный материал Какое слово зашифровано в таблице? 2Na+2HCl=2NaCl +H2↑ 2Al + 3S =
- 3. Реакции соединения - это реакции, при которых из нескольких веществ образуется одно сложное. Реакции замещения -
- 4. Как расставить коэффициенты в реакциях с нечётным числом атомов? 5 10 Обратите внимание! Р + О
- 5. Na + Cl2 → NaCl H2CO3 → H2O + CO2 ↑ Fe(OH)3 → Fe2O3 + H2O
- 6. Цель урока: -познакомиться с реакциями обмена, дать определение данным реакциям -установить условия протекания реакций обмена до
- 7. Химические уравнения. Реакции обмена. Правила техники безопасности Реакция нейтрализации Лабораторные опыты Условия течения реакций идущих до
- 8. NaOH + HCl = NaCl + H2O Запишите уравнение подобной реакции между серной кислотой и гидроксидом
- 9. Не брать вещества руками Осторожно! ..При попадании на руки кислоты и щелочи вызывают ожог Сыпучие химические
- 10. Получите нерастворимый Fe(OH)3↓. В пробирку налейте 1 мл гидроксида натрия и прилейте несколько капель хлорида железа
- 11. На дне стакана равномерно разместите ложечку соды (карбоната натрия) и прилейте 2 мл раствора серной кислоты,
- 12. А если бы в пробирках проходила реакция нейтрализации между NaCl и H2SO4 ? 2NaCl + H2SO4
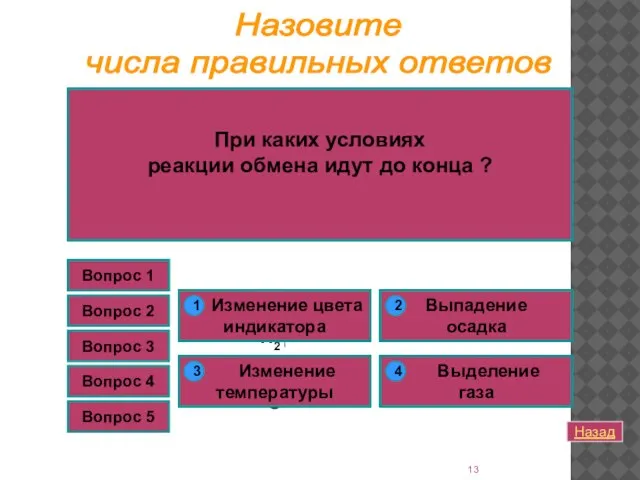
- 13. Вопрос 1 Какая реакция относится к реакциям ионного обмена? Вопрос 1 К какому типу реакций относится
- 15. Скачать презентацию










 Первый питательный крем от Anew - Ультра-Питание
Первый питательный крем от Anew - Ультра-Питание American Society Demographics
American Society Demographics  Презентация на тему Бородинская битва 4 класс
Презентация на тему Бородинская битва 4 класс Девиантное поведение
Девиантное поведение КУЛЬТУРА РОССИИ XIV — XVI ВЕКА
КУЛЬТУРА РОССИИ XIV — XVI ВЕКА Дефекты в кристаллах
Дефекты в кристаллах «Разработка Единой медицинской информационной системы на платформе 1С:Предприятие»
«Разработка Единой медицинской информационной системы на платформе 1С:Предприятие» Разработка и вывод на рынок аппарата плазменной коагуляции, на основе низкотемпературной плазмы
Разработка и вывод на рынок аппарата плазменной коагуляции, на основе низкотемпературной плазмы Презентация на тему Модест Петрович Мусоргский
Презентация на тему Модест Петрович Мусоргский Компьютерные вирусы
Компьютерные вирусы Дополнительные цвета
Дополнительные цвета Конституция Российской Федерации: государственные символы России
Конституция Российской Федерации: государственные символы России урок 15_ — копия _2_
урок 15_ — копия _2_ В землянке
В землянке Самсон
Самсон Моя наука
Моя наука Назарларыңызға әлемдегі 10 сәнді банкноттар жайлы
Назарларыңызға әлемдегі 10 сәнді банкноттар жайлы Французское искусство XVII века
Французское искусство XVII века Презентация на тему кпд тепловых двигателей 8 класс
Презентация на тему кпд тепловых двигателей 8 класс  Организационно-правовые основы деятельности первичной профсоюзной организации
Организационно-правовые основы деятельности первичной профсоюзной организации Кошки и собаки
Кошки и собаки Эффективное обшение
Эффективное обшение Права ребенка
Права ребенка Презентация на тему Природное и культурное наследие России
Презентация на тему Природное и культурное наследие России  Между парадигмами. Особенности исследования того, что еще не стало мейнстримом
Между парадигмами. Особенности исследования того, что еще не стало мейнстримом Культурология как наука
Культурология как наука Что изучает ФИЗИКА ?
Что изучает ФИЗИКА ? Звукопоглощающие материалы и конструкции
Звукопоглощающие материалы и конструкции