Содержание
- 2. Открытие 1825 г., Х. Эрстед Алюминий (от лат. Alumen – квасцы) 1855 г – Al почти
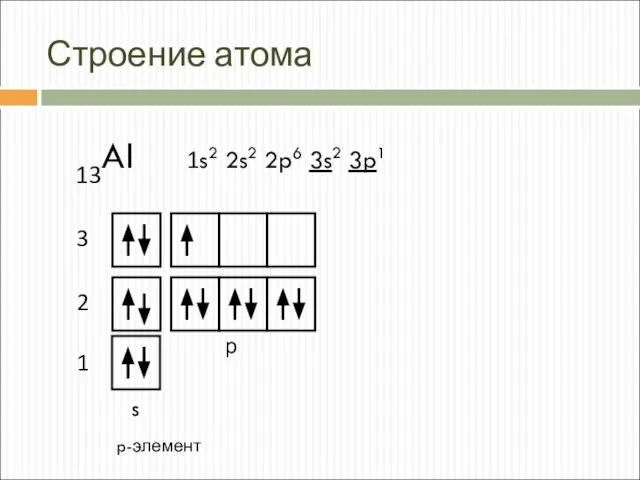
- 3. Строение атома 13Al 1s2 2s2 2p6 3s2 3p1 s p-элемент 1 2 3 р
- 4. Распространенность в природе 3-е место среди всех элементов 1-е место среди металлов В природе встречается в
- 5. Распространенность в природе Боксит Al2O3
- 6. Распространенность в природе сапфир Al2O3 Разновидность корунда –
- 7. Распространенность в природе рубин Al2O3 Разновидность корунда –
- 8. Распространенность в природе Глинозем Al2O3
- 9. Распространенность в природе изумруд Be3Al2(SiO3)6 Разновидность берилла –
- 10. Распространенность в природе аквамарин Be3Al2(SiO3)6 Разновидность берилла –
- 11. Получение Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886
- 12. Физические свойства Серебристо-белый металл Тпл=660оС высокая электропроводность лёгкий (плотность — 2,7 г/см³) высокая пластичность
- 13. Химические свойства 1) Взаимодействие с простыми веществами а) с галогенами Al + I2 → б) с
- 14. Химические свойства 2) Взаимодействие с водой 2Al + 6H2O → 2Al(OH)3 + 3H2 3) Восстанавливает металлы
- 15. Химические свойства 5) Взаимодействие со щелочью 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + H2 тетрагидроксо-
- 16. Применение
- 17. Применение
- 18. Применение
- 20. Скачать презентацию
















 Инфраструктурные инвестиции
Инфраструктурные инвестиции Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09
Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09 Pos материалы гербион
Pos материалы гербион Презентация на тему Неофициальные символы России
Презентация на тему Неофициальные символы России CPA launches FOD
CPA launches FOD Методы и приборы разрушающего контроля, применяемые при обследовании
Методы и приборы разрушающего контроля, применяемые при обследовании ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ
ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи»
Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи» Колористика при окрашивании волос. Тест
Колористика при окрашивании волос. Тест Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна»)
Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна») Греческая вазопись
Греческая вазопись Холод в нефтянной промышленности
Холод в нефтянной промышленности Урок-путешествие по разделу «Были-небылицы». Оценка достижений
Урок-путешествие по разделу «Были-небылицы». Оценка достижений LobbyWorks
LobbyWorks Самоиндукция
Самоиндукция Correct сommunication. Правильное общение
Correct сommunication. Правильное общение Тема: «Положение человека в системе животного мира. Эволюция гоминид».
Тема: «Положение человека в системе животного мира. Эволюция гоминид». Презентация на тему Выживание в природных условиях после аварии
Презентация на тему Выживание в природных условиях после аварии  ангелы
ангелы Интеллектуально-познавательная игра
Интеллектуально-познавательная игра Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208-
Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208- Fruit and vegetables
Fruit and vegetables Ты подвиг совершил во имя жизни на земле
Ты подвиг совершил во имя жизни на земле Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите
Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите ТВ - тюнеры
ТВ - тюнеры Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров
Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров Евгений Замятин
Евгений Замятин Characteristic of grain mass
Characteristic of grain mass