Содержание
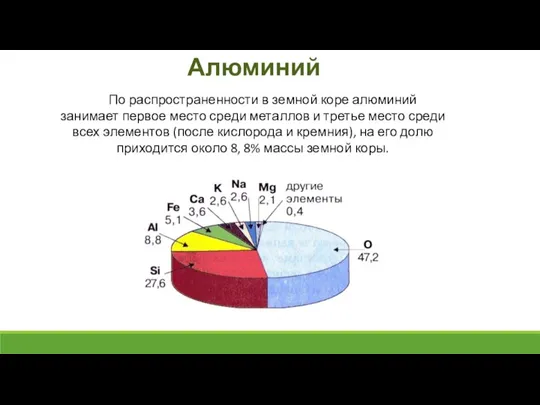
- 2. Алюминий По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди
- 3. В природе алюминий встречается только в соединениях (минералах): Корунд Берилл Нефелин Алунит Боксит
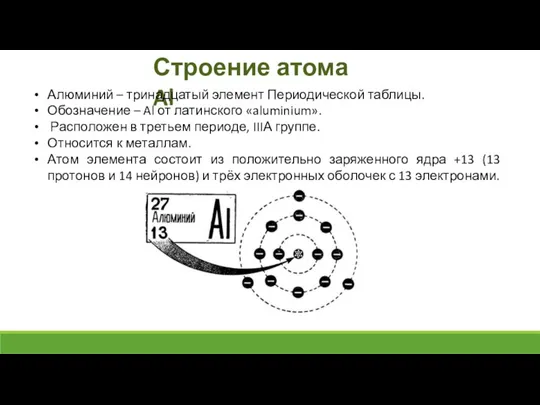
- 4. Строение атома Al Алюминий – тринадцатый элемент Периодической таблицы. Обозначение – Al от латинского «aluminium». Расположен
- 5. На внешнем энергетическом уровне атома алюминия имеется три электрона, которые являются валентными: 1s22s22p63s23р 1 В результате
- 6. Применение алюминия и его соединений Алюминий - легкий, но прочный материал. Алюминий хорошо поддается механической обработке.
- 7. Изделия из алюминия
- 8. Алюминийорганические соединения Алюминийорганические соединения –соединения, содержащие связь Al – C . Общая формула RnAlX3-n, где R
- 9. Алюминийтриалкилы(арилы) (R3Al) Алюминийтриалкилы представляют собой вязкие бесцветные жидкости. Соединения с низшими радикалами (С1— С4) легко самовоспламеняются
- 10. Алкил(арил)алюминийгалогениды (RnAlHal3-n) Алкил(арил)алюминийгалогениды представляют собой вязкие бесцветные жидкости или кристаллические вещества. Легко окисляются, причем соединения с
- 11. Алкил(арил)алюминийгидриды (RnAlH3-n) Алкил(арил)алюминийгидриды–жидкие или твердые кристаллические вещества. Как и другие алюминийорганические соединения, они склонны к ассоциации
- 12. Алкоксиды алюминия (Al(OR)3) Алкоксиды алюминия - бесцветные прозрачные жидкости или твердые кристаллические вещества. Соединения ассоциированы с
- 13. Понятие о трехцентровых мостиковых связях Длины связей и валентные углы в молекуле триметилалюминия
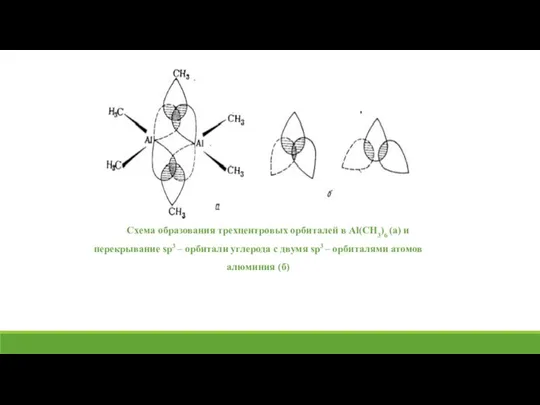
- 14. Схема образования трехцентровых орбиталей в Al(CH3)6 (a) и перекрывание sp3 – орбитали углерода с двумя sp3
- 15. Свойства алюминийорганических соединений Алюминийтриалкилы (арилы) R3AI - один из наиболее важных в практическом плане и доступных
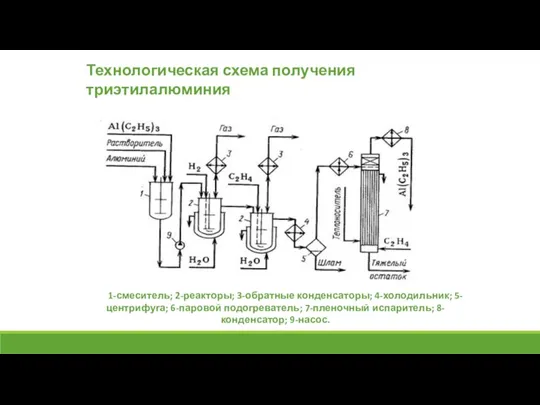
- 16. 1-смеситель; 2-реакторы; 3-обратные конденсаторы; 4-холодильник; 5-центрифуга; 6-паровой подогреватель; 7-пленочный испаритель; 8-конденсатор; 9-насос. Технологическая схема получения триэтилалюминия
- 17. Алюминийорганические соединения могут быть также получены при алкилировании (арилировании) с помощью металлорганических соединений галогенидов алюминия или
- 18. Другие способы получения: Ртутьорганические соединения в среде эфира реагируют с металлическим алюминием, давая эфираты триалкил(арил)алюминия: 2AI
- 19. В 1955 г. немецким ученым Циглером был осуществлен простой и технологичный синтез алюминийтриалкилов из дешевого и
- 20. Свойства алюминийтриалкил(арил)ов Термическая устойчивость алюминийтриалкилов невысока. Даже низшие алюминийтриалкилы, перегоняемые в вакууме при температуре не выше
- 21. При повышенном давлении и температуре алюминийтриалкилы реагируют с водородом с разрывом связи Аl—С: R3AI+ H2→R2AIH+RH (p,t)
- 22. Алюминийтриалкилы легко взаимодействуют с соединениями, содержащими подвижный водород, – с водой, спиртами, тиоспиртами, органическими кислотами, фенолами
- 23. Алкил(арил)алюминийгалогениды RnAlHal3-n Взаимодействие галогеналкилов(арилов) с металлическим алюминием приводит к преимущественному образованию алкил- (арил)алюминийгалогенидов: Al + RX→RAIX2
- 24. Одним из способов получения алкил(арил)алюминийгидридов RnAIH3-n является взаимодействие алюминийтриалкилов с водородом при повышенном давлении и температуре:
- 25. Соединения очень реакционноспособны. Связь =Аl-Н проявляет высокую реакционную способность в реакциях присоединения к алкенам и алкинам:
- 26. Алкоксиды алюминия Реакция регулируемого окисления алюминийтриалкилов, протекающая ступенчато: Взаимодействие алюминийтриалкилов, алкилалюминийгалогенидов, алкилалюминийгидридов со спиртами также приводит
- 27. Алкоксигрупшы у алюминия чувствительны к гидролизу. Реакция протекает по схеме гидролитической поликонденсации с образованием алюмооксановой связи:
- 28. Практическое использование органических производных алюминия Широкое применение нашли элементорганические соединения алюминия благодаря возможности их промышленного синтеза.
- 29. Алюминийорганические соединения компоненты катализаторов Циглера - Натта, используемых в синтезе полиолефинов и стереорегулярныхи диеновых каучуков, катализаторы
- 30. Учитывая специфические свойства алюминийорганических соединений, а также использование в их производстве водорода, этилена, изобутилена, хлористого этила,
- 31. В НИИМСК была разработана новая каталитическая система для производства бутилкаучука, состоящая из комплексного катализатора на основе
- 33. Скачать презентацию


























 Решение неравенств с одной переменной (11 класс)
Решение неравенств с одной переменной (11 класс) Современные подходы к минимизации налога на прибыль организаций
Современные подходы к минимизации налога на прибыль организаций Экономика и её участники
Экономика и её участники 2006 – 2007 учебный год
2006 – 2007 учебный год Анализ финансового состояния предприятия, оптимизация в системе электронных таблиц
Анализ финансового состояния предприятия, оптимизация в системе электронных таблиц Рынок биотехнологии РФ
Рынок биотехнологии РФ Лингвистическая игра
Лингвистическая игра Два пути
Два пути Презентация на тему А. Н. Островский «Бедность не порок»
Презентация на тему А. Н. Островский «Бедность не порок» Проблема повышения уровня качества знаний в нашей школе
Проблема повышения уровня качества знаний в нашей школе The Past Perfect
The Past Perfect  физика
физика Диалектика характера Обломова
Диалектика характера Обломова Анализ работы образовательных учреждений Чусовского городского округа
Анализ работы образовательных учреждений Чусовского городского округа Правописание прилагательных
Правописание прилагательных Построение и редактирование геометрических объектов
Построение и редактирование геометрических объектов Открытое акционерное общество «Российский банк развития»
Открытое акционерное общество «Российский банк развития» Производственная практика
Производственная практика Паспорта комнатных растений
Паспорта комнатных растений Martini Royale Изысканный кинококтейль, первая презентация которого проходила в рамках Каннского кинофестиваля, где он завоевал признан
Martini Royale Изысканный кинококтейль, первая презентация которого проходила в рамках Каннского кинофестиваля, где он завоевал признан Медузы
Медузы Внутренняя политика Екатерины II
Внутренняя политика Екатерины II В Александрии Египетской
В Александрии Египетской Электрооборудование бытовых машин
Электрооборудование бытовых машин Промышленность мира
Промышленность мира Искусство и окружающие предметы (4 класс)
Искусство и окружающие предметы (4 класс) УГАДАЙТЕ СЛОВО задание В В О О Р Р О О Б Б Е Е Й Й.
УГАДАЙТЕ СЛОВО задание В В О О Р Р О О Б Б Е Е Й Й. Особенности истории информатики
Особенности истории информатики