Содержание
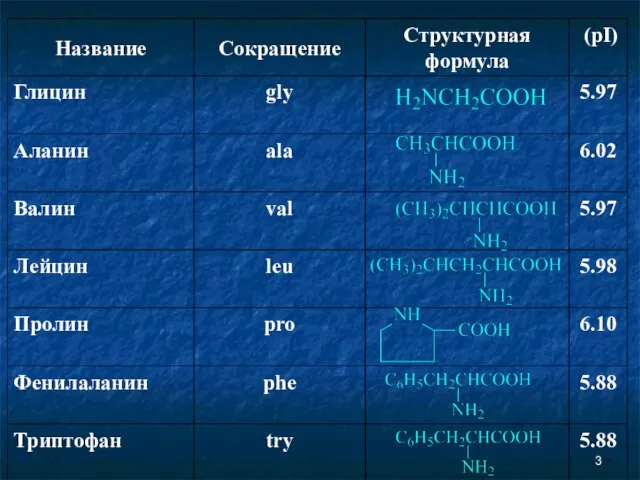
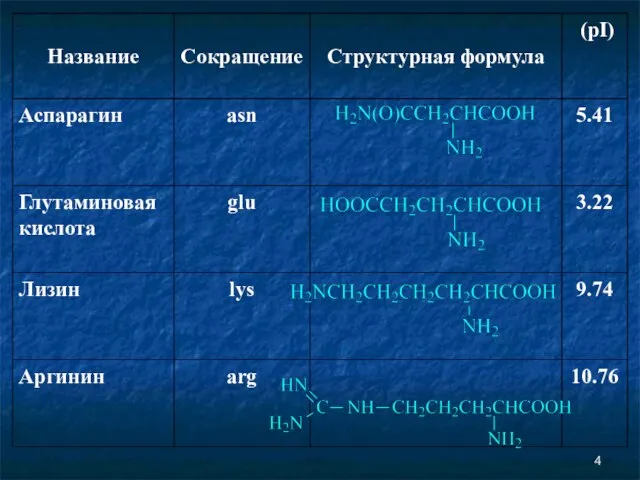
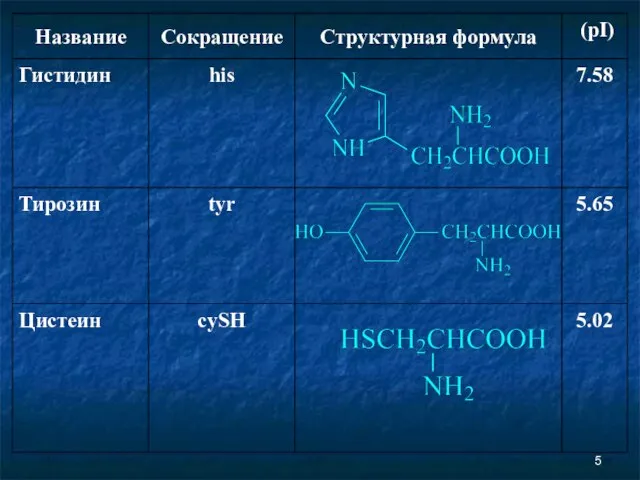
- 2. Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой.
- 6. Незаменимые аминокислоты Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей,
- 7. Незаменимые аминокислоты Следующие аминокислоты принято считать незаменимыми для организма человека: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин,
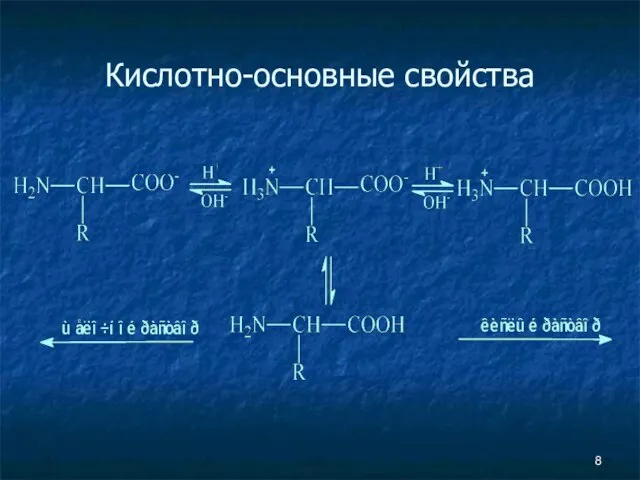
- 8. Кислотно-основные свойства
- 9. Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион; аминокислота в твердом состоянии
- 10. Изоэлектрическая точка (рI) Изоэлектрической точкой называется такое значение pH, имеющее определенное значение для каждой аминокислоты, при
- 11. Способы получения аминокислот Аминирование α-галогензамещенных кислот
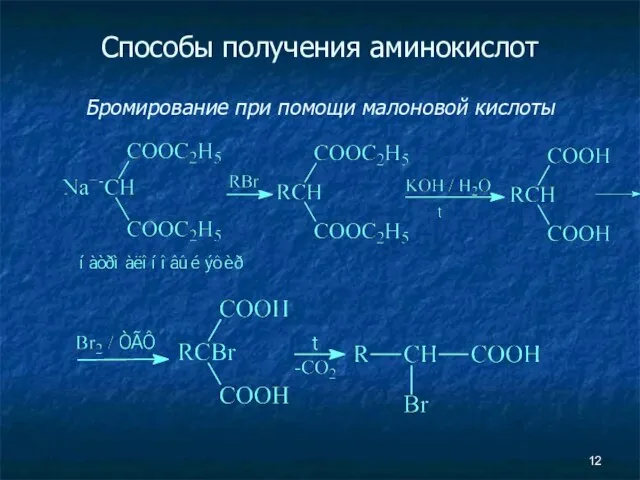
- 12. Способы получения аминокислот Бромирование при помощи малоновой кислоты
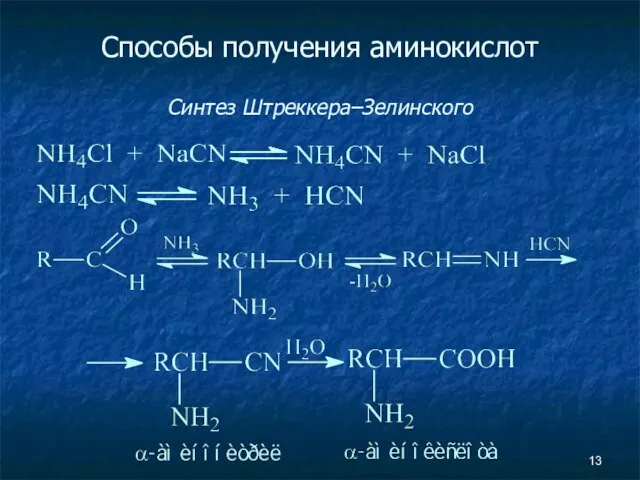
- 13. Способы получения аминокислот Синтез Штреккера–Зелинского
- 14. Способы получения аминокислот Алкилирование N-замещенных аминомалоновых эфиров Аминирование эфиров α-галоген-замещенных кислот (с помощью фталимида калия)
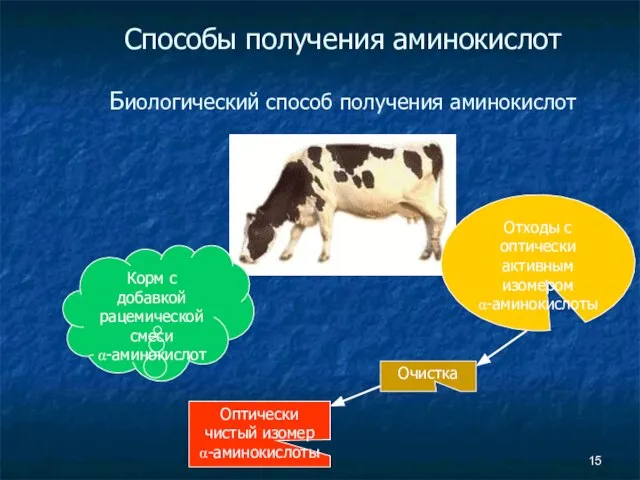
- 15. Способы получения аминокислот Биологический способ получения аминокислот Корм с добавкой рацемической смеси α-аминокислот Отходы с оптически
- 16. Химические свойства аминокислот Реакции аминогруппы Метод Ван-Слайка
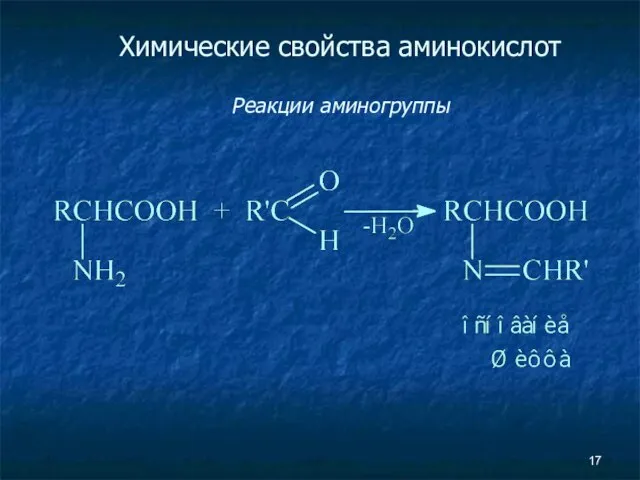
- 17. Химические свойства аминокислот Реакции аминогруппы
- 18. Химические свойства аминокислот Реакции карбоксильной группы
- 19. Химические свойства аминокислот Реакции карбоксильной группы
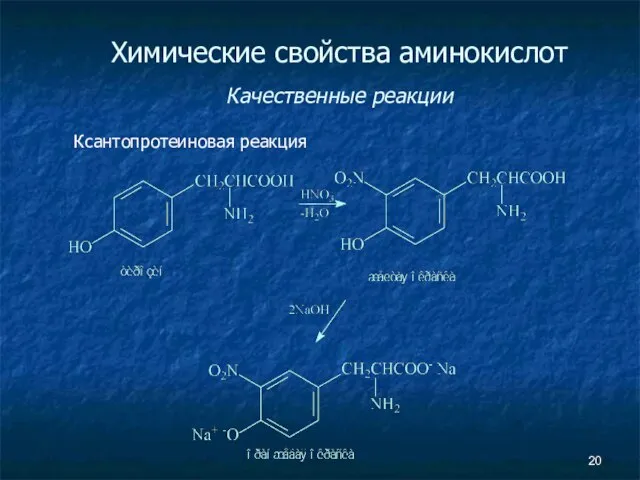
- 20. Химические свойства аминокислот Качественные реакции Ксантопротеиновая реакция
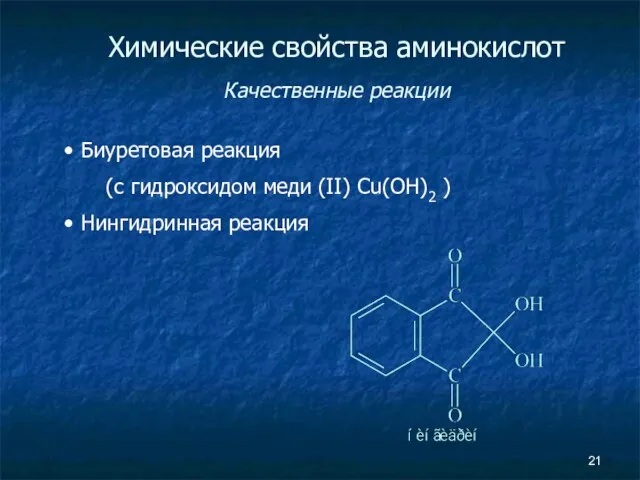
- 21. Химические свойства аминокислот Качественные реакции Биуретовая реакция (с гидроксидом меди (II) Cu(OH)2 ) Нингидринная реакция
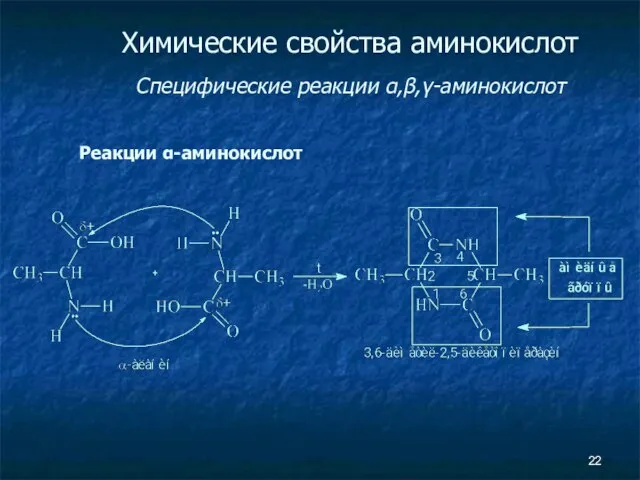
- 22. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции α-аминокислот
- 23. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции β-аминокислот
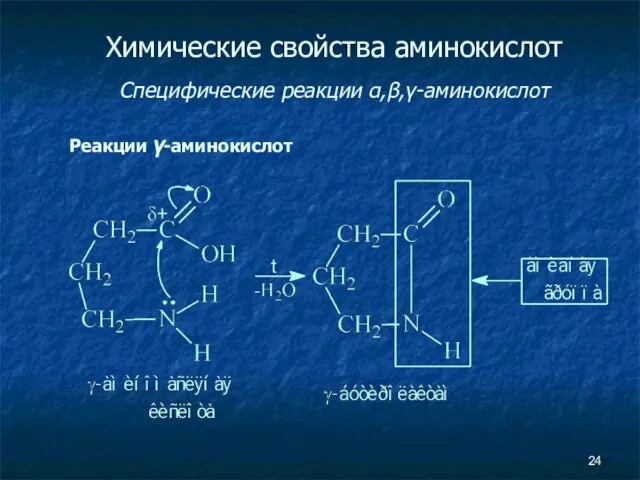
- 24. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции γ-аминокислот
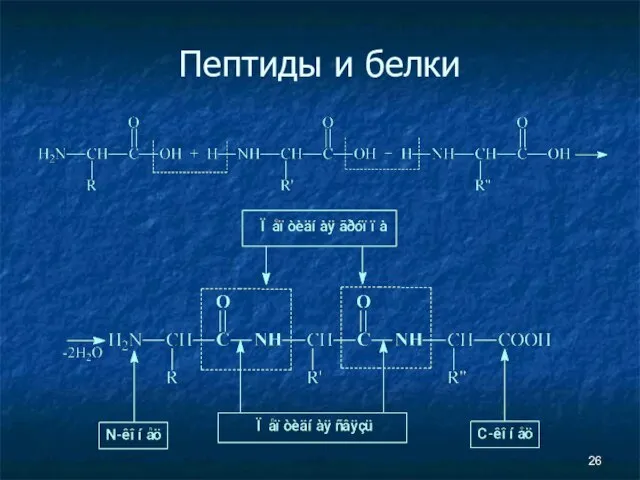
- 25. Пептиды и белки Пептиды — соединения, построенные из нескольких остатков α-аминокислот, связанных амидной (пептидной) связью.
- 26. Пептиды и белки
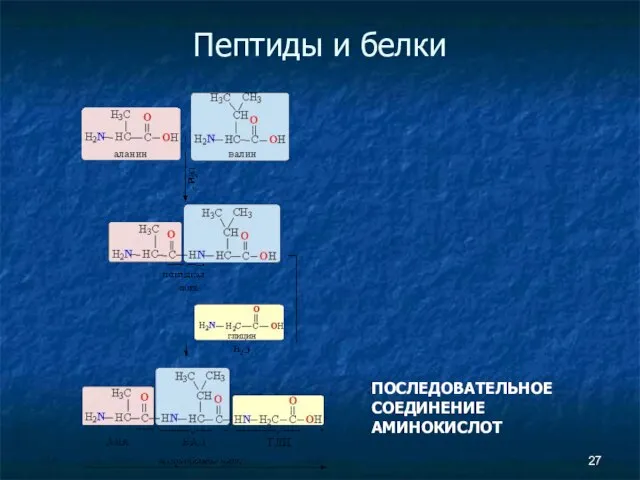
- 27. Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
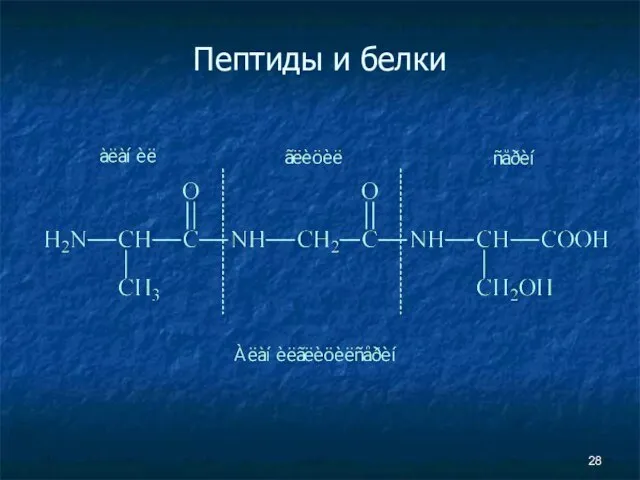
- 28. Пептиды и белки
- 29. Пептиды и белки Первичная структура белка инсулина.
- 30. Пептиды и белки Структура белков Первичная структура пептидов и белков — это последовательность аминокислотных остатков в
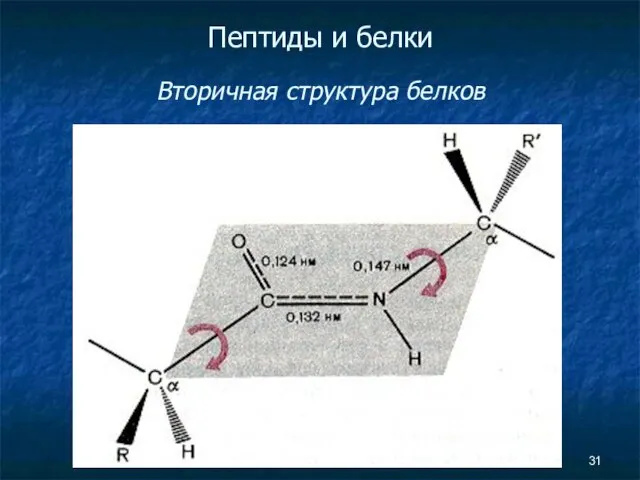
- 31. Пептиды и белки Вторичная структура белков
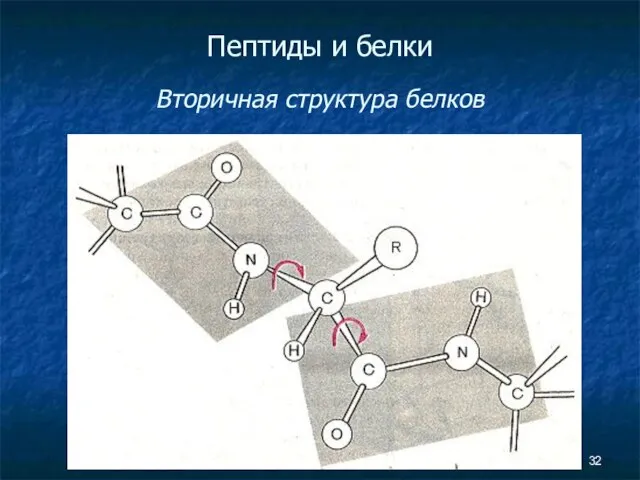
- 32. Пептиды и белки Вторичная структура белков
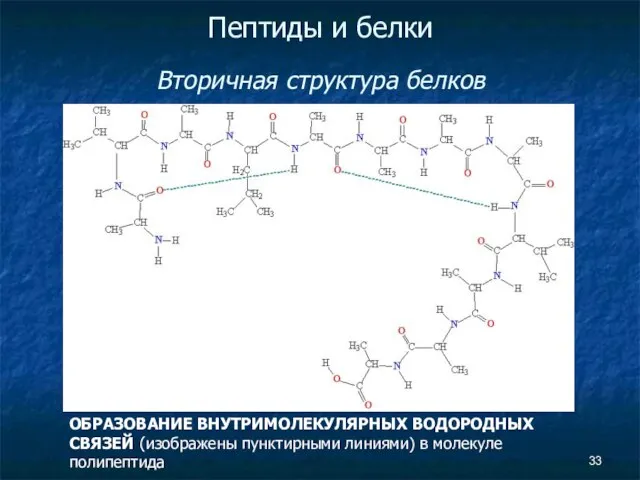
- 33. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными линиями) в молекуле полипептида
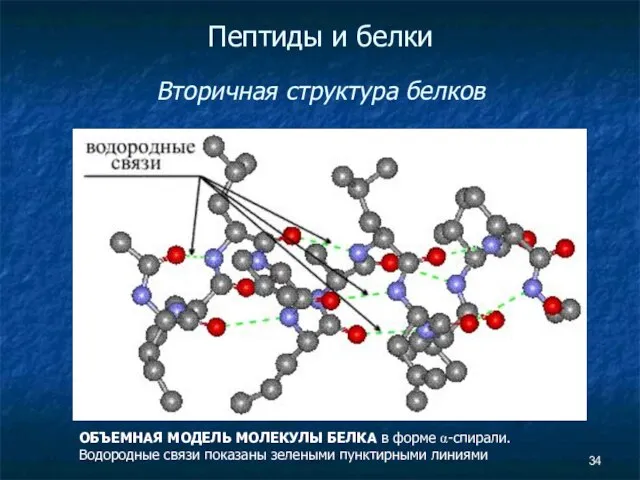
- 34. Пептиды и белки Вторичная структура белков ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме α-спирали. Водородные связи показаны
- 35. Пептиды и белки Вторичная структура белков α-спираль молекулы белка
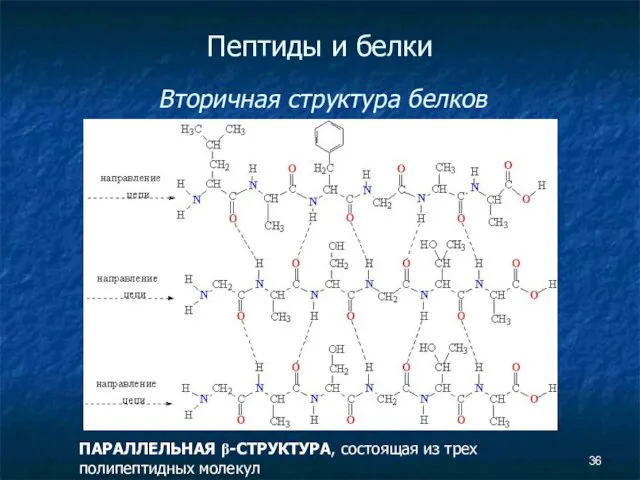
- 36. Пептиды и белки Вторичная структура белков ПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных молекул
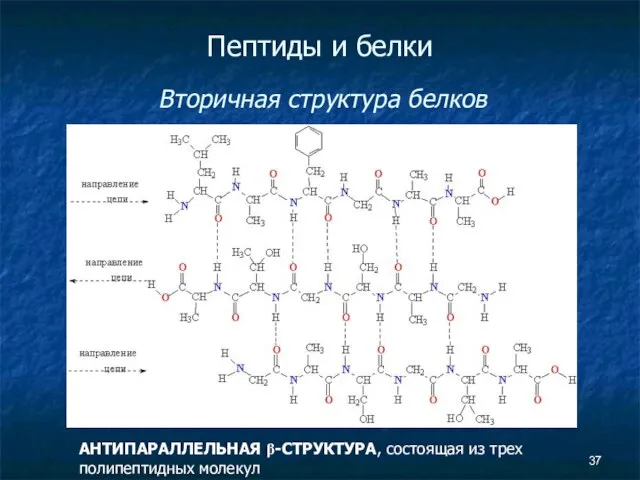
- 37. Пептиды и белки Вторичная структура белков АНТИПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных молекул
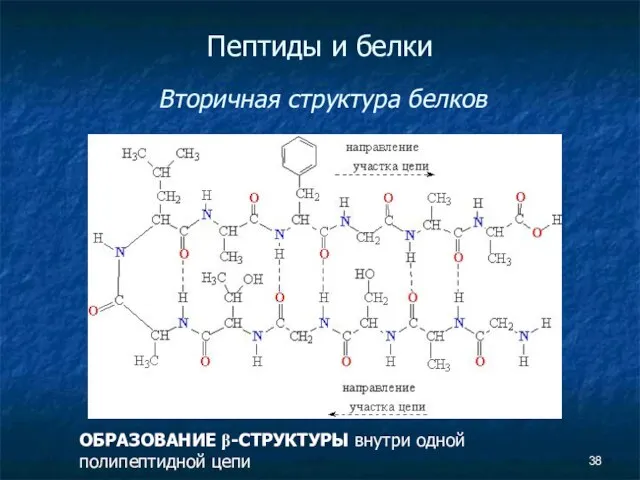
- 38. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ β-СТРУКТУРЫ внутри одной полипептидной цепи
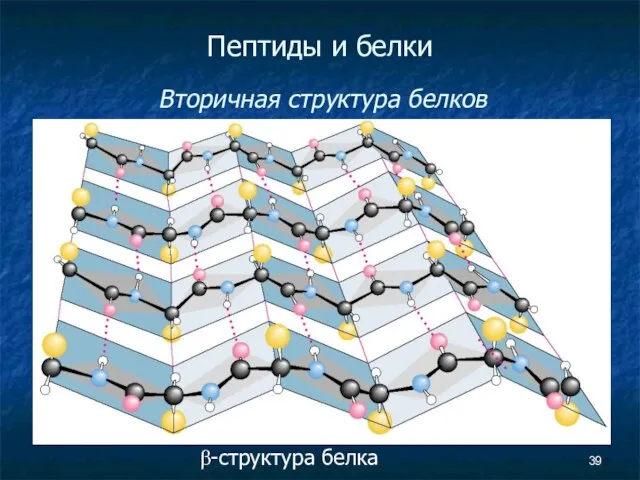
- 39. Пептиды и белки Вторичная структура белков β-структура белка
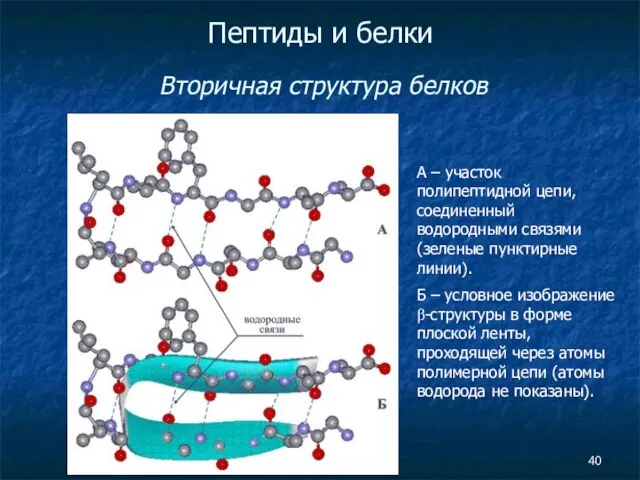
- 40. Пептиды и белки Вторичная структура белков А – участок полипептидной цепи, соединенный водородными связями (зеленые пунктирные
- 41. Пептиды и белки Вторичная структура белков Вторичная структура белка — это более высокий уровень структурной организации,
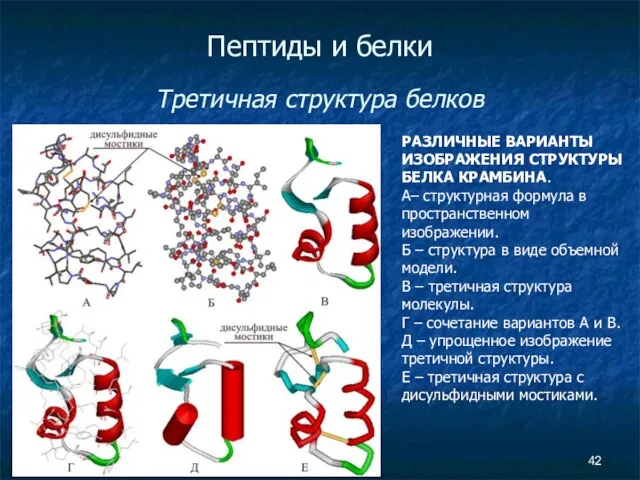
- 42. Пептиды и белки Третичная структура белков РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в
- 43. Пептиды и белки Ионные взаимодействия
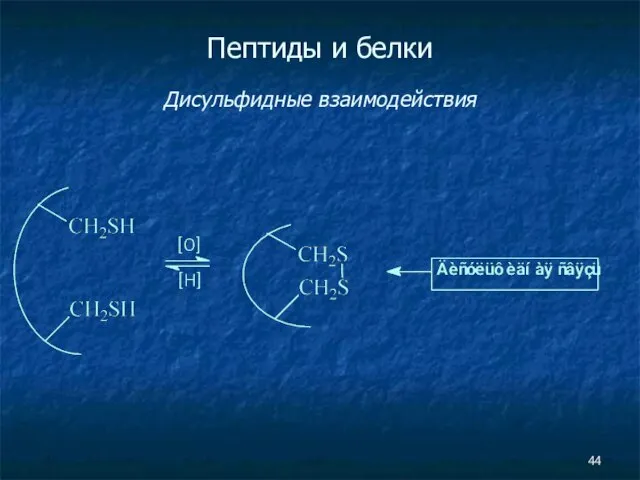
- 44. Пептиды и белки Дисульфидные взаимодействия
- 45. Пептиды и белки Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо дисульфидных мостиков
- 46. Пептиды и белки Фибриллярные белки ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка и паутины
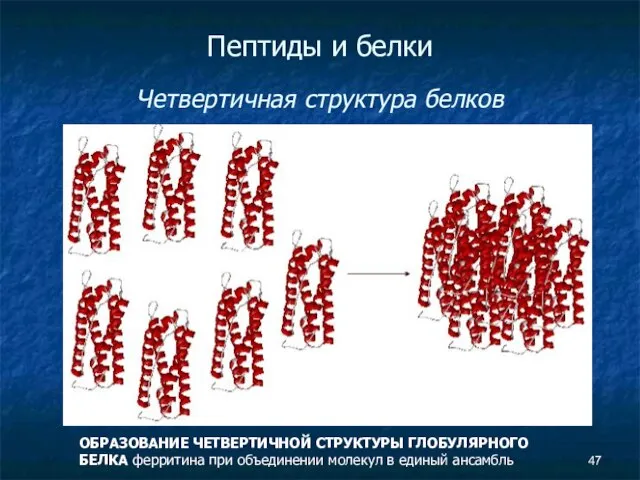
- 47. Пептиды и белки Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в
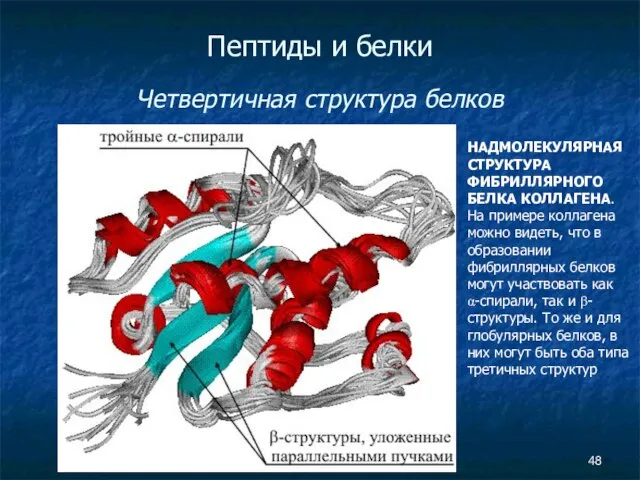
- 48. Пептиды и белки Четвертичная структура белков НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть,
- 49. Пептиды и белки Денатурация белков Денатурация белков — это разрушение их природной (нативной) пространственной структуры с
- 51. Скачать презентацию




















 Travel America
Travel America Румынский производитель автомобилей Дакия
Румынский производитель автомобилей Дакия Автоматизированная система контроля уровня знаний в системе дистанционного образования Магистерская диссертация по специальн
Автоматизированная система контроля уровня знаний в системе дистанционного образования Магистерская диссертация по специальн Система охлаждения компьютера
Система охлаждения компьютера О подвигах, о доблести и славе…
О подвигах, о доблести и славе… Поведенческие финансы
Поведенческие финансы Херени Даниэл
Херени Даниэл ИГРА как одна из форм деятельности классного руководителя
ИГРА как одна из форм деятельности классного руководителя О чём говорит искусство. 2 класс
О чём говорит искусство. 2 класс ШМО учителей русского языка и литературы МОУ «ВГЛ»г. Волжск РЕСПУБЛИКА МАРИЙ ЭЛ
ШМО учителей русского языка и литературы МОУ «ВГЛ»г. Волжск РЕСПУБЛИКА МАРИЙ ЭЛ Основы мировых религиозных культур « Вся культура – из храма» Дж. Фрэзер Автор: д.и.н., доцент Сушко А.В. Омск – 2012.
Основы мировых религиозных культур « Вся культура – из храма» Дж. Фрэзер Автор: д.и.н., доцент Сушко А.В. Омск – 2012. Решение по кэширование трафика
Решение по кэширование трафика Озеро Байкал – жемчужина Сибири
Озеро Байкал – жемчужина Сибири ДОБРО ПОЖАЛОВАТЬ!!!
ДОБРО ПОЖАЛОВАТЬ!!! Распространение объектно-ориентированного подхода на информационную безопасность
Распространение объектно-ориентированного подхода на информационную безопасность Rich Dad, poor Dad
Rich Dad, poor Dad Возникновение ислама. Арабский халифат и его распад
Возникновение ислама. Арабский халифат и его распад Террасы. Ялта. Концепт, финал
Террасы. Ялта. Концепт, финал Деятельность МБУ Благоустройство Павловский Посад:
Деятельность МБУ Благоустройство Павловский Посад: Презентация на тему Рукописные книги Древней Руси 3 класс
Презентация на тему Рукописные книги Древней Руси 3 класс Дети с синдромом дефицита внимания и гипервозбудимости: особенности, психолого-педагогические и медицинские аспекты, воздействие
Дети с синдромом дефицита внимания и гипервозбудимости: особенности, психолого-педагогические и медицинские аспекты, воздействие Игротека в библиотеке
Игротека в библиотеке Oscar Wilde
Oscar Wilde  Деловая игра Социальный предприниматель
Деловая игра Социальный предприниматель Импортеры_Китай
Импортеры_Китай Тренинг влияния (противостояния манипуляциям)
Тренинг влияния (противостояния манипуляциям) Словарь к занятию Семейное древо
Словарь к занятию Семейное древо Классификация схем совмещения литья и прокатки
Классификация схем совмещения литья и прокатки