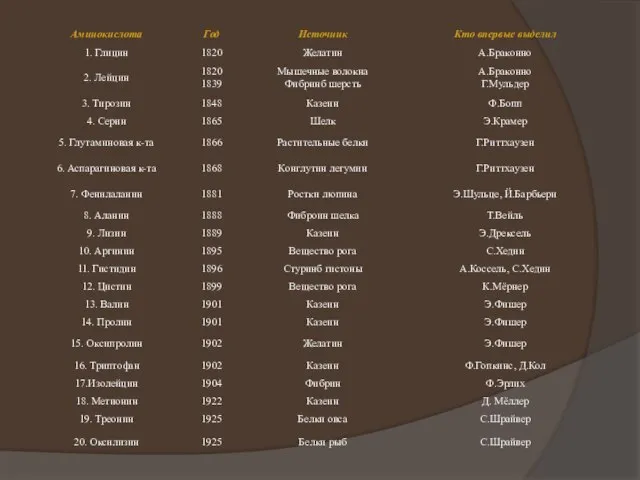
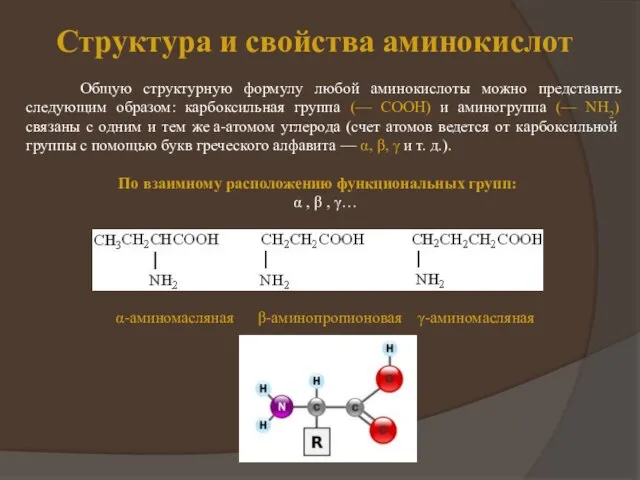
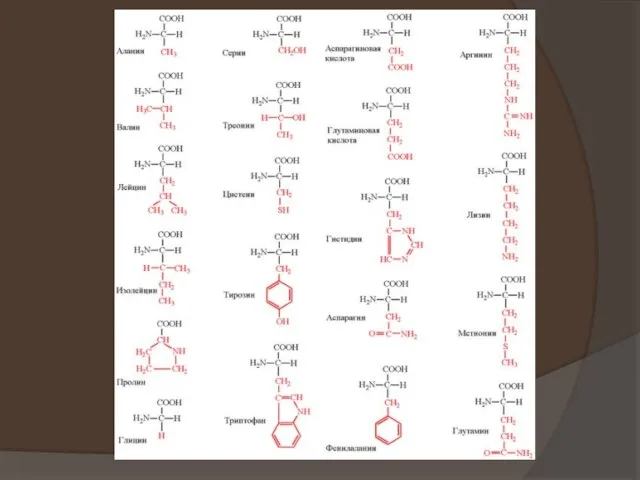
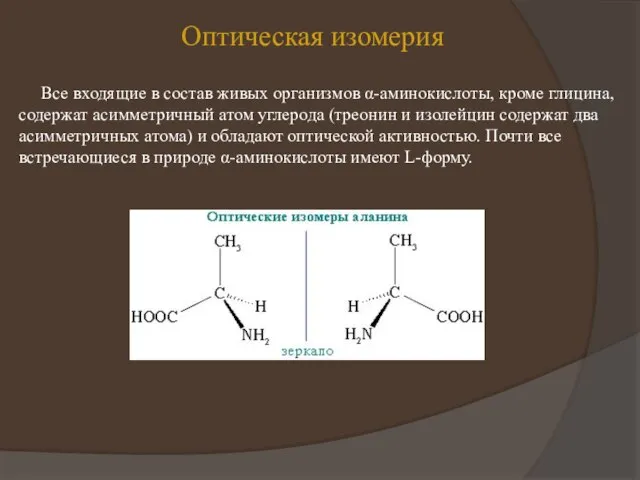
на теории радикалов, он сформулировал понятие о минимальной структурной единице, входящей в состав всех белков. Эту единицу, которой приписывался состав 2C8H12N2 + 50, Г. Мульдер назвал протеином (Рг), а свою концепцию - теорией протеина.
Позднее состав протеина был уточнен - C40H62N10O12; дополнительно к протеинным единицам некоторые белки содержали серу и фосфор. Формула белков, предложенная Мульдером в 1838 г., выглядела так:
Г. Мульдер пользовался структурными формулами и для обозначения ряда физиологических процессов. В своем учебнике физиологической химии (1844) он рассматривал дыхание как окисление протеина, пищеварение - как перестройку белка с изменением содержания S, Р, Са и т. п.
Работы Г. Мульдера способствовали широкому распространению взглядов о единстве всех белков, их фундаментальном значении в мире живой природы.
Однако вскоре наступают трудные времена для теории протеина. В 1846 г. Н. Э. Лясковский, работавший в лаборатории Ю. Либиха, доказал неточность многих приведенных Г. Мульдером анализов. Свои сомнения в правильности теории публично высказал Ю. Либих. Г. Мульдер пытался корректировать формулу протеина , но в конце концов уступил под натиском новых фактов и открытий.
белок сыворотки крови 10Pr S2P






 Презентация ремонтов. Ремонт вагонов
Презентация ремонтов. Ремонт вагонов Схема жизни бетонной конструкции 3 года30-35 лет40 лет 0-3 года – набор бетоном проектной прочности 3-40 лет – незначительное уменьшение
Схема жизни бетонной конструкции 3 года30-35 лет40 лет 0-3 года – набор бетоном проектной прочности 3-40 лет – незначительное уменьшение понятливый понятой
понятливый понятой Природный газ
Природный газ Музыка и изобразительное искусство
Музыка и изобразительное искусство Старший кассир, кассир
Старший кассир, кассир Комнатные растения в интерьере 7 класс
Комнатные растения в интерьере 7 класс Тьюторская тема
Тьюторская тема Классный час
Классный час Все мы родом из детства Зам.директора ВР Пыжик Т.Е.
Все мы родом из детства Зам.директора ВР Пыжик Т.Е. Психологическое сопровождение
Психологическое сопровождение ПТК Восточной Сибири. Полуостров Таймыр
ПТК Восточной Сибири. Полуостров Таймыр ЕГЭ 2010
ЕГЭ 2010 Всемирный День студента
Всемирный День студента Девиантное поведение. 8 класс
Девиантное поведение. 8 класс Профпригодность. Тесты
Профпригодность. Тесты МАСТЕРСКАЯ-ПРАКТИКУМ ПО ЭРГОНОМИЧЕСКИМ ОСНОВАМ ПРОЕКТИРОВАНИЯ ПОЛЬЗОВАТЕЛЬСКИХ ИНТЕРФЕЙСОВ
МАСТЕРСКАЯ-ПРАКТИКУМ ПО ЭРГОНОМИЧЕСКИМ ОСНОВАМ ПРОЕКТИРОВАНИЯ ПОЛЬЗОВАТЕЛЬСКИХ ИНТЕРФЕЙСОВ «У солнышка в гостях»
«У солнышка в гостях» Схема взаимосвязей образовательных понятий
Схема взаимосвязей образовательных понятий Монеты древней руси
Монеты древней руси СССР в годы Хрущевской оттепели 1953-1964
СССР в годы Хрущевской оттепели 1953-1964 «Путь к звездам»
«Путь к звездам» Солнце – вечный огонь Вселенной. Солнечная система
Солнце – вечный огонь Вселенной. Солнечная система Java Script Examples
Java Script Examples Работа на швейной машинке
Работа на швейной машинке Питание растений 6 класс
Питание растений 6 класс Организации вебинара
Организации вебинара Подписки Билайн: масс-медиа нового поколения
Подписки Билайн: масс-медиа нового поколения