Слайд 2Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за

единицу времени в единице объема (для гомогенных систем) или на единице площади (для гетерогенных систем)
Слайд 3Гомогенные системы:
Газ + газ
Жидкость + жидкость
Гетерогенные системы :
Газ +

Жидкость;
Газ + Твердое вещество;
Жидкость+ твердое вещество;
Твёрдое вещество + твёрдое вещество;
Слайд 4Определите тип реагирующих систем
H2 +Cl2 = 2HCl
KOH+ H2SO4 = K2SO4 + H2O
Zn
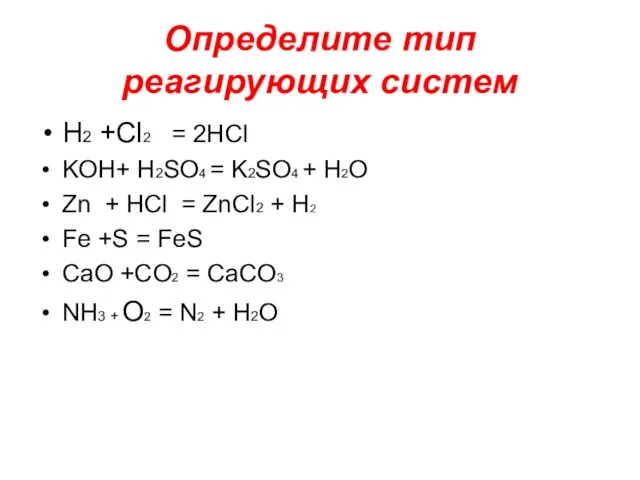
+ HCl = ZnCl2 + H2
Fe +S = FeS
CaO +CO2 = CaCO3
NH3 + O2 = N2 + H2O
Слайд 5Факторы, влияющие на скорость
Природа реагирующих веществ.
Концентрация реагирующих веществ.
Температура.
Площадь соприкосновения реагирующих веществ.
Присутствие катализаторов

или ингибиторов.
Слайд 6Лабораторная работа
1 ряд. Влияние природы реагирующих веществ.
2 ряд. Влияние концентрации реагирующих веществ

(для гомогенных систем)
3ряд. Влияние температуры.
Слайд 7Отчёт групп
Чем выше активность реагирующих веществ, тем больше скорость реакции.
Скорость реакции пропорциональна

произведению концентрации реагирующих веществ, взятых в степенях, равных их коэффициентам (Закон действующих масс)
С повышением температуры на 10 градусов, скорость реакции увеличивается в 2-4 раза ( Правило Вант-Гоффа)
Слайд 8Катализаторы и катализ
Катализаторы- вещества, повышающие скорость химической реакции, но сами они при

этом не расходуются.
Катализ – изменение скорости реакции под действием катализаторов.
Слайд 9Площадь соприкосновения
Чем больше площадь соприкосновения, тем больше скорость химической реакции.

Слайд 10Что мы изучали?
Чем определяется скорость реакций? В каких единицах она измеряется?
Почему не

все столкновения между частицами приводят к осуществлению реакций?
Что такое энергия активации? От каких факторов она зависит?
Какие типы реакций называются гомо(гетеро) генными?
Слайд 11Решение задач
1. Вычислите скорость реакции, идущей по схеме: 2А +В = D,

если начальная концентрация вещества А равна 0,4 моль\л, а через 20 секунд она стала равной 0,1 моль\л. Как изменится за это время концентрация вещества В, и вещества D?
Слайд 122. Запишите кинетическое уравнение для реакции: 2Н2 +О2= 2Н2О
3. Во сколько раз

увеличится скорость реакции, если температурный коэффициент равен 3, а температуру увеличили на 30 градусов?
4. При повышении температуры на 40 градусов, скорость реакции возрастает в 16 раз. Определите температурный коэффициент.












 Работа секретаря с документами, содержащими конфиденциальную информацию
Работа секретаря с документами, содержащими конфиденциальную информацию Задачи на разрезание (занятие 5)
Задачи на разрезание (занятие 5) Олимпийские и паралимпийские ценности
Олимпийские и паралимпийские ценности Презентация на тему Андрей Первозванный
Презентация на тему Андрей Первозванный ИТ Бизнес Металл
ИТ Бизнес Металл III СЪЕЗД АССОЦИАЦИИ МОЛОДЫХ ПЕДАГОГВ
III СЪЕЗД АССОЦИАЦИИ МОЛОДЫХ ПЕДАГОГВ Gaols,objectives
Gaols,objectives  Презентация на тему Литература конца 18 начала 20 века
Презентация на тему Литература конца 18 начала 20 века Международный день прогулки
Международный день прогулки Математические и логические основы информатики
Математические и логические основы информатики Системы отопления
Системы отопления 2011/2012 учебный год
2011/2012 учебный год XII традиционный легкоатлетический пробег памяти В.И. Мусихина
XII традиционный легкоатлетический пробег памяти В.И. Мусихина Новое качество для Вашего бизнеса
Новое качество для Вашего бизнеса Сквозные образовательные результаты как условие социализации школьников
Сквозные образовательные результаты как условие социализации школьников Русское национальное блюдо Пирожки жареные
Русское национальное блюдо Пирожки жареные Изображения. Разрезы
Изображения. Разрезы Шляхи вдосконалення розсадництва у розсадниках ВП НУБіП України Боярська ЛДС
Шляхи вдосконалення розсадництва у розсадниках ВП НУБіП України Боярська ЛДС Перечень болезней, являющихся причинами острых желудочно-кишечных кровотечений
Перечень болезней, являющихся причинами острых желудочно-кишечных кровотечений Колледж педагогического образования, информатики и права
Колледж педагогического образования, информатики и права Оттачиваем производство услуг
Оттачиваем производство услуг Принятие христианства
Принятие христианства Продажи на Яндекс.Маркете
Продажи на Яндекс.Маркете Презентация на тему ТКАНИ И ОРГАНЫ ЧЕЛОВЕКА биология 8 класс
Презентация на тему ТКАНИ И ОРГАНЫ ЧЕЛОВЕКА биология 8 класс  Шифрование
Шифрование Состав финансовой информации
Состав финансовой информации 19 секретов
19 секретов АДМИН
АДМИН