ковалентная неполярная.
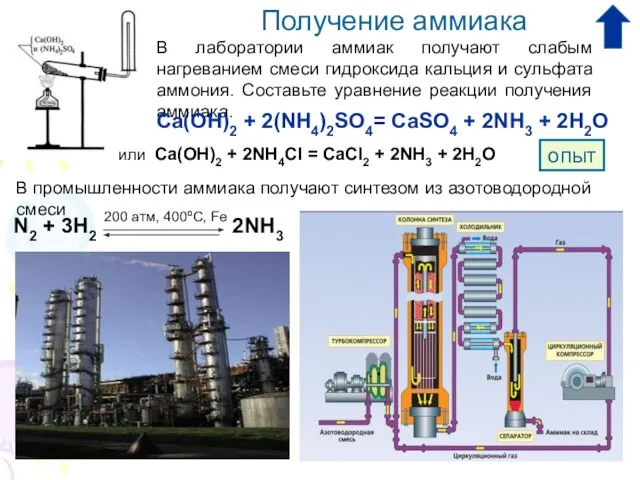
2. Каким способом получают аммиак в лаборатории:
А) прямым синтезом из азота и водорода;
Б) термическим разложением солей аммония;
В) взаимодействием солей аммония со щелочами.
3. Как можно различить хлорид аммония и хлорид натрия:
А) по запаху; Б) по действию нитрата серебра;
В) по действию щелочи при нагревании.
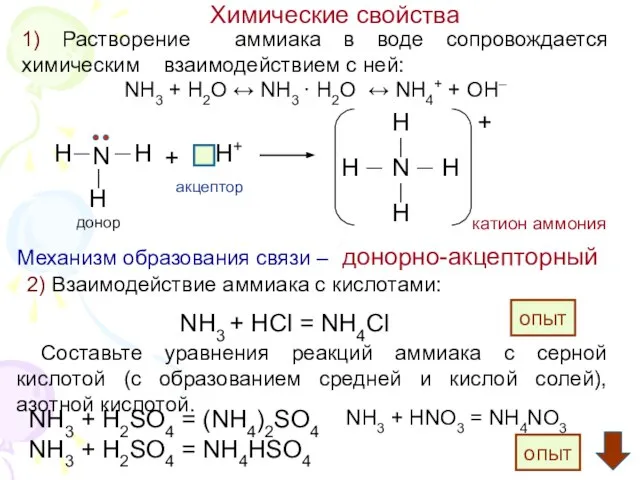
4. Водный раствор аммиака не реагирует:
А) с соляной кислотой; Б) с гидроксидом кальция; В) с водой.
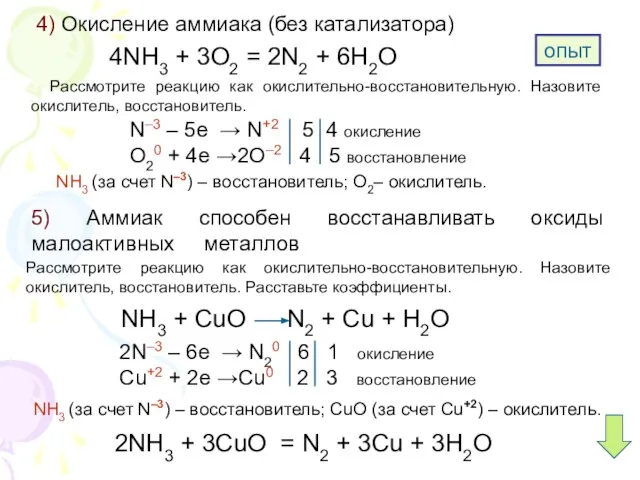
5. Аммиак способен окисляться до свободного азота:
А) без катализатора; Б) при повышенном давлении; В) с катализатором.
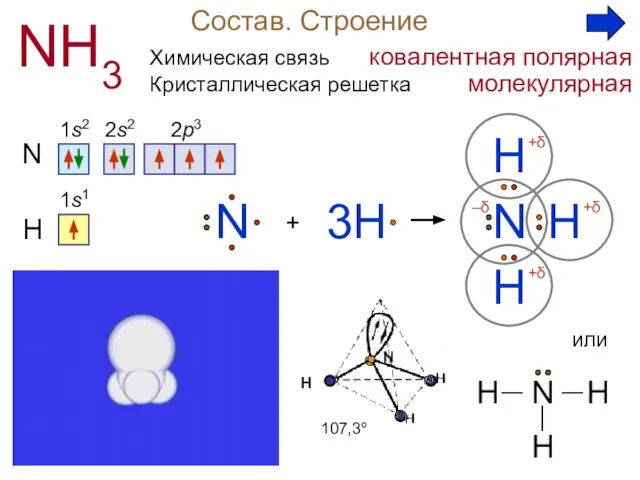
6. Механизм образования иона (катиона) аммония:
А) донорно-акцепторный; Б) ионный; В) радикальный;
7. Уравнению реакции NaOH + NH4Cl = NaCl + NH3 + H2O
cоответствует краткое ионное:
А) NH4+ + H+ = NН4+ Б) NH4+= NН3+ Н+ В) NH4+ + OH¯ = NH3 + H2O
Б
В
В
Б
А
А
В











 Открытый конкурс инновационных и бизнес-идей среди учащихся. СТАРТ
Открытый конкурс инновационных и бизнес-идей среди учащихся. СТАРТ Винни-Пух и все-все-все
Винни-Пух и все-все-все 3D фотографии
3D фотографии Презентация на тему Математическая викторина
Презентация на тему Математическая викторина Его величество –Домашнее Задание
Его величество –Домашнее Задание Самоанализ результатов управленческой деятельности Заместитель директора по учебно-воспитательной работе МБОУ «Школа иску
Самоанализ результатов управленческой деятельности Заместитель директора по учебно-воспитательной работе МБОУ «Школа иску Подростковый возраст и подростковый кризис
Подростковый возраст и подростковый кризис Атлас 7кл. Нов.в
Атлас 7кл. Нов.в Маркировка: нормативное регулирование
Маркировка: нормативное регулирование Реклама кетчупа Heinz
Реклама кетчупа Heinz Народы и традиции
Народы и традиции Подарок
Подарок Районный конкурс
Районный конкурс Феодализм
Феодализм Презентация на тему Королевство Бутан
Презентация на тему Королевство Бутан Суринов Александр Евгеньевич Руководитель Федеральной службы государственной статистики
Суринов Александр Евгеньевич Руководитель Федеральной службы государственной статистики Модели практикоориентированого обучения в зарубежных вузах
Модели практикоориентированого обучения в зарубежных вузах Рисунок – основа изобразительного искусства
Рисунок – основа изобразительного искусства МОУ Атемарская средняя общеобразовательная школа - обладатель Гранта Президента Российской Федерации
МОУ Атемарская средняя общеобразовательная школа - обладатель Гранта Президента Российской Федерации Итоговое повторение "Южная Америка"
Итоговое повторение "Южная Америка" Презентация на тему Семя его строение и значение
Презентация на тему Семя его строение и значение Presentation1
Presentation1 Симптомы кризиса 3-х лет
Симптомы кризиса 3-х лет Структура проектной заявки
Структура проектной заявки Презентация на тему Какие бывают автомобили (для детей)
Презентация на тему Какие бывают автомобили (для детей)  МОДЕЛЬ ПОРТФОЛИО УЧЕНИКА
МОДЕЛЬ ПОРТФОЛИО УЧЕНИКА autopokraska
autopokraska Управление рисками и контроль выполнения политики безопасности с помощью системы ІР-Guard
Управление рисками и контроль выполнения политики безопасности с помощью системы ІР-Guard