Содержание
- 2. Жоспар: Кіріспе Аммиак Негізгі бөлім 1.Аммиактың физикалық, химиялық қасиеттері 2.Өнеркәсіпте алынуы 3.Қолданылуы 4.Қазақстандағы аммиак өндірісі.КазАзот Қорытынды
- 3. Аммиа́к — NH3, сутегі нитриді; қалыпты жағдайда - өткір иісті; (ерітіндісі-мүсәтір спирті); түссіз газ; ауадан шамамен
- 4. Физикалық қасиеті: Аммиак — түссіз, өткір иісті, ауадан екі еседей жеңіл, тұншықтырғыш газ. Балқу температурасы -77,8°С,
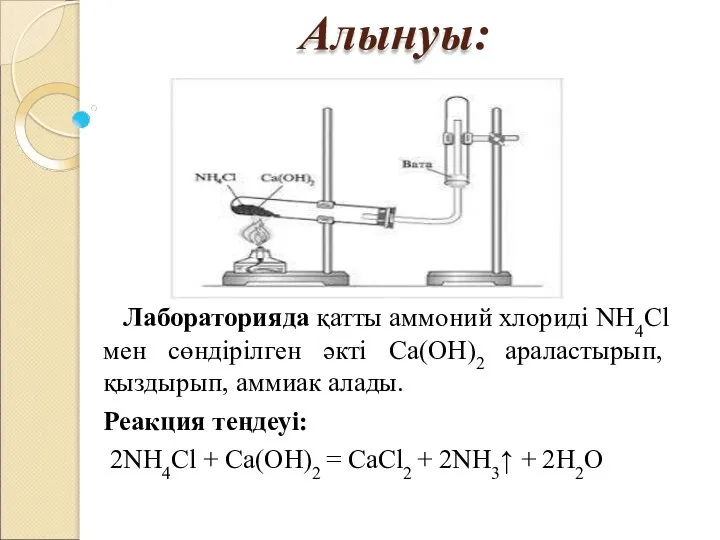
- 5. Алынуы: Лабораторияда қатты аммоний хлориді NH4Cl мен сөндірілген әкті Са(ОН)2 араластырып, қыздырып, аммиак алады. Реакция теңдеуі:
- 6. Өнеркәсіпте алынуы: Аммиак өнеркәсіптік жолмен азотты сутегімен қосу арқылы алады. Азот ауадан, сутегі судан алынады. Алғаш
- 7. Химиялық қасиеттері: 4NH3 + 5 O2 → 4NO + 6H2O (kat: Pt, Cr2O3) 2NH3 + 3CuO
- 8. Қолданылуы Аммиактан минералдық тыңайтқыштар, дәрі-дәрмектер, қопарылғыш заттар, азот қышқылы және нитраттар өндіріледі, аммоний тұздары алынады. Аммиак
- 9. Қазақстандағы аммиак өндірісі.КазАзот ҚазАзот АҚ– Қазақстанның кешенді өнеркәсіп орындарының бірі. Аммиак (сутегі нитриді, NH3) — NH3
- 10. Аммиак қауіпті заттектерге жатады, және оны сақтау және тасымалдау барысында қауіпсіздік ережелерін сақтамау аммиактың төгілуіне, сөйтіп
- 11. КазАзоттың перспективалық агрохимиялық зерттеулері Минералдық тыңайтқыштардың Қазақстандағы әртүрлі ауылшаруашылық дақылдарының шығымдылығына әсерін талдауға және өсімдіктердің дұрыс
- 12. Тест Аммиак молекуласының пішіні: A) кубті. Б) үшбұрышты B) тетраэдрлі C) пирамидальді. D) жалпақ. E) октаэдрлі.
- 13. 6.Аммиактың судағы ерітіндісіндегі универсалды индикатор қағаздың түсін ... өзгертеді. A) көкке. B) қызғылт сарыға. C) ал
- 14. 11.Аммиактың химиялық қасиетін көрсетіңіз: А) Аммиактың судағы ерітіндісі әлсіз негіздік қасиет көрсетеді Б) аммиак пен оттек
- 15. 13.Аммоний тұздары қыздырғанда айрылады: А) (NН4)2SО4 ═ NН3↑ + NН4 НSО4 Б)(NН4)3 РО4 ═ 3NН3↑ +
- 16. Тест жауаптары: 1. С,Ж 2. С,Д 3. А,З,И 4. В,З 5. Д,З 6. С,Ж 7. С,Ж
- 18. Скачать презентацию














 Коммерческое предложение
Коммерческое предложение Календарное планирование в помощь воспитателям ДОУ
Календарное планирование в помощь воспитателям ДОУ Киберспорт. Преимущества. Зрелищность
Киберспорт. Преимущества. Зрелищность The Roman Art
The Roman Art Нравственное воспитание – основа воспитательной деятельности школы. Взаимодействие школы с социумом
Нравственное воспитание – основа воспитательной деятельности школы. Взаимодействие школы с социумом Кто говорит-сеет,кто слушает-собирает,или секреты устной речи
Кто говорит-сеет,кто слушает-собирает,или секреты устной речи Urok_1
Urok_1 Презентация на тему Арарат
Презентация на тему Арарат Потребности человека (6 класс)
Потребности человека (6 класс) Президентская программа Глобальное образование
Президентская программа Глобальное образование Презентация на тему Фейербах и Маркс. Конец классической немецкой философии
Презентация на тему Фейербах и Маркс. Конец классической немецкой философии Домашнее задание для участия в интервью “Город моей мечты”. Шаблон
Домашнее задание для участия в интервью “Город моей мечты”. Шаблон Техники продаж
Техники продаж Проект: робо-рука
Проект: робо-рука Астраханская картинная галерея - жемчужина среди шедевров
Астраханская картинная галерея - жемчужина среди шедевров Дизайн
Дизайн Теория доказательства и аргументации
Теория доказательства и аргументации Корпоративный сайт и Public Relations в Интернете
Корпоративный сайт и Public Relations в Интернете Нива вся белешенька стоит. Золотые зерна осыпаются. Только ветер жатву шевелит. Но ничьи здесь спины не сгибаются.
Нива вся белешенька стоит. Золотые зерна осыпаются. Только ветер жатву шевелит. Но ничьи здесь спины не сгибаются. Компетентностный подход в дошкольном образовании
Компетентностный подход в дошкольном образовании История
История Сила. Силы в природе
Сила. Силы в природе Проект
Проект Технология подготовки и проведенияпрезентаций
Технология подготовки и проведенияпрезентаций Защита диплома
Защита диплома Известным блоггером ты можешь и не стать…
Известным блоггером ты можешь и не стать… Мастер-класс голубая ель
Мастер-класс голубая ель Изонить - оригинальный вид декоративно-прикладного искусства
Изонить - оригинальный вид декоративно-прикладного искусства