Содержание
- 2. ДНК-полимеразы присутствуют во всех клетках про- и эукариот. Некоторые прокариотические и эукариотические ДНК-полимеразы выделены в чистом
- 4. ДНК-пoлимераза I E. coli Выделена А. Корнбергом и сотр. в 1958 г. Изучена наиболее полно. Представляет
- 5. Схема удвоения молекулы ДНК при репликации
- 6. Экзонуклеазные реакции ДНК-полимеразы I. 3’→ 5’-экзонуклеазная активность Кроме полимеризации ДНК-пол.I катализирует две другие реакции. В ходе
- 7. 5’→ 3’-экзонуклеазная активность ДНК-пол.I Вторая реакция также заключается в отщеплении нуклеотидов, но гидролиз идет с 5’-конца
- 8. Ник-трансляция •ДНК-пол. I способна удлинять 3’-конец одной из цепей ДНК в месте разрывов и одновременно удалять
- 9. ДНК-полимераза II Две другие ДНК-полимеразы присутствуют в клетках E. сoli в меньших количествах. ДНК-пол. II (мол.масса
- 10. ДНК-полимераза III-холофермент Ключевой фермент, ответственный за репликацию ДНК E. coli. Кор- фермент ДНК-пол. III состоит из
- 11. ДНК-полимераза III-холофермент ДНК-полимераза III (мол. масса 103 кДа) — играет главную роль в репли- кации ДНК
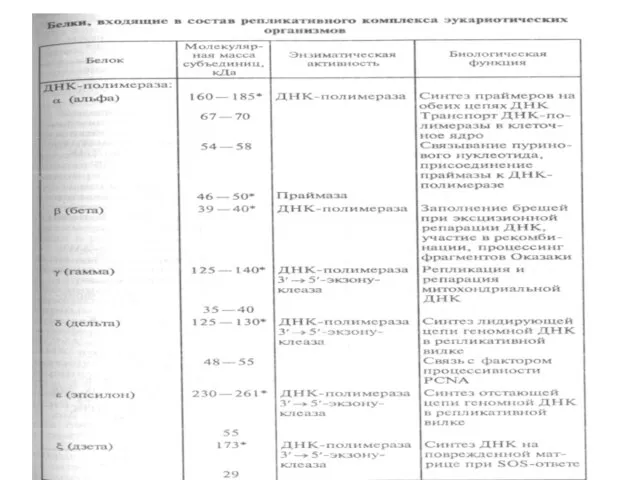
- 12. ДНК-полимеразы эукариот Механизмы репликации ДНК у эукариот менее изучены из-за их большей сложности. Основные результаты получены
- 14. ДНК-полимераза α — первая ДНК-полимераза, обнаружен- ная в клетках эукариот. Она представлена в клетке в виде
- 15. ДНК-полимераза δ — гетеродимер, состоящий из каталити- ческой субъединицы (125—130 кДа) и субъединицы 48 — 55
- 16. ДНК-полимераза ε, выделена из клеток HeLa, содержит два полипептида — каталитический 261 кДа и полипептид 55
- 17. ДНК-полимераза γ локализована в митохондриях, ее функция связана с репликацией и репарацией митохондриальной ДНК, она кодируется
- 18. Таким образом, поскольку эукариотические ДНК-полимеразы α и β лишены 3′ → 5 ′ и 5 ′
- 19. Модель работы димерной полимеразы(ДНК-пол.III); координация синтеза ДНК на комплементарных цепях Элонгация репликации. Модель полуконсерва- тивной прерывистой
- 20. Преодоление антипараллельности цепей при репликации за счет возникновения петли Холофермент ДНК-полимеразы III может обра- зовывать димер
- 21. Роль вспомогательных белков в синтезе ДНК ДНК-праймаза. ДНК-полимеразы не способны инициировать синтез новых цепей ДНК, они
- 22. На стадии инициации репликации короткую РНК-затравку из рибонуклеозидтрифосфатов синтезирует фермент, называ- емый ДНК-праймазой. ДНК-праймаза может быть
- 23. ДНК-лигаза ДНК-лигаза. ДНК-лигазы вирусов, бактерий, млекопитающих соединяют 5'-фосфатную и З'-гидроксильную группы нуклеотидов, находящихся на противоположных концах
- 24. Хеликаза Раскручивание, или расплетание, спирали происходит в локальном участке ДНК. Эту реакцию осуществляет хеликаза — ДНК-зависимая
- 25. ДСБ-белки (SSB-белки) Белки, связывающиеся с одноцепочечной ДНК. ДСБ-белки связываются с сахарофосфатным остовом одиночных цепей ДНК, не
- 26. Модель инициации репликации ДНК у Escherichia coli Геном Е. coli реплицируется двунаправленно от одной точки начала
- 27. Регуляция инициации репликации у E. coli Хромосома Е. coli содержит единственную область начала репликации (oriC), размер
- 28. Белок Dna В (хеликаза) в виде гексамеров в комплексе с шестью мономерами белка Dna С, каждый
- 29. Схема инициации репликации хромосомы E. coli
- 30. Этапы инициации репликации ДНК E. coli.1 – белок dna A формирует тетрамеры, связывающиеся со специфическими сайтами
- 31. Терминация репликации Терминация репликации проис- ходит тогда, когда встречаются две репликативные вилки при удвоении кольцевых молекул
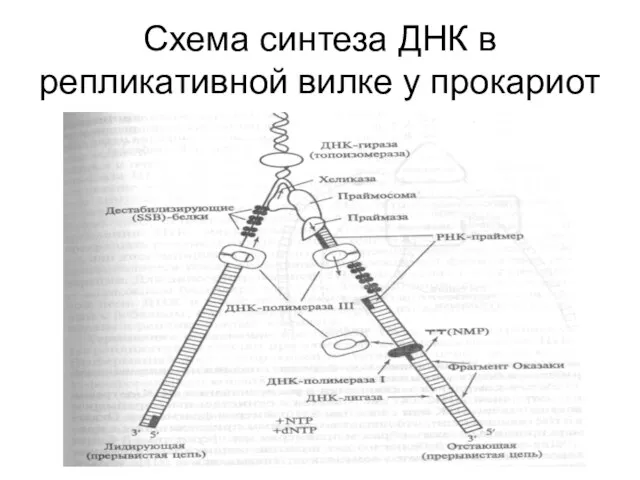
- 32. Схема синтеза ДНК в репликативной вилке у прокариот
- 33. Бокуть, с.122
- 34. Репликация ДНК у эукариот Рассмотрим особенности репликации эукариот на примере дрожжей – Saccharomyces сеrеvisiae. Точки начала
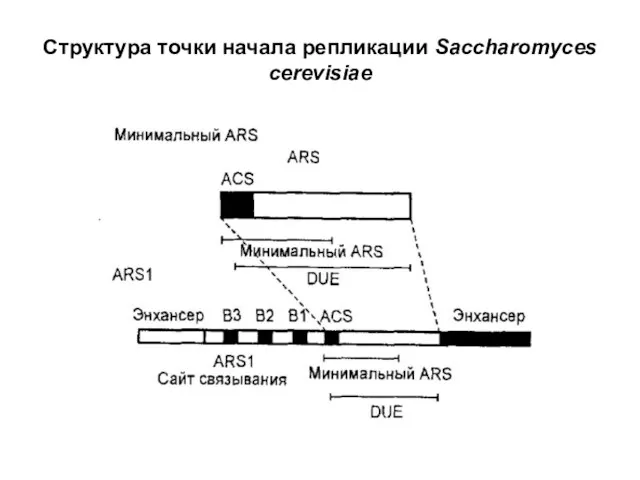
- 35. Структура точки начала репликации Saccharomyces cerevisiae
- 37. Скачать презентацию
Слайд 2ДНК-полимеразы присутствуют во всех клетках про- и
эукариот. Некоторые прокариотические и эукариотические
ДНК-полимеразы присутствуют во всех клетках про- и
эукариот. Некоторые прокариотические и эукариотические

ДНК-полимеразы выделены в чистом виде, и их
ферментативные и физические свойства охарактеризованы.
Физические свойства этих ферментов не совсем идентичны,
но механизм катализа, который они осуществляют, в общих
чертах одинаков: каждая из них способна удлинять цепь ДНК,
наращивая ее посредством присоединения каждого
последующего нуклеотида к 3’-концу цепи ДНК или РНК.
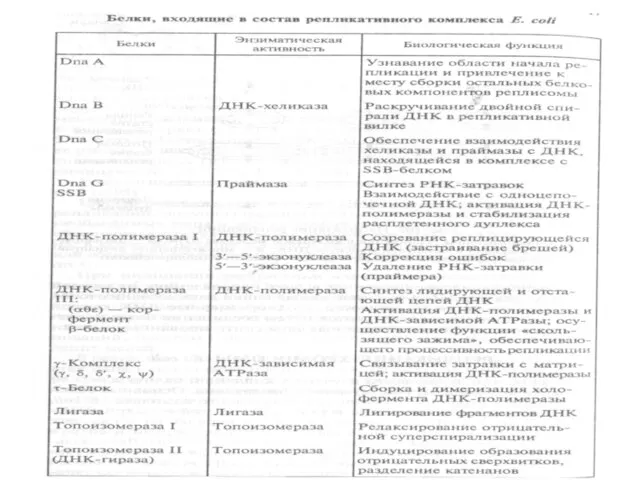
Основные белки и ферменты, входящие в состав
репликативного комплекса E. сoli, а также их функции,
указаны в таблице. У E. сoli есть три ДНК-полимеразы– I, II и
III (названия даны по мере их открытия).
ДНК-полимеразы про- и эукариот
Слайд 4ДНК-пoлимераза I E. coli
Выделена А. Корнбергом и сотр. в 1958 г.
ДНК-пoлимераза I E. coli
Выделена А. Корнбергом и сотр. в 1958 г.

Изучена наиболее полно. Представляет собой
одиночный полипептид с мультифункциональ-
ными активностями. Для осуществления
реакции полимеризации ферменту необходим
праймер, содержащий свободную 3’-ОН-
группу и матрица, детерминирующая
присоединение нужного нуклеотида.
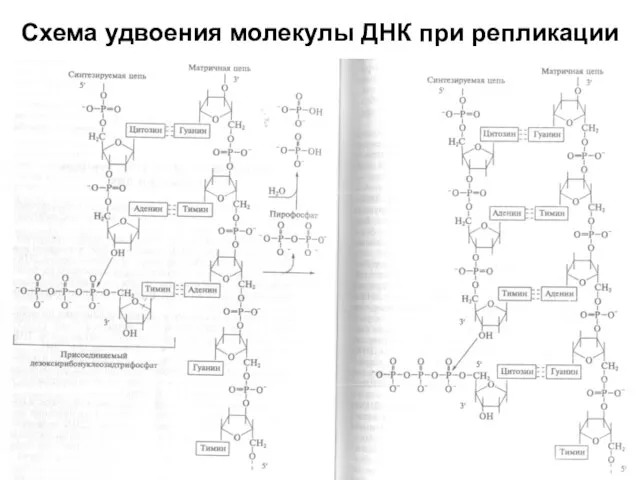
Слайд 5Схема удвоения молекулы ДНК при репликации
Схема удвоения молекулы ДНК при репликации
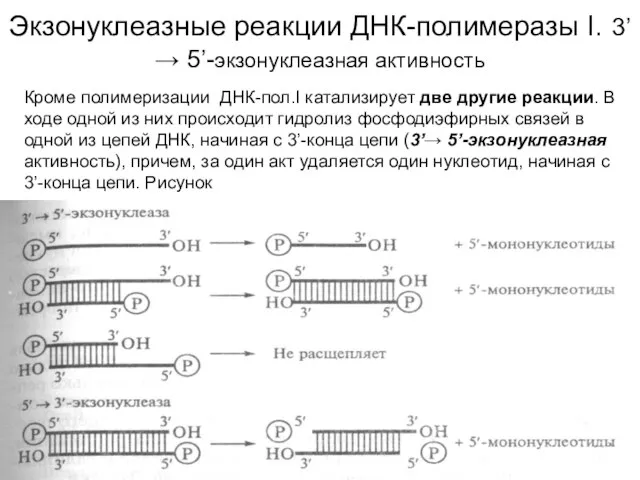
Слайд 6Экзонуклеазные реакции ДНК-полимеразы I. 3’→ 5’-экзонуклеазная активность
Кроме полимеризации ДНК-пол.I катализирует две другие
Экзонуклеазные реакции ДНК-полимеразы I. 3’→ 5’-экзонуклеазная активность
Кроме полимеризации ДНК-пол.I катализирует две другие
Слайд 75’→ 3’-экзонуклеазная активность ДНК-пол.I
Вторая реакция также заключается в отщеплении нуклеотидов, но
гидролиз
5’→ 3’-экзонуклеазная активность ДНК-пол.I
Вторая реакция также заключается в отщеплении нуклеотидов, но
гидролиз

активность).
Различные активности ДНК-пол.I принадлежат разным участкам
полипептидной цепи с молекулярной массой 109 000 дальтон.
Большой С-концевой участок (76 000 дальтон) проявляет 5’→3’-
полимеразную и 3’→ 5’-экзонуклеазную активности.
Малый, N-концевой, фрагмент (36 000 дальтон) обладает только
5’→ 3’-экзонуклеазной активностью.
Большой фрагмент называется также фрагментом Кленова, он способен
инициировать репликацию in vitro. 3’→ 5’-экзо-нуклеазная активность
обеспечивает контроль за присоединением каждого последующего
нуклеотида и удаление ошибочно вставленного нуклеотида с
растущего конца цепи ДНК. С помощью 5’→ 3’-экзонуклеазной активности
вырезаются праймеры.
Слайд 8Ник-трансляция
•ДНК-пол. I способна удлинять 3’-конец одной из цепей ДНК в
месте разрывов
Ник-трансляция
•ДНК-пол. I способна удлинять 3’-конец одной из цепей ДНК в
месте разрывов

конца того же разрыва. Этот процесс называется ник-
трансляцией. Он играет ключевую роль в репарации
повреждений ДНК.
В клетке E. coli имеется несколько сотен молекул ДНК-
пол.I. В целом ДНК-пол.I имеет большее отношение к
созреванию реплицирующейся ДНК, чем непосредственно к
полимеразным процессам в репликативной вилке.
•ДНК-полимераза I и присущие ей экзонуклеазные активности
играют большую роль в репликации и репарации хромосом-
ной ДНК Е. coli. Экзонуклеазная активность 3' → 5'
обеспечивает контроль за присоединением каждого
нуклеотида и удаление ошибочных нуклеотидов с растущего
конца цепи.
Слайд 9ДНК-полимераза II
Две другие ДНК-полимеразы присутствуют в клетках E. сoli в
меньших количествах.
ДНК-полимераза II
Две другие ДНК-полимеразы присутствуют в клетках E. сoli в
меньших количествах.

ДНК-пол. II (мол.масса 90 кДа) представлена одной
полипептидной цепью, обладает полимеразной и 3’→ 5’-экзонуклеазной
активностями. Она плохо соединяется с одноцепочечными ДНК, но лучше
работает с биспиральной ДНК, имеющей одноцепочечные бреши длиной в
несколько десятков нуклеотидов, обладает лишь 10 %-й ДНК-
полимеразной активностью по сравнению с ДНК-полимеразой I.
Предполагают, что основной функцией ДНК-полимеразы II является
достраивание поврежденных участков в молекуле ДНК, т. е. репарация
ДНК.
Она может заполнять пробелы между фрагментами ДНК за счет
полимеразной активности, но не способна отщеплять РНК-нуклеотиды от
фрагментов Оказаки (т.к. не обладает 5’→3’-экзонуклеазной активностью)
или осуществлять ник-трансляцию.
Слайд 10ДНК-полимераза III-холофермент
Ключевой фермент, ответственный за репликацию ДНК E. coli. Кор-
фермент ДНК-пол. III
ДНК-полимераза III-холофермент
Ключевой фермент, ответственный за репликацию ДНК E. coli. Кор-
фермент ДНК-пол. III

субъединица обладает полимеразной активностью, а ε-субъединица
3’→ 5’-экзонуклеазной активностью. Комплекс α и ε-субъединиц характе-
ризуется более высокими полимеразной и 3’→ 5’-экзонуклеазной актив-
ностями, чем каждая из соответствующих субъединиц в отдельности.
Функция третьей θ-субъединицы кор-фермента пока не выяснена. Кроме
указанных в состав ДНК-пол. III входят еще семь субъединиц: γ,β,δ,δ’,ψ…
Таким образом, общая молекулярная масса ДНК-пол.III составляет 10³
килодальтон. Роль β-субъединицы заключается в том, чтобы максимально
снизить вероятность отделения фермента от матрицы до завершения
процесса копирования. Точная функция других субъединиц неизвестна.
ДНК-пол.III обладает повышенным сродством к матрице и характеризуется
более высокой эффективностью копирования, чем ДНК-пол I.
Слайд 11ДНК-полимераза III-холофермент
ДНК-полимераза III (мол. масса 103 кДа) — играет главную роль в
ДНК-полимераза III-холофермент
ДНК-полимераза III (мол. масса 103 кДа) — играет главную роль в

кации ДНК у Е. coli. В каждой клетке содержится только 10— 20 копий
фермента, приблизительно столько же, сколько репликативных вилок.
ДНК-полимераза III является основным компонентом ферментного комп-
лекса, инициирующего формирование репликативных вилок в точках
начала репликации.
ДНК-полимераза III состоит из десяти типов субъединиц (α,β,γ,с,δ,δ’,
θ,ε..). Репликацию проводит полная форма фермента — холофермент,
содержащий все субъединицы. Холофермент не обладает 5'→3'-экзо-
нуклеазной активностью, в связи с чем для репликации отстающей цепи
необходимо участие ДНК-полимеразы I. Полимеразную реакцию осущест-
вляет каталитический кор из α,ε и θ-субъединиц, в котором α-субъединица
обладает полимеразной активностью, ε-субъединица — 3'→5'-экзонуклеа-
зной активностью, функция θ-субъединицы пока неясна. Помимо субъеди-
ниц, составляющих полимеразный кор, ДНК-полимераза III-холофермент
содержит еще семь субъединиц. Эти полипептиды существуют во множес-
тве копий, являются регуляторными и усиливают действие каталитическо-
го ядра (кора) ДНК-полимеразы III.
Отличительная черта холофермента ДНК-полимеразы III — исключи-
тельно высокая процессивность. Мерой процессивности является длина
фрагмента вновь синтезированной макромолекулы, которую комплекс
(или индивидуальные ферменты) способен образовывать в одном цикле,
не диссоциируя от матрицы. Установлено, что холофермент ДНК-полиме-
разы III синтезирует ведущую цепь ДНК длиной в 50 ООО нуклеотидов со
скоростью более 500 нуклеотидов в секунду в одном цикле, ни разу не
диссоциируя от ДНК-матрицы.
Слайд 12ДНК-полимеразы эукариот
Механизмы репликации ДНК у эукариот менее изучены из-за их большей
сложности.
ДНК-полимеразы эукариот
Механизмы репликации ДНК у эукариот менее изучены из-за их большей
сложности.

вируса SV40, в которой процесс репликации исследовали в зараженных
клетках человека, культивируемых in vitro. В этой системе вирусный белок,
называемый Т-антигеном, выполняет многие функции, необходимые для
репликации вирусной ДНК. Он является белком-инициатором, обладает
ДНК-хеликазной активностью и необходим для правильного взаимодей-
ствия с ДНК ферментного комплекса, синтезирующего праймеры.
В то же время вирус SV40 использует для репликации своей небольшой
хромосомы и многие белки клетки-хозяина, что позволяет исследовать
функционирование репликативного комплекса клеток человека в такой
относительно простой системе.
ДНК-полимеразы эукариот. В клетках эукариот имеются по меньшей
мере шесть различных ДНК-зависимых ДНК-полимераз: α, β, δ,ε,γ,ζ.
Четыре из них — α, β, δ,ε — непосредственно участвуют в репликации
хромосомной ДНК (табл. 18).
Слайд 14ДНК-полимераза α — первая ДНК-полимераза, обнаружен-
ная в клетках эукариот. Она представлена в
ДНК-полимераза α — первая ДНК-полимераза, обнаружен-
ная в клетках эукариот. Она представлена в

прочного комплекса с ДНК-праймазой — ферментом,
осуществляющим синтез РНК-затравок. Комплекс ДНК-
полимераза α-праймаза является единственным у эукариот
ферментативным ансамблем, способным инициировать
синтез ДНК de novo. В ходе репликации в клеточных ядрах
ДНК полимераза α-праймаза синтезирует затравку лидиру-
ющей нити в участке ori и затравки фрагментов Оказаки
запаздывающей нити.
Как правило, ДНК-полимераза не обладает корректорской
3'→5'-экзонуклеазной активностью. По-видимому, в ходе
эволюции экзонуклеазный центр в данном ферменте
редуцировался.
ДНК-полимераза β является наименьшей по размеру и самой простой по
строению ДНК-полимеразой в клетках эукариот. Основная функция ДНК-
пол.β в клетке связана с эксцизионной репарацией ядерной ДНК (заполнение
пробелов при репарации).
Слайд 15ДНК-полимераза δ — гетеродимер, состоящий из каталити-
ческой субъединицы (125—130 кДа) и субъединицы
ДНК-полимераза δ — гетеродимер, состоящий из каталити-
ческой субъединицы (125—130 кДа) и субъединицы

кДа, необходимой для преодоления ферментом структурных
барьеров в природных однонитевых матрицах и для связи с
фактором процессивности PCNA (от англ. Proliferating Cell
Nuclear Antigen –ядерный антиген пролиферирующих
клеток). Три молекулы PCNA образуют кольцевой тример с
отверстием для двунитевой ДНК в центральной части,
который представляет собой перемещающуюся по ДНК
подвижную платформу или «скользящую скрепку» в форме
тора (бублика), удерживающую ДНК-полимеразу δ в ходе
полимеризации на матрице и обеспечивающую высокопро-
цессивный синтез ДНК. Хотя PCNA и прокариотический
фактор процессивности субъединица β ДНК-полимеразы III
Е. coli имеют низкую гомологию на уровне первичной
структуры, оба белка формируют близкие по пространствен-
ной геометрии структуры «скользящей скрепки».
Слайд 16ДНК-полимераза ε, выделена из клеток HeLa, содержит два
полипептида — каталитический 261
ДНК-полимераза ε, выделена из клеток HeLa, содержит два
полипептида — каталитический 261

Каталитический полипептид обладает ДНК-полимеразной и
3'→5‘-экзонуклеазной активностями. Особенностью холо-
фермента ДНК-полимеразы ε по сравнению с ДНК-полимера-
зой δ является его меньшая зависимость от вспомогательных
факторов (PCNA, RFС - репликативный фактор С и RPA –
репликативный ядерный белок А), а также низкая (почти на
порядок) скорость синтеза ДНК.
Это различие, возможно, связано с разной функцией ДНК-
полимераз в репликативной вилке. Один холофермент, ДНК-
полимераза δ осуществляет быстрый и процессивный синтез
лидирующей нити, используя для элонгации единственную
затравку, синтезируемую ДНК-полимеразой α-праймазой в
районе ori, и диссоциирует только по достижении конца
репликона, тогда как несколько холоферментов ДНК-полиме-
разы ε могут одновременно синтезировать фрагмены Оказаки
в «зоне Оказаки», удлиняя затравки, синтезируемые ДНК-
полимеразой α-праймазой в начале каждого фрагмента.
Слайд 17ДНК-полимераза γ локализована в митохондриях, ее функция связана с
репликацией и репарацией
ДНК-полимераза γ локализована в митохондриях, ее функция связана с
репликацией и репарацией

ядерным геномом. ДНК-полимераза γ способна направлять высокопро-
цессивную полимеризацию на однонитевых ДНК-матрицах в отсутствие
вспомогательных факторов.
Охарактеризованы также другие ДНК-полимеразы эукариот: ή, θ, REV1 и
др. Все эти ферменты участвуют в репарации ДНК.
В последние годы наряду с углубленным изучением строения и свойств
отдельных ДНК-полимераз эукариот большое внимание уделяется
взаимодействию этих ферментов со вспомогательными факторами и
механизму функционирования их в составе многокомпонентных
репликативных и репаративных комплексов. Список белков, взаимодей-
ствующих с ДНК-полимеразами, постоянно растет и включает не только
известные факторы PCNA, RFC и RPA, но и ключевые факторы регуляции
клеточного метаболизма, такие, как белки группы МСМ (minichromosome
maintenance factors), факторы узнавания участков ori репликации ORC
(origin recognition complex) и др.
Слайд 18Таким образом, поскольку эукариотические
ДНК-полимеразы α и β лишены 3′ → 5
Таким образом, поскольку эукариотические
ДНК-полимеразы α и β лишены 3′ → 5

3 ′ -экзонуклеазных активностей, становится
понятным участие ДНК-полимераз δ и ε в
процессе репликации ядерной ДНК в качестве
корректирующих ферментов, а ДНК-полиме-
разе ε приписывают также функцию удаления
РНК-праймеров на концах фрагментов
Оказаки.
Слайд 19Модель работы димерной полимеразы(ДНК-пол.III); координация синтеза ДНК на комплементарных цепях
Элонгация репликации. Модель
Модель работы димерной полимеразы(ДНК-пол.III); координация синтеза ДНК на комплементарных цепях
Элонгация репликации. Модель

тивной прерывистой репликации ДНК в реплика-
тивной вилке представлена на рис. Дуплекс
родительской молекулы ДНК расплетает АТР-
зависимая хеликаза. Образующиеся одноцепо-
чечные участки покрывает SSB-белок. ДНК-пол.
III движется по одной из матричных цепей в нап-
равлении раскрывания вилки и синтезирует ве-
дущую цепь ДНК. По другой, матричной цепи в
том же направлении движется праймосома
(комплекс белков, осуществляющий инициацию
репликации). Время от времени, входящая в
состав праймосомы праймаза (белок Dna G),
Синтезирует РНК-затравки для отстающей цепи.
Вторая молекула холофермента ДНК-пол. III
удлиняет эти затравки до тех пор, пока не дос-
тигнет предыдущей затравки, т.е. она синтези-
рует фрагменты Оказаки длиной от 1000 до
2000 н. Удаление сегментов РНК с 5'-конца каж-
дого фрагмента Оказаки осуществляет ДНК-
пол.I, используя свою 5'→3'-кзонуклеазную
активность. Заполнение брешей между фраг-
ментами Оказаки катализируется той же ДНК-
полимеразой I. Одноцепочечный разрыв заши-
вает ДНК-лигаза. Таким образом, из серии фраг-
ментов Оказаки образуется новая цепь.
Слайд 20Преодоление антипараллельности цепей при репликации за счет возникновения петли
Холофермент ДНК-полимеразы III может
Преодоление антипараллельности цепей при репликации за счет возникновения петли
Холофермент ДНК-полимеразы III может
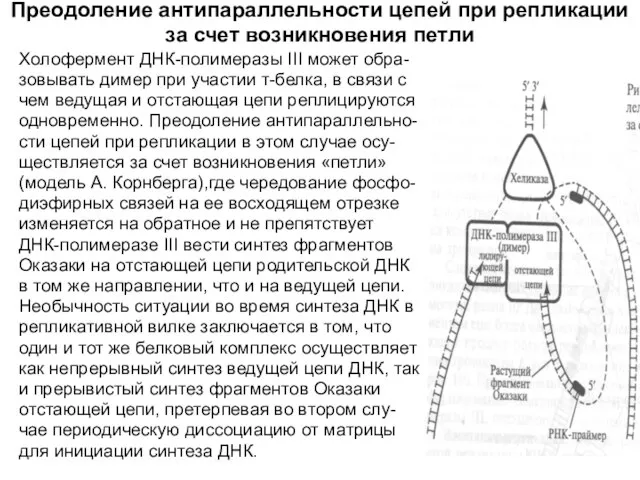
зовывать димер при участии т-белка, в связи с
чем ведущая и отстающая цепи реплицируются
одновременно. Преодоление антипараллельно-
сти цепей при репликации в этом случае осу-
ществляется за счет возникновения «петли»
(модель А. Корнберга),где чередование фосфо-
диэфирных связей на ее восходящем отрезке
изменяется на обратное и не препятствует
ДНК-полимеразе III вести синтез фрагментов
Оказаки на отстающей цепи родительской ДНК
в том же направлении, что и на ведущей цепи.
Необычность ситуации во время синтеза ДНК в
репликативной вилке заключается в том, что
один и тот же белковый комплекс осуществляет
как непрерывный синтез ведущей цепи ДНК, так
и прерывистый синтез фрагментов Оказаки
отстающей цепи, претерпевая во втором слу-
чае периодическую диссоциацию от матрицы
для инициации синтеза ДНК.
Слайд 21Роль вспомогательных белков в синтезе ДНК
ДНК-праймаза. ДНК-полимеразы не
способны инициировать синтез новых
Роль вспомогательных белков в синтезе ДНК
ДНК-праймаза. ДНК-полимеразы не
способны инициировать синтез новых
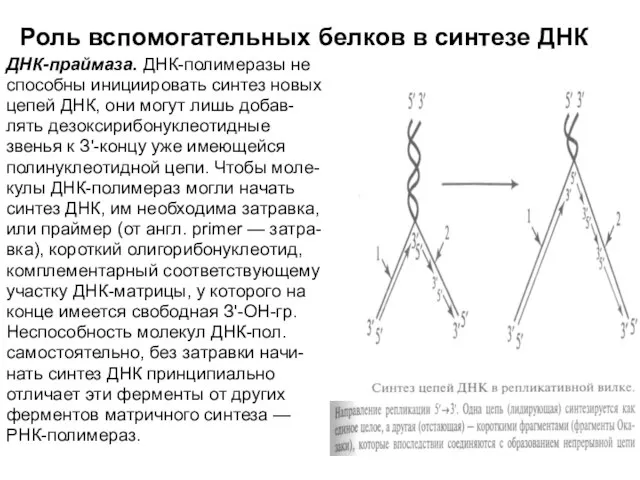
цепей ДНК, они могут лишь добав-
лять дезоксирибонуклеотидные
звенья к З'-концу уже имеющейся
полинуклеотидной цепи. Чтобы моле-
кулы ДНК-полимераз могли начать
синтез ДНК, им необходима затравка,
или праймер (от англ. primer — затра-
вка), короткий олигорибонуклеотид,
комплементарный соответствующему
участку ДНК-матрицы, у которого на
конце имеется свободная З'-ОН-гр.
Неспособность молекул ДНК-пол.
самостоятельно, без затравки начи-
нать синтез ДНК принципиально
отличает эти ферменты от других
ферментов матричного синтеза —
РНК-полимераз.
Слайд 22На стадии инициации репликации короткую РНК-затравку из
рибонуклеозидтрифосфатов синтезирует фермент, называ-
емый ДНК-праймазой.
На стадии инициации репликации короткую РНК-затравку из
рибонуклеозидтрифосфатов синтезирует фермент, называ-
емый ДНК-праймазой.

ферментом (как у бактерий) или входить в качестве субъеди-
ницы в ДНК-полимеразу (как у ДНК-полимеразы α эукариот).
В любом случае праймаза — это фермент, отличный от РНК-
полимераз, которые синтезируют разнообразные клеточные
РНК. После того как будет синтезирован РНК-праймер,
подключается ДНК-полимераза и продолжает наращивать
цепь. Новосинтезированные цепи ДНК всегда содержат на 5'-
конце несколько рибонуклеотидов: у прокариот — от двух до
пяти нуклеотидов, у эукариот их в два раза больше. В
дальнейшем короткие праймеры замещаются сегментами
ДНК.
Слайд 23ДНК-лигаза
ДНК-лигаза. ДНК-лигазы вирусов, бактерий,
млекопитающих соединяют 5'-фосфатную и
З'-гидроксильную группы нуклеотидов,
находящихся
ДНК-лигаза
ДНК-лигаза. ДНК-лигазы вирусов, бактерий,
млекопитающих соединяют 5'-фосфатную и
З'-гидроксильную группы нуклеотидов,
находящихся
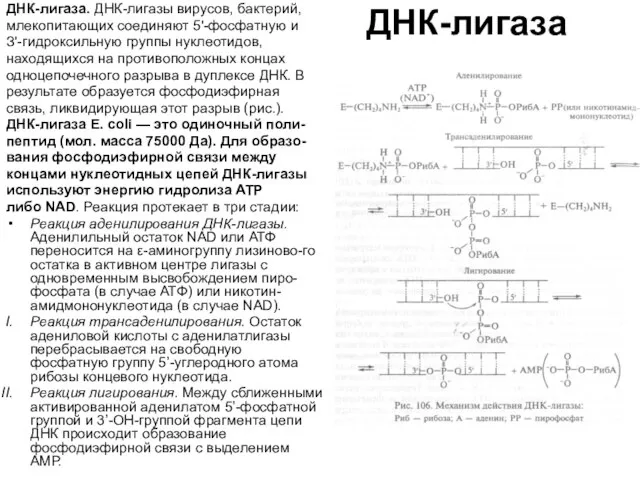
одноцепочечного разрыва в дуплексе ДНК. В
результате образуется фосфодиэфирная
связь, ликвидирующая этот разрыв (рис.).
ДНК-лигаза Е. coli — это одиночный поли-
пептид (мол. масса 75000 Да). Для образо-
вания фосфодиэфирной связи между
концами нуклеотидных цепей ДНК-лигазы
используют энергию гидролиза АТР
либо NAD. Реакция протекает в три стадии:
Реакция аденилирования ДНК-лигазы. Аденилильный остаток NAD или АТФ переносится на ε-аминогруппу лизиново-го остатка в активном центре лигазы с одновременным высвобождением пиро-фосфата (в случае АТФ) или никотин-амидмононуклеотида (в случае NAD).
Реакция трансаденилирования. Остаток адениловой кислоты с аденилатлигазы перебрасывается на свободную фосфатную группу 5’-углеродного атома рибозы концевого нуклеотида.
Реакция лигирования. Между сближенными активированной аденилатом 5’-фосфатной группой и 3’-ОН-группой фрагмента цепи ДНК происходит образование фосфодиэфирной связи с выделением АМР.
Слайд 24Хеликаза
Раскручивание, или расплетание, спирали происходит в локальном
участке ДНК. Эту реакцию осуществляет
Хеликаза
Раскручивание, или расплетание, спирали происходит в локальном
участке ДНК. Эту реакцию осуществляет

АТРаза, использующая энергию гидролиза АТР для расплетания
двойной спирали ДНК. Хеликазы имеют кольцевую (тороидальную)
структуру, образованную шестью субъединицами. Такие гексамерные
хеликазы кольцеобразной формы обнаружены у фагов, вирусов, бактерий,
архей, эукариот (рис.). Хеликаза, движимая гидролизом АТР, однонаправ
ленно перемещается по одной из цепей ДНК (вероятно, за счет ее конфор-
мационных изменений), расплетая перед собой двойную спираль, в
результате чего возникает вилка (Y) из двуцепочечного участка ДНК и двух
одноцепочечных ветвей.
Слайд 25ДСБ-белки (SSB-белки)
Белки, связывающиеся с одноцепочечной ДНК. ДСБ-белки
связываются с сахарофосфатным остовом одиночных
ДСБ-белки (SSB-белки)
Белки, связывающиеся с одноцепочечной ДНК. ДСБ-белки
связываются с сахарофосфатным остовом одиночных

ДНК, не закрывая оснований, что не мешает комплементарно-
му присоединению нуклеотидов в ходе репликации. ДСБ-
белок Е. coli наиболее изучен, он представляет собой тетра-
мер, характеризуется высокой степенью асимметрии
молекулы.
ДСБ-белки стабилизируют одноцепочечную ДНК, обеспечи-
вая условия для комплементарного спаривания, удаляют
Возможные элементы вторичной структуры ДНК(например,
предотвращают образование шпилечных структур);
связывание одноцепочечной ДНК с ДСБ-белками стимулирует
ДНК-полимеразу и повышает точность ее работы.
У эукариот таковым белком является ядерный репликатив-
ный белок A (RPA), представляющий гетеротример с
субъединицами 70, 32 —34 и 11 — 14 кДа.
Слайд 26Модель инициации репликации ДНК у Escherichia coli
Геном Е. coli реплицируется
двунаправленно
Модель инициации репликации ДНК у Escherichia coli
Геном Е. coli реплицируется
двунаправленно
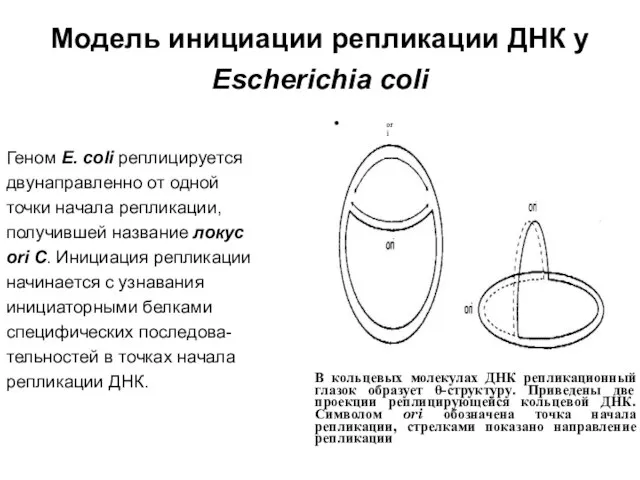
точки начала репликации,
получившей название локус
ori С. Инициация репликации
начинается с узнавания
инициаторными белками
специфических последова-
тельностей в точках начала
репликации ДНК.
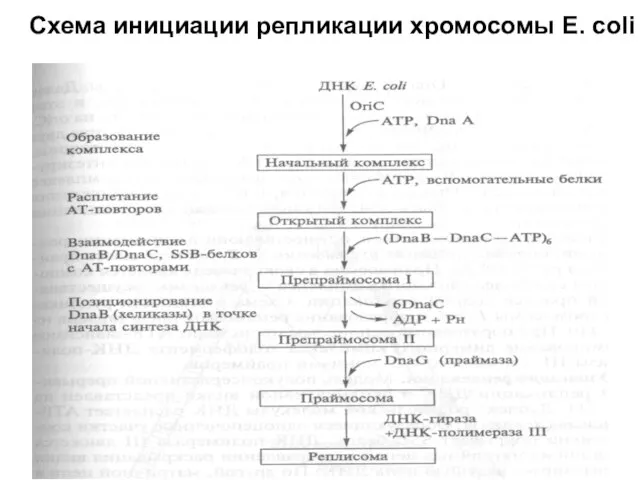
Слайд 27Регуляция инициации репликации у E. coli
Хромосома Е. coli содержит единственную область начала
Регуляция инициации репликации у E. coli
Хромосома Е. coli содержит единственную область начала

(oriC), размер которой составляет 258 н.п. В oriC имеется пять
консенсусных девятинуклеотидных сайтов связывания инициаторного
белка Dna А, названных Dna А-боксами. В левой части oriC наряду с Dna
А-боксами находятся АТ-богатые 13-нуклеотидные повторы. Белок Dna
А распознает область начала репликации и образует комплекс с другими
белками.
Сначала белок Dna А в комплексе с АТР взаимодействует с Dna А-
боксами. С помощью электронной микроскопии исходный комплекс
обнаруживается в виде компактной эллипсоидной структуры, содержащей
-20 мономеров Dna А, которая закрывает oriC. В этом комплексе частично
расплетаются АТ-богатые повторы и формируется открытый комплекс. В
этом процессе участвуют некоторые вспомогательные белки, которые
помогают инициатору Dna А раскручивать и изгибать ДНК (ранее они
обозначались n, n', n", i, а. В последнее время их обозначают IME, FIS-
факторы и т.д.).
Слайд 28Белок Dna В (хеликаза) в виде гексамеров в комплексе с шестью
мономерами
Белок Dna В (хеликаза) в виде гексамеров в комплексе с шестью
мономерами

АТР, а именно (Dna В —Dna С—АТР)6, взаимодействует с
одноцепочечными участками частично расплетенной ДНК. В этом
комплексе хеликазная активность Dna В блокирована. Транслокация
Dna В (хеликазы) от места ее первоначального вхождения в комплекс к
месту старта репликативной вилки и высвобождение из комплекса
белка Dna С, вызывает активацию хеликазы. Далее хеликаза
взаимодействует с белком Dna G (праймазой), и этот комплекс играет
ключевую роль в инициации репликации на oriС.
Оба фермента обеспечивают сопряженное функционирование двух
репликативных вилок, движущихся в противоположные стороны;
хеликаза начинает расплетать дуплекс ДНК, праймаза синтезирует
первые затравки. В сформированном праймирующем комплексе
присутствие белка Dna А не требуется, и он после освобождения
из комплекса может быть повторно использован для репликации
на другом оriС.
Слайд 29Схема инициации репликации хромосомы E. coli
Схема инициации репликации хромосомы E. coli
Слайд 30Этапы инициации репликации ДНК E. coli.1 – белок dna A формирует тетрамеры,
Этапы инициации репликации ДНК E. coli.1 – белок dna A формирует тетрамеры,
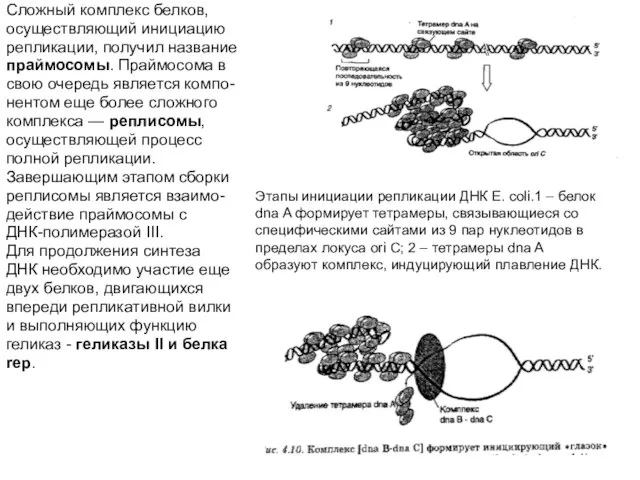
Сложный комплекс белков,
осуществляющий инициацию
репликации, получил название
праймосомы. Праймосома в
свою очередь является компо-
нентом еще более сложного
комплекса — реплисомы,
осуществляющей процесс
полной репликации.
Завершающим этапом сборки
реплисомы является взаимо-
действие праймосомы с
ДНК-полимеразой III.
Для продолжения синтеза
ДНК необходимо участие еще
двух белков, двигающихся
впереди репликативной вилки
и выполняющих функцию
геликаз - геликазы II и белка
rep.
Слайд 31Терминация репликации
Терминация репликации проис-
ходит тогда, когда встречаются
две репликативные вилки при
удвоении
Терминация репликации
Терминация репликации проис-
ходит тогда, когда встречаются
две репликативные вилки при
удвоении
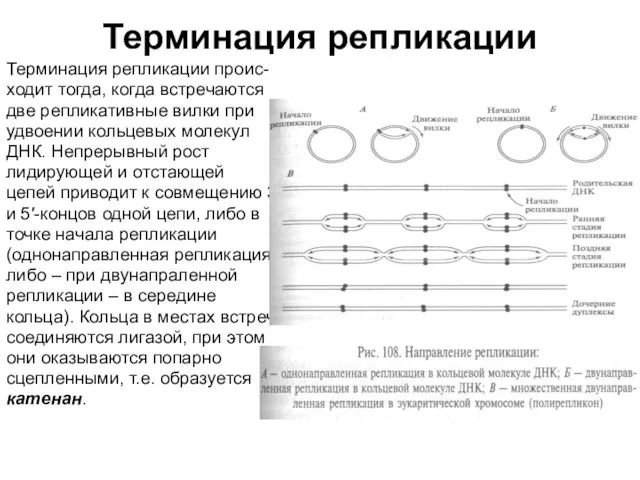
ДНК. Непрерывный рост
лидирующей и отстающей
цепей приводит к совмещению 3′
и 5′-концов одной цепи, либо в
точке начала репликации
(однонаправленная репликация,
либо – при двунапраленной
репликации – в середине
кольца). Кольца в местах встречи
соединяются лигазой, при этом
они оказываются попарно
сцепленными, т.е. образуется
катенан.
Слайд 32Схема синтеза ДНК в репликативной вилке у прокариот
Схема синтеза ДНК в репликативной вилке у прокариот
Слайд 33Бокуть, с.122
Бокуть, с.122

Слайд 34Репликация ДНК у эукариот
Рассмотрим особенности репликации эукариот на примере дрожжей –
Saccharomyces
Репликация ДНК у эукариот
Рассмотрим особенности репликации эукариот на примере дрожжей –
Saccharomyces

структурных компонента - последовательность из 11 пар оснований (ACS), называ-
емую элементом узнавания инициатора, которая входит в состав функциона-
льной автономно реплицирующейся последовательности (ARS), и области,
представляющей собой легко расплетаемый участок ДНК - DUE (DNA unwinding
element). Кроме того, для функционирования точки начала репликации необходи-
мы еще три последовательности, называемые Bl, В2 и ВЗ. Структурный элемент
ВЗ представляет собой сайт взаимодействия с белковым ARS фактором 1,
который действует одновременно как транскрипционный фактор. Исходя из этих
данных была предложена модель, в соответствии с которой организация точки
начала репликации у эукариот сходна с организацией элементов промоторов.
Кроме того, в точке начала репликации был обнаружен «глушитель» транскрипции,
который необходим для инициации репликации и для репрессии транскрипции. В
целом, у эукариот в точках начала репликации, вероятно, действуют транскрипци-
онные факторы (позитивно и/или негативно), которые приводят к раскрыванию
DUE-элемента и последующему введению компонентов репликативной
машины.
Слайд 35Структура точки начала репликации Saccharomyces cerevisiae
Структура точки начала репликации Saccharomyces cerevisiae
 Ход реализации пилотных проектов Росреестра на территории республики, а также создание региональной модели инфраструктуры прост
Ход реализации пилотных проектов Росреестра на территории республики, а также создание региональной модели инфраструктуры прост Пройдём с тобой по школьным этажам …
Пройдём с тобой по школьным этажам … Бал во дворце. Урок изобразительного искусства (5 класс)
Бал во дворце. Урок изобразительного искусства (5 класс) Биоинформатика
Биоинформатика Новоладожская детская школа искусств. Обучение детей росписи по ткани в технике холодного батика
Новоладожская детская школа искусств. Обучение детей росписи по ткани в технике холодного батика Кофейня «Blanco y negro»
Кофейня «Blanco y negro» ИНФОРМАЦИЯ О КОМПАНИИ
ИНФОРМАЦИЯ О КОМПАНИИ Презентация на тему Животный мир Арктики и Антарктиды
Презентация на тему Животный мир Арктики и Антарктиды  День полиции
День полиции Должностная инструкция
Должностная инструкция Подготовительные недели Великого Поста
Подготовительные недели Великого Поста Легко ли быть изобретателем?
Легко ли быть изобретателем? Итоговая аттестация выпускников старшей школы. ГОУСОШ №820
Итоговая аттестация выпускников старшей школы. ГОУСОШ №820 28-я Международная специализированная выставка Реклама 2021
28-я Международная специализированная выставка Реклама 2021 What are they wearing gtame
What are they wearing gtame Спешите стать терпимей и добрей
Спешите стать терпимей и добрей Презентация на тему Слово Предложение
Презентация на тему Слово Предложение Политическая система общества
Политическая система общества  Презентация на тему Любовная лирика Пушкина
Презентация на тему Любовная лирика Пушкина  «Алфавит - животные» (в загадках и картинках)
«Алфавит - животные» (в загадках и картинках) Палеозой
Палеозой Игра «Знатоки квадратных уравнений»
Игра «Знатоки квадратных уравнений» Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов
Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов дз
дз Риски информационной безопасности при передаче систем на аутсорсинг
Риски информационной безопасности при передаче систем на аутсорсинг Политический анализ
Политический анализ Штефан Кукс Stephan Kux Отдел Экономики Economic Development Кантон Цюрих Canton of Zurich
Штефан Кукс Stephan Kux Отдел Экономики Economic Development Кантон Цюрих Canton of Zurich  Стажировка в АО Сибур-Нефтехим (специалист планово-экономического отдела)
Стажировка в АО Сибур-Нефтехим (специалист планово-экономического отдела)