Содержание
- 2. Брейн – ринг проводится как фрагмент зачёта за курс 9 – го класса. Форма зачёта –
- 3. I раунд Не бойтесь! Вы всё знаете!
- 4. Молекулы и атомы Дать определения атому, молекуле. 100
- 5. Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной
- 6. Молекулы и атомы 200 Что такое «химический элемент»?
- 7. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом. Основные элементы Земли I раунд
- 8. Молекулы и атомы 300 Что такое «изотопы»?
- 9. Изотопы – элементы с одним порядковым номером, но с разной атомной массой I раунд
- 10. Молекулы и атомы 400 Что такое «ионы»?
- 11. Ионы – заряженные частицы, образующиеся в результате отрыва (присоединения) электронов от атома с образованием энергетически устойчивых
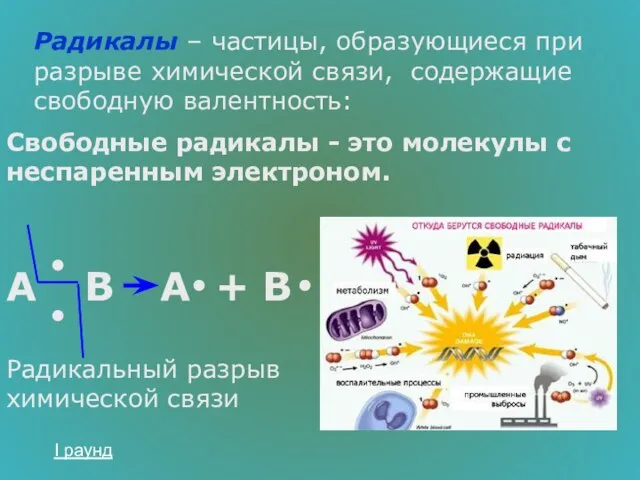
- 12. Молекулы и атомы 500 Что такое «радикалы»?
- 13. Радикалы – частицы, образующиеся при разрыве химической связи, содержащие свободную валентность: Свободные радикалы - это молекулы
- 14. Периодическая система элементов 100 Дать определение периодической системы
- 15. Периодическая система – это графическое представление периодического закона в виде прямоугольной таблицы. Она состоит из периодов
- 16. Периодическая система элементов 200 Дать определение периода
- 17. Период – горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным газом. Свойства элементов в периоде
- 18. Периодическая система элементов 300 Дать определение группы элементов
- 19. Группа элементов – ряд элементов по вертикали, сходных по химическим свойствам. Номер группы показывает высшую валентность
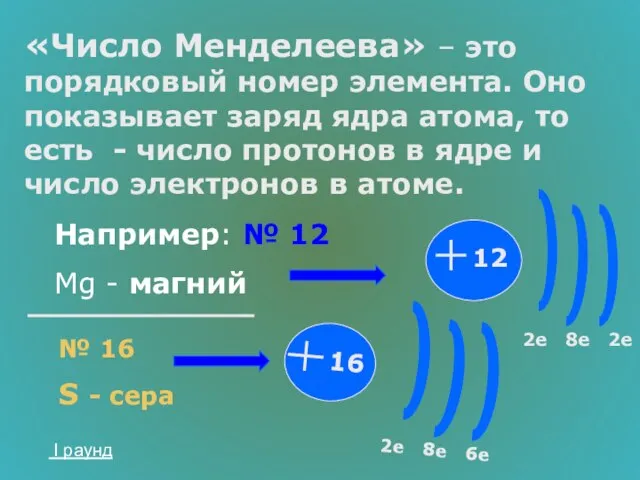
- 20. Периодическая система элементов 400 Что показывает «число Менделеева»?
- 21. «Число Менделеева» – это порядковый номер элемента. Оно показывает заряд ядра атома, то есть - число
- 22. Периодическая система элементов 500 Как объяснить периодические изменения свойств элементов?
- 23. Периодические изменения свойств элементов объясняются периодическим изменением числа электронов на последнем электронном уровне: Ура!!! I раунд
- 24. II раунд Ну, это вам будет потруднее!
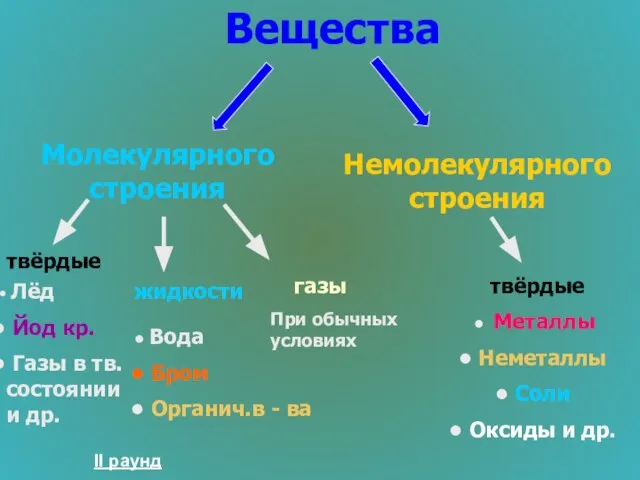
- 25. Строение вещества 100 Приведите примеры веществ молекулярного и немолекулярного строения
- 26. Вещества Молекулярного строения Немолекулярного строения твёрдые жидкости твёрдые Лёд Йод кр. Газы в тв. состоянии и
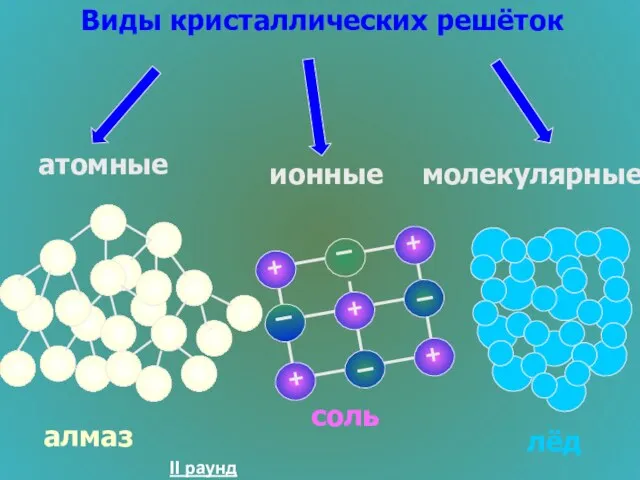
- 27. Строение вещества 200 Какие виды кристаллических решёток вам известны?
- 28. Виды кристаллических решёток атомные алмаз ионные молекулярные соль лёд II раунд
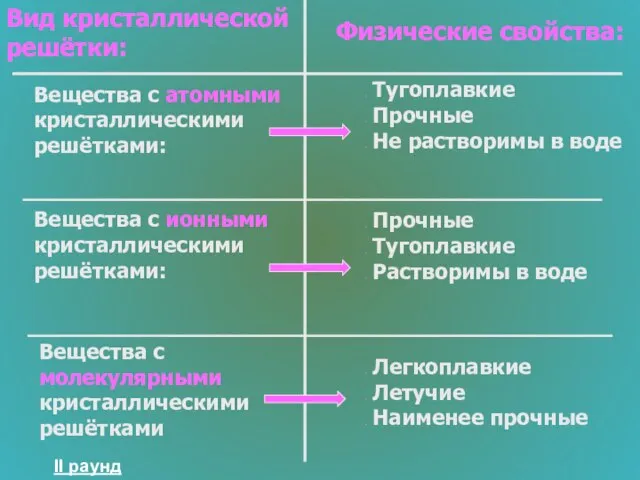
- 29. Строение вещества 300 Привести примеры зависимости свойств веществ от вида кристаллических решёток
- 30. Вещества с атомными кристаллическими решётками: Тугоплавкие Прочные Не растворимы в воде Вещества с ионными кристаллическими решётками:
- 31. Строение вещества 400 Что такое «аллотропия»?
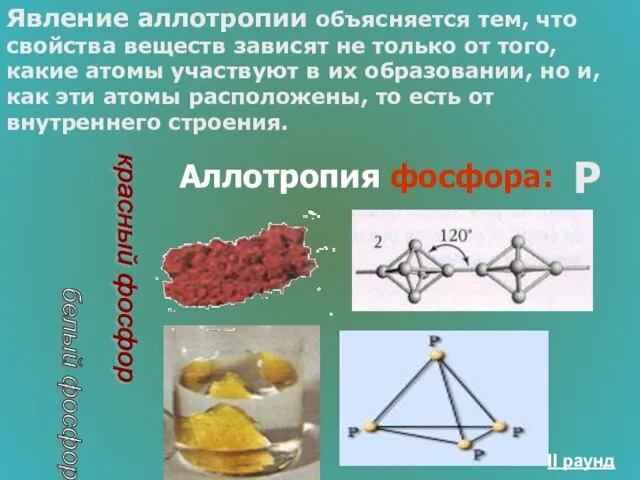
- 32. Аллотропия – способность химического элемента образовывать несколько простых веществ. Например, углерод С образует: II раунд
- 33. Строение вещества 500 Как можно объяснить явление аллотропии?
- 34. Явление аллотропии объясняется тем, что свойства веществ зависят не только от того, какие атомы участвуют в
- 35. Металлы 100 Какое определение металлам дал М.В.Ломоносов?
- 36. М. В. Ломоносов определял металлы как «светлые блестящие тела, которые ковать можно» II раунд
- 37. Металлы 200 Какой металл нашёл наибольшее применение в электротехнике?
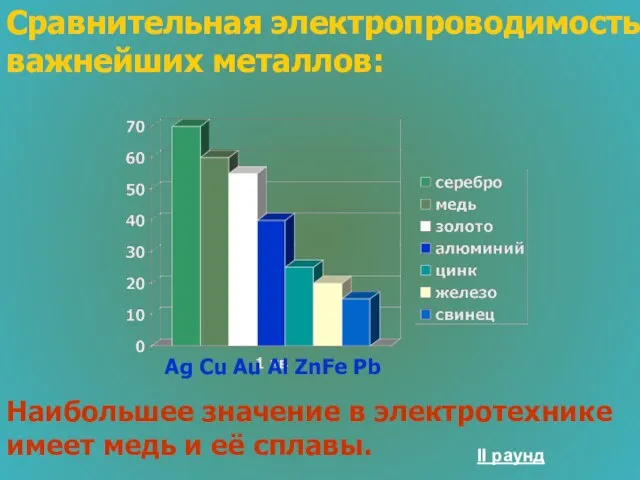
- 38. Сравнительная электропроводимость важнейших металлов: Наибольшее значение в электротехнике имеет медь и её сплавы. Ag Cu Au
- 39. Металлы 300 Что общего в поведении всех металлов в химических реакциях?
- 40. Все металлы в химических реакциях являются восстановителями, то есть отдают валентные электроны и окисляются. Металлы всегда
- 41. Металлы 400 Назовите щелочные металлы и расскажите об их применении
- 42. Щелочные металлы: Литий Li, натрий Na, калий К, рубидий Rb, цезий Cs Применение: Na применяется как
- 43. Металлы 500 Какие металлы называются переходными и почему?
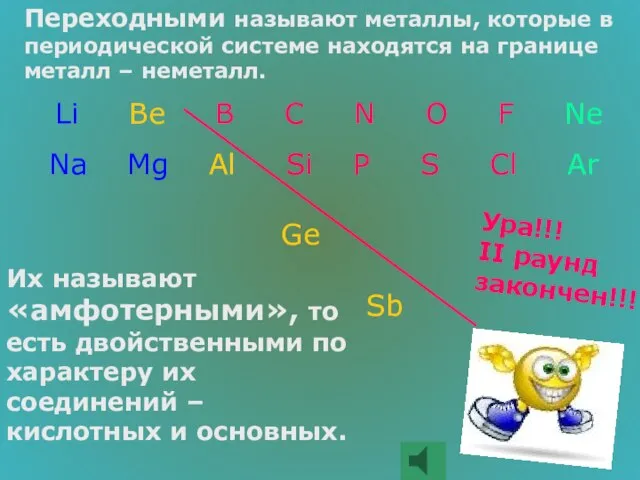
- 44. Переходными называют металлы, которые в периодической системе находятся на границе металл – неметалл. Li Be B
- 45. финал Газовый закон А.Авогадро 100 Следствия из закона Авогадро 100 Закон Джона Дальтона 100
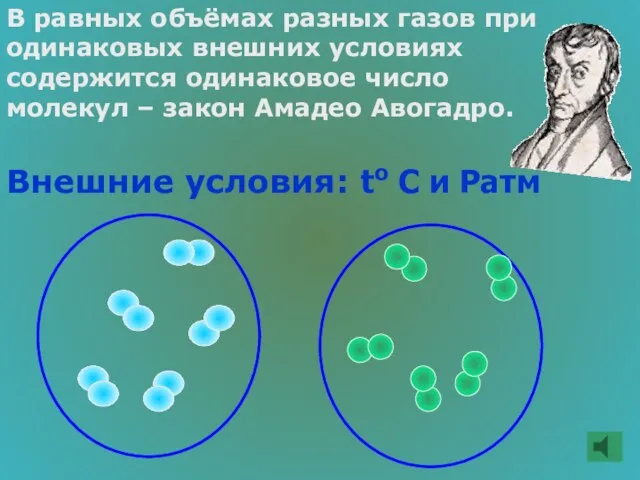
- 46. В равных объёмах разных газов при одинаковых внешних условиях содержится одинаковое число молекул – закон Амадео
- 47. I следствие: равное число молекул при одинаковых внешних условиях занимает одинаковые объёмы. II следствие: 1 моль
- 48. Отношение доли каждого элемента к его атомной относительной массе можно выразить простыми целыми числами: Закон кратных
- 50. Скачать презентацию






































 Презентация на тему Основные инфекционные заболевания и их профилактика
Презентация на тему Основные инфекционные заболевания и их профилактика Митральные пороки
Митральные пороки  Влияние компьютерных игр на здоровье младших школьников и определение компьютерной зависимости
Влияние компьютерных игр на здоровье младших школьников и определение компьютерной зависимости Презентация на тему Пальчиковая гимнастика
Презентация на тему Пальчиковая гимнастика  “Мастерская для инноваций”
“Мастерская для инноваций” В каких странах говорят на английском языке?
В каких странах говорят на английском языке? В ожидании Рождества. Фотоальбом
В ожидании Рождества. Фотоальбом В.Б. Тарасов МГТУ им. Н.Э.Баумана, Кафедра «Компьютерные системы автоматизации производства» e-mail:
В.Б. Тарасов МГТУ им. Н.Э.Баумана, Кафедра «Компьютерные системы автоматизации производства» e-mail:  Административная ответственность
Административная ответственность МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ ВЕРБАЛЬНЫХ И НЕВЕРБАЛЬНЫХ ЕДИНИЦ В ДИАЛОГЕ II Б. ДЕЙКТИЧЕСКИЕ ЖЕСТЫ И РЕЧЕВЫЕ АКТЫ Крейдлин Г. Е. (РГГУ,
МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ ВЕРБАЛЬНЫХ И НЕВЕРБАЛЬНЫХ ЕДИНИЦ В ДИАЛОГЕ II Б. ДЕЙКТИЧЕСКИЕ ЖЕСТЫ И РЕЧЕВЫЕ АКТЫ Крейдлин Г. Е. (РГГУ,  Технология как часть общечеловеческой культуры
Технология как часть общечеловеческой культуры Коммуникационные технологии
Коммуникационные технологии  Атмосфера: значение, строение, изучение
Атмосфера: значение, строение, изучение Презентация на тему Вода в природе 3 класс
Презентация на тему Вода в природе 3 класс  Презентация на тему Фалес Милетский
Презентация на тему Фалес Милетский Реки
Реки Блинчики-Мск. Проект
Блинчики-Мск. Проект Презентация на тему Чтобы путь был счастливым (3 класс)
Презентация на тему Чтобы путь был счастливым (3 класс) Развитие социальной психологии
Развитие социальной психологии проект ккт
проект ккт Установка коннектора компрессора на новых корейских компрессорах!
Установка коннектора компрессора на новых корейских компрессорах! Я РАДА ПРИВЕТСТВОВАТЬ ВАС НА УРОКЕ ФИЗИКИ
Я РАДА ПРИВЕТСТВОВАТЬ ВАС НА УРОКЕ ФИЗИКИ общая характеристика растений
общая характеристика растений Новогодний хороводНам очень веселоВозьмёмся за руки.. - презентация
Новогодний хороводНам очень веселоВозьмёмся за руки.. - презентация Биохимия почек и мочеобразования
Биохимия почек и мочеобразования Сертификация систем качества
Сертификация систем качества Презентация на тему Экологические факторы. Антропогенное воздействие на экосистемы
Презентация на тему Экологические факторы. Антропогенное воздействие на экосистемы Птичья азбука
Птичья азбука