Содержание
- 2. А1 А2 А3 А4 А5 А6 А7 А8 А9 А10 А11 А12 А13 А14 А15 А16
- 3. А1. Число электронов в ионе железа Fe2+ равно 1) 54 2) 28 3) 58 4) 24
- 4. А2. Среди элементов VIА группы максимальный радиус атома имеет 1) кислород 2) сера 3) теллур 4)
- 5. А3. Водородная связь образуется между молекулами 1) этана 2) бензола 3) водорода 4) этанола К выбору
- 6. А4. Степень окисления, равную + 4, атом серы имеет в соединении 1) H2SO4 2) FeS2 3)
- 7. А5. Веществом молекулярного строения является 1) озон 2) оксид бария 3) графит 4) сульфид калия К
- 8. А6. Амфотерным гидроксидом и кислотой соответственно являются 1) H2SO4 и Zn(OH)Cl 2) Ca(OH)2 и HCl 3)
- 9. А7. В каком ряду химические элементы расположены в порядке усиления металлических свойств? 1) Na, Mg, Al
- 10. А8. Формула высшего оксида хлора 1) Cl2O 2) ClO2 3) Cl2O6 4) Cl2O7 К выбору задания
- 11. А9. Верны ли следующие суждения о меди? А. Для меди характерны степени окисления + 1 и
- 12. А10. Оксид кальция взаимодействует с каждым из трех веществ: 1) кислород, вода, серная кислота 2) соляная
- 13. А11. Гидроксид хрома (III) взаимодействует с каждым из двух веществ: 1) СО2 и HCl 2) SiО2
- 14. А12. Карбонат кальция реагирует с 1) HCl 2) MgO 3) Pb 4) H2O К выбору задания
- 15. А13. В схеме превращений Ba Ba(OH)2 BaCl2 веществами «X» и «Y» соответственно являются 1) KOH и
- 16. А14. Алкины являются структурными изомерами 1) алкадиенов 2) алканов 3) циклоалканов 4) алкенов К выбору задания
- 17. А15. В молекуле какого вещества все атомы углерода находятся в состоянии sp2-гибридизации? 1) гексана 2) гексена
- 18. А16. Характерной реакцией для многоатомных взаимодействие с 1) H2 2) Сu 3) Ag2O (NH3 р-р) 4)
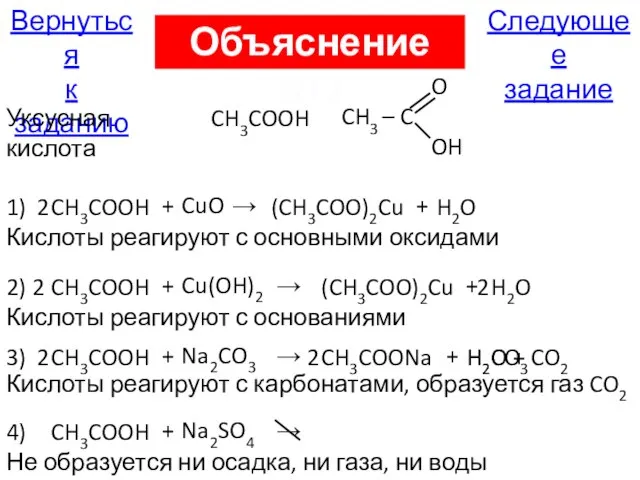
- 19. А17. Уксусная кислота не взаимодействует с 1) CuO 2) Cu(OH)2 3) Na2CO3 4) Na2SO4 К выбору
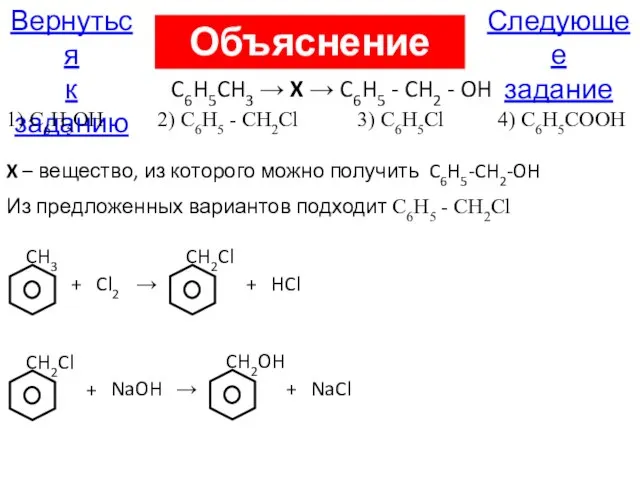
- 20. А18. В схеме превращений C6H5CH3 → X → C6H5 - CH2 - OH веществом «Х» является
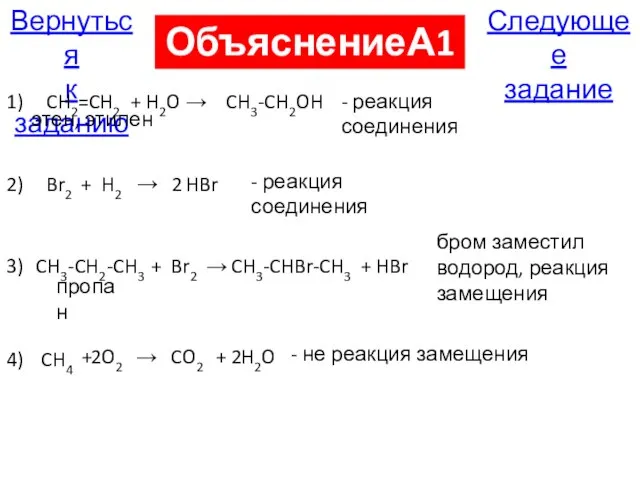
- 21. А19. К реакциям замещения относится взаимодействие 1) этена и воды 2) брома и водорода 3) брома
- 22. А20. С наибольшей скоростью при комнатной температуре протекает реакция между 1) AgNO3(р-р) и NaCl(р-р) 2) CaСО3
- 23. А21. В системе 2CO (г) + O2 (г) 2CO2 (г) + Q смещению химического равновесия в
- 24. А22. В каком ряду все указанные вещества являются неэлектролитами? 1) этанол, хлорид калия, сульфат бария 2)
- 25. А23. С выпадением осадка протекает реакция ионного обмена между растворами 1) гидроксида натрия и хлорида бария
- 26. А24. В какой реакции оксид серы (IV) является восстановителем? 1)SO2 + 2NaOH = Na2SO3 + H2O
- 27. А25. Щелочную реакцию среды имеет раствор каждой из двух солей: 1) КCl и Na2S 2) К2SiO3
- 28. А26. Верны ли следующие суждения о свойствах углеводородов? А. Алканы вступают в реакции полимеризации Б. Этилен
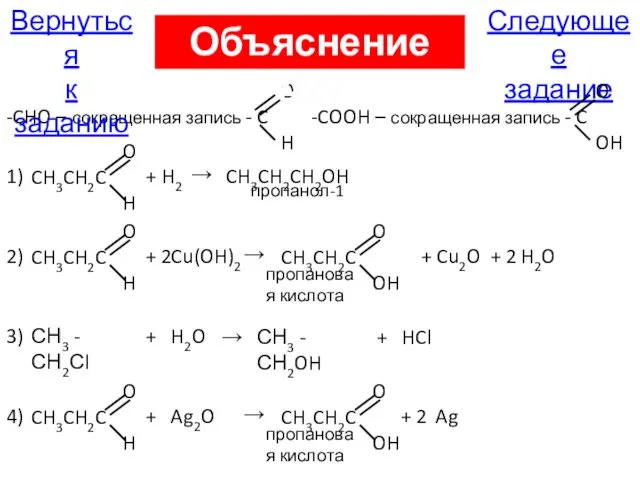
- 29. А27. Пропанол-1 образуется в результате реакции, схема которой 1) СН3СН2СНО + H2 → 2) СН3СН2СНО +
- 30. А28. Белки приобретают желтую окраску под действием 1) HNO3 (конц.) 2) Cu(OH)2 3) H2SO4 (конц.) 4)
- 31. А29. Сырьем для получения метанола в промышленности служат 1) CO и H2 2) HCHO и H2
- 32. А30. Согласно термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г) + 566 кДж при сжигании оксида
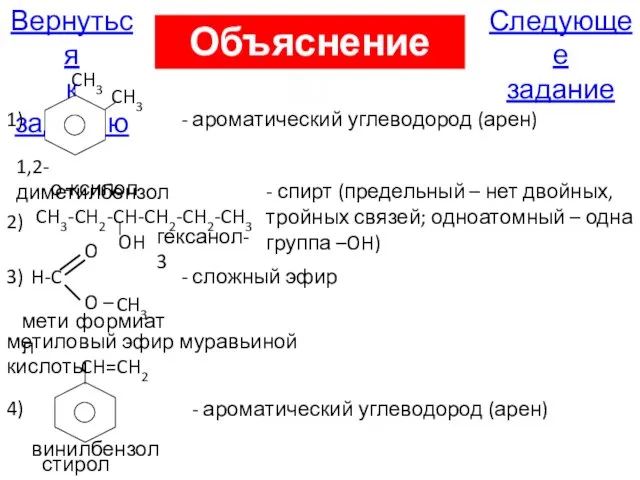
- 33. В1. Установите соответствие между названием органического соединения и классом, к которому оно принадлежит A) 1,2-диметилбензол 1)
- 34. В2. Установите соответствие между формулой вещества и степенью окисления углерода в нем А) CH2Cl2 1) –
- 35. В3. Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его
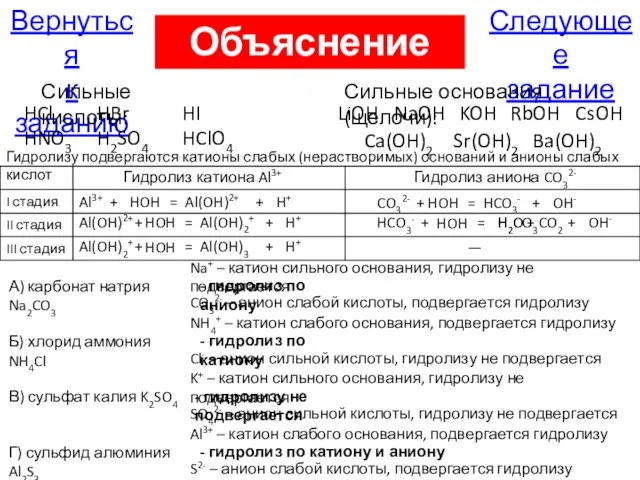
- 36. В4. Установите соответствие между названием соли и её способностью к гидролизу A) карбонат натрия 1) гидролиз
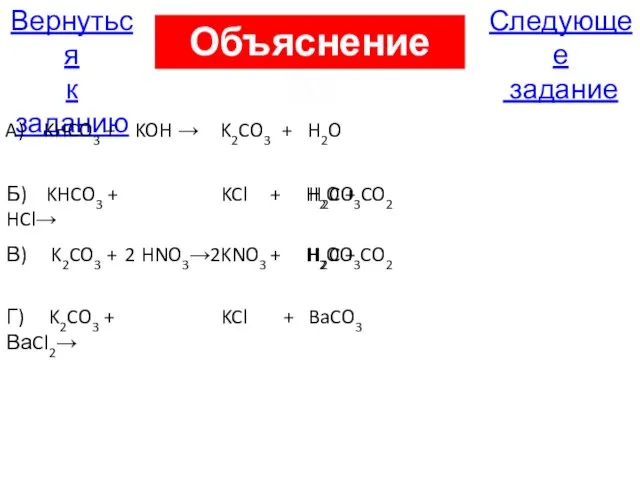
- 37. В5. Установите соответствие между реагирующими веществами и продуктами реакций A) KHCO3 + KOH → 1) KNO3
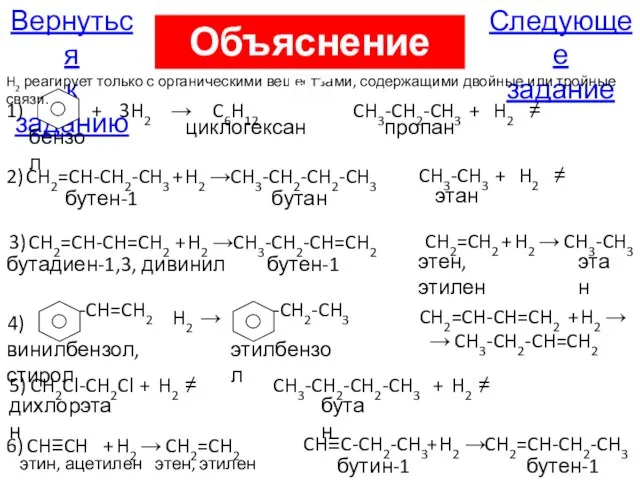
- 38. В6. С водородом взаимодействует каждое из двух веществ: бензол, пропан; бутен, этан; дивинил, этен; стирол, бутадиен-1,3;
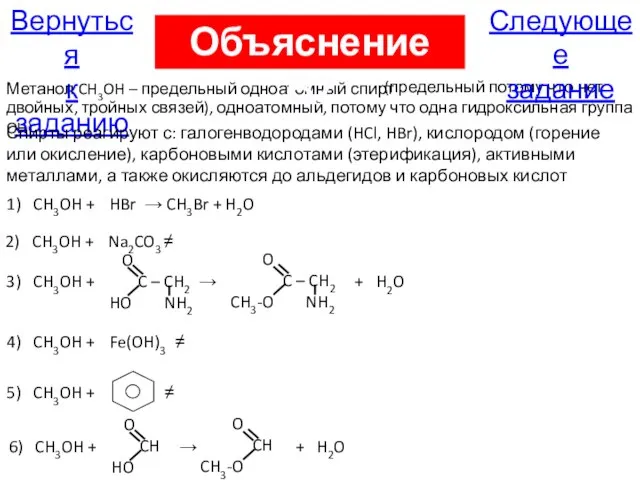
- 39. В7. Метанол взаимодействует с веществами: бромоводород; карбонат натрия; глицин; гидроксид железа (III); бензол; метановая кислота. (2
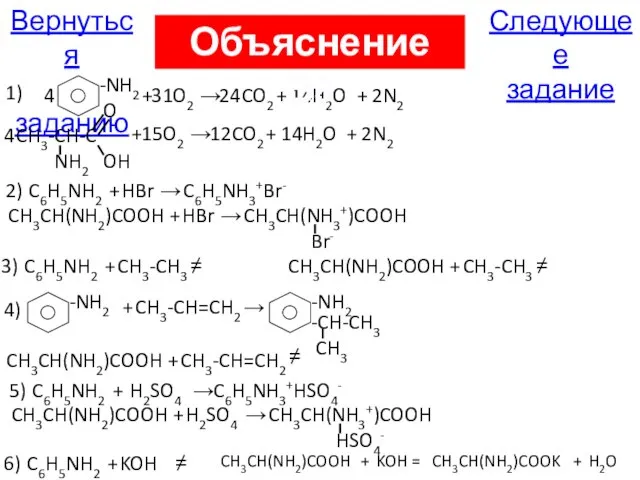
- 40. В8. И с анилином, и с аланином способны реагировать кислород; бромоводород; этан; пропен; серная кислота; гидроксид
- 41. В9. Определите массу воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей
- 42. В10. Рассчитайте массу свинца, полученного в результате взаимодействия 6,6 г цинка с избытком раствора нитрата свинца
- 43. С1. Используя метод электронного баланса, составьте уравнение реакции KMnO4+H2S + H2SO4→MnSO4+S+ ... + ... . Определите
- 44. С2. Даны вещества: - алюминий; - оксид марганца (IV); -водный раствор сульфата меди (II); - концентрированная
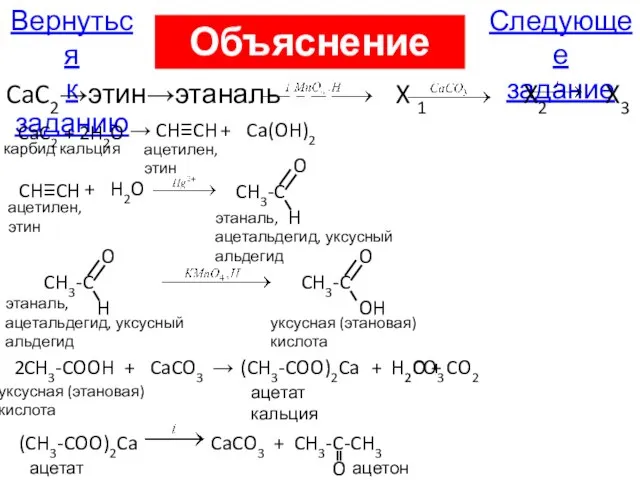
- 45. С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CaC2→этин→этаналь X 1 X2 X3
- 46. С4. Сероводород объемом 5,6 л (н.у.) прореагировал без остатка с 59,02 мл раствора КOH с массовой
- 47. С5. При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л
- 48. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
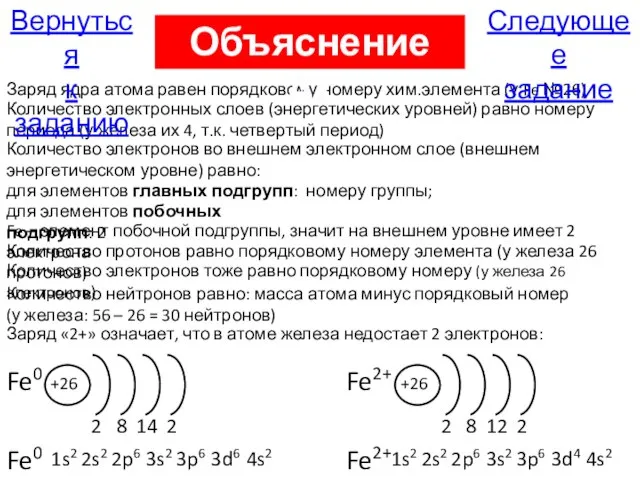
- 49. Fe0 +26 2 8 14 Количество электронных слоев (энергетических уровней) равно номеру периода (у железа их
- 50. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 51. Следующее задание Вернуться к заданию Объяснение А2 Чем ближе к Fr, тем: - больше радиус атома;
- 52. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 53. Следующее задание Вернуться к заданию Объяснение А3 Водородная – это связь между ионом водорода одном молекулы
- 54. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 55. Следующее задание Вернуться к заданию Объяснение А4 Валентность – это число связей, которыми атом соединяется с
- 56. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 57. Следующее задание Вернуться к заданию Объяснение А5 Существует 4 типа строения (кристаллических решеток): 1) Озон O3
- 58. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 59. Следующее задание Вернуться к заданию Объяснение А6 Амфотерные оксиды: BeO, ZnO, PbO, Al2O3, Cr2O3, Fe2O3 Основные
- 60. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 61. Следующее задание Вернуться к заданию ОбъяснениеА7 Чем ближе к Fr, тем: - больше радиус атома сильнее
- 62. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 63. Следующее задание Вернуться к заданию Объяснение А8 Высший – это оксид элемента в максимальной степени окисления
- 64. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 65. Следующее задание Вернуться к заданию Объяснение А9 Некоторые степени окисления элементов побочных подгрупп Железо: Fe0 Fe+2
- 66. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 67. Следующее задание Вернуться к заданию Объяснение А10 Оксид кальция CaO – основный оксид. + O2 ≠
- 68. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 69. Следующее задание Вернуться к заданию Объяснение А11 Гидроксид хрома (III) Cr(OH)3 – амфотерный гидроксид + CO2
- 70. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 71. Следующее задание Вернуться к заданию Объяснение А12 Карбонат кальция CaCO3 - соль CaCO3 + HCl =
- 72. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 73. Следующее задание Вернуться к заданию Объяснение А13 Ba Ba(OH)2 BaCl2 Металлы с основаниями не реагируют Ba
- 74. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
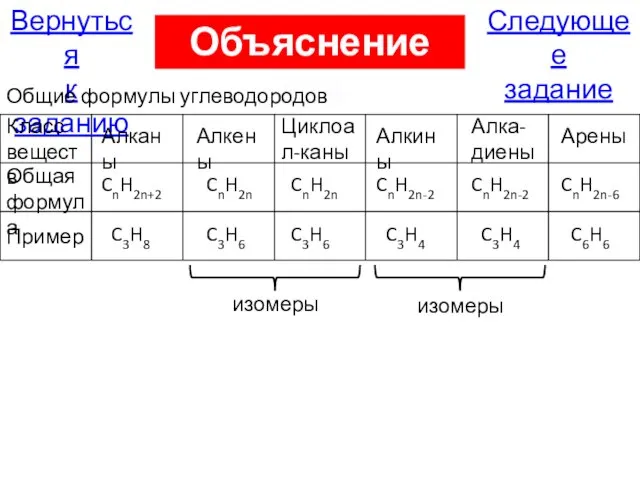
- 75. Следующее задание Вернуться к заданию Объяснение А14 Класс веществ Общая формула Алканы CnH2n+2 Пример C3H8 Алкены
- 76. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
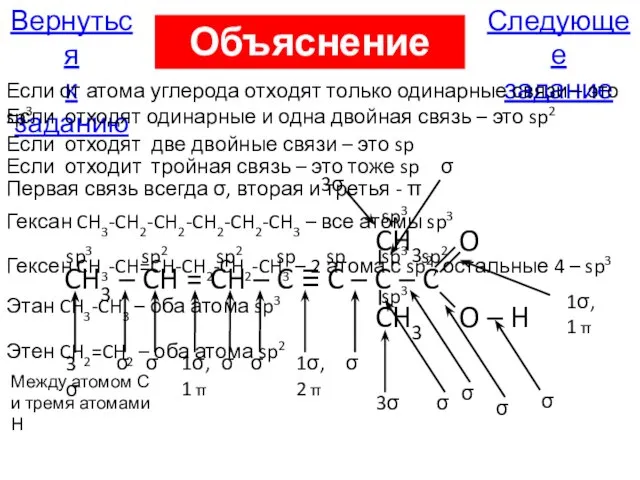
- 77. Следующее задание Вернуться к заданию Объяснение А15 Если от атома углерода отходят только одинарные связи –
- 78. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
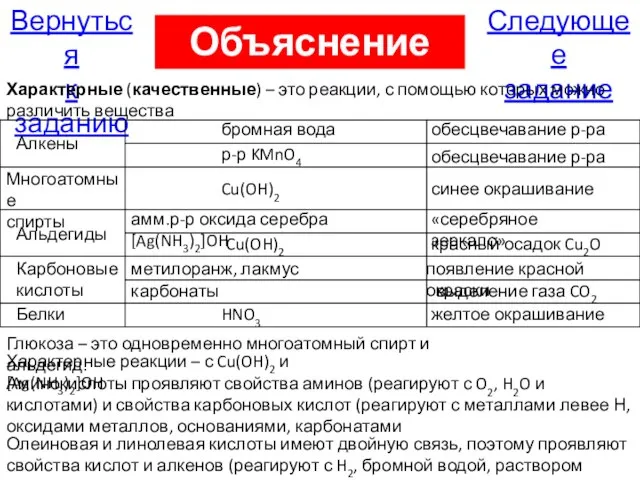
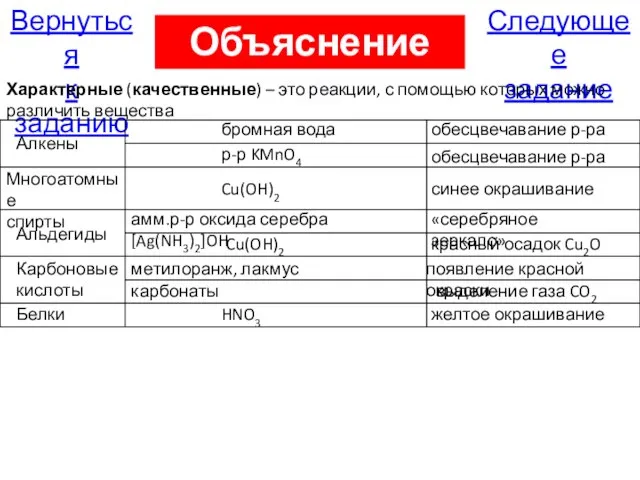
- 79. Следующее задание Вернуться к заданию Объяснение А16 Характерные (качественные) – это реакции, с помощью которых можно
- 80. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 81. Следующее задание Вернуться к заданию Объяснение А17 Уксусная кислота CH3COOH O CH3 – C OH CH3COOH
- 82. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 83. Следующее задание Вернуться к заданию Объяснение А18 X – вещество, из которого можно получить C6H5-CH2-OH CH3
- 84. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 85. Следующее задание Вернуться к заданию ОбъяснениеА19 1) CH2=CH2 этен, этилен + H2O → CH3-CH2OH - реакция
- 86. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 87. Следующее задание Вернуться к заданию Объяснение А20 1. С наибольшей скоростью протекают реакции в растворах. 2.
- 88. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 89. Следующее задание Вернуться к заданию Объяснение А21 При увеличении давления, равновесие реакции смещается в ту сторону,
- 90. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 91. Следующее задание Вернуться к заданию Объяснение А22 C2H5OH (этанол) – органическое вещество, неэлектролит KCl (хлорид калия)–
- 92. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 93. Следующее задание Вернуться к заданию Объяснение А23 1) гидроксид натрия и хлорид бария NaOH + BaCl2
- 94. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 95. Следующее задание Вернуться к заданию Объяснение А24 Окислитель – отбирает электроны Например: Cu+2 + 2e →
- 96. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 97. Следующее задание Вернуться к заданию Объяснение А25 Сильные кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4 Сильные
- 98. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 99. (гидрогалогенирования, гидрирования, гидратации, галогенирования) Следующее задание Вернуться к заданию Объяснение А26 Алканы вступают в реакции: 1)
- 100. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 101. O -CHO – сокращенная запись - C H Следующее задание Вернуться к заданию Объяснение А27 O
- 102. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 103. Следующее задание Вернуться к заданию Объяснение А28 Характерные (качественные) – это реакции, с помощью которых можно
- 104. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 105. Следующее задание Вернуться к заданию Объяснение А29 Получение некоторых веществ: Водород H2 - из воды (электролизом)
- 106. Правильно Следующее задание Вернуться к заданию На страницу с объяснением
- 107. Следующее задание Вернуться к заданию Объяснение А30 2СО(г) + О2(г) = 2СО2(г) + 566 кДж В
- 108. CH3 O H-C O – CH3 Следующее задание Вернуться к заданию 1) о-ксилол 1,2-диметилбензол - ароматический
- 109. Следующее задание Вернуться к заданию CH2Cl2 А) Cl ближе к F, значит перетягивает к себе электроны
- 110. Следующее задание Вернуться к заданию активные металлы, не выделяются на катоде, вместо них выделяется H2 металлы
- 111. Следующее задание Вернуться к заданию Сильные кислоты: HCl HBr HI HNO3 H2SO4 HClO4 Сильные основания (щелочи):
- 112. Следующее задание Вернуться к заданию A) KHCO3 + KOH → K2CO3 + H2O Б) KHCO3 +
- 113. Следующее задание Вернуться к заданию 1) + H2 → C6H12 3 бензол циклогексан CH3-CH2-CH3 + H2
- 114. (предельный потому что нет двойных, тройных связей), одноатомный, потому что одна гидроксильная группа OH) Следующее задание
- 115. Следующее задание Вернуться к заданию -NH2 + O2 → CO2 + H2O + N2 4 24
- 116. mраствора (смеси) Следующее задание Вернуться к заданию ω = mвещества mв-ва = ω × mр-ра (смеси)
- 117. Следующее задание Вернуться к заданию Zn + Pb(NO3)2 = Zn(NO3)2 + Pb n(Zn) = m M
- 118. Следующее задание Вернуться к заданию KMnO4+ H2S + H2SO4→ MnSO4+ S+ + Сначала определим неизвестные продукты
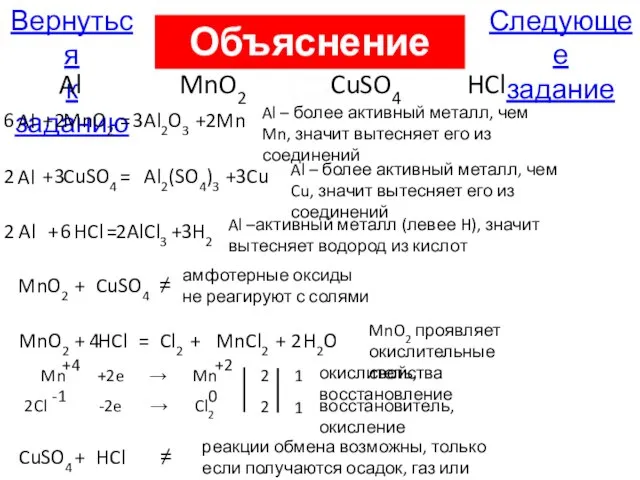
- 119. Следующее задание Вернуться к заданию Al MnO2 CuSO4 HCl Al + MnO2 = Al2O3 + Mn
- 120. Следующее задание Вернуться к заданию CaC2→этин→этаналь X 1 X2 X3 CaC2 карбид кальция + H2O →
- 121. 5,6 22,4 Дано: V(H2S)=17,4 л Vр (KOH) = 59,02 мл m (соли) - ? Решение: ω
- 123. Скачать презентацию







































































































 Вклад М.В.Ломоносова в русскую литературу
Вклад М.В.Ломоносова в русскую литературу Создание дидактических материалов по истории с использованием средств ИКТ к теме «Занимательная история»
Создание дидактических материалов по истории с использованием средств ИКТ к теме «Занимательная история» О проведении работы по медицинскому обеспечению летней оздоровительной кампании 2012 года в Пермском крае
О проведении работы по медицинскому обеспечению летней оздоровительной кампании 2012 года в Пермском крае Higher education traditions in the USA
Higher education traditions in the USA Великий ученый - энциклопедист
Великий ученый - энциклопедист Типы текста
Типы текста Строим пирамиду
Строим пирамиду Основные элементы оборудования и наполнения среды
Основные элементы оборудования и наполнения среды Презентация на тему Понятие, этапы развития и функции денег
Презентация на тему Понятие, этапы развития и функции денег Оптические иллюзии в живописи и графике
Оптические иллюзии в живописи и графике Культура и общество
Культура и общество Д.Поллок
Д.Поллок BLANCOSUBLINEДизайнерское решение для подстольного монтажа – семейство моек BlancoSubline из Silgranit® CLEAN
BLANCOSUBLINEДизайнерское решение для подстольного монтажа – семейство моек BlancoSubline из Silgranit® CLEAN Топливно-энергетический комплекс мира (ТЭК)
Топливно-энергетический комплекс мира (ТЭК)  Экспериментальная установка теплового насоса
Экспериментальная установка теплового насоса 드라마와 함께 하는 한국어 수 업제2 강강
드라마와 함께 하는 한국어 수 업제2 강강 Сравнение умственной работоспособности обучающихся младшей и старшей школы в стрессовой ситуации
Сравнение умственной работоспособности обучающихся младшей и старшей школы в стрессовой ситуации Условия для реализации основной образовательной программы ДО.
Условия для реализации основной образовательной программы ДО. Школьною тропинкой начинается Жизнь, поверь, у каждого из нас. И о чём мечтали, всё сбывается! Переходим мы из класса в класс…
Школьною тропинкой начинается Жизнь, поверь, у каждого из нас. И о чём мечтали, всё сбывается! Переходим мы из класса в класс…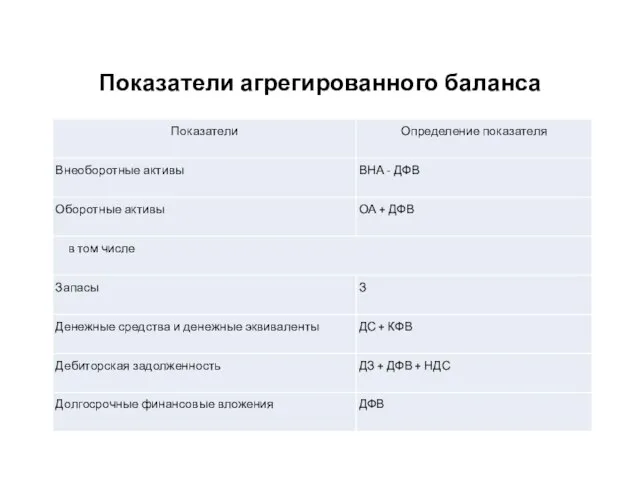 Показатели агрегированного баланса
Показатели агрегированного баланса Сложное предложение (4 класс)
Сложное предложение (4 класс) Презентация Киренский 2022
Презентация Киренский 2022 Самоконтроль в обучении
Самоконтроль в обучении Результаты выполнения Росприроднадзором поручений Минприроды России по подготовке плана по реализации комплекса мер, направленн
Результаты выполнения Росприроднадзором поручений Минприроды России по подготовке плана по реализации комплекса мер, направленн Единственное право и единственная обязанность силы – это защищать слабого Волкодав
Единственное право и единственная обязанность силы – это защищать слабого Волкодав Презентация на тему Древний Вавилон
Презентация на тему Древний Вавилон Школа Панацея 03.09.2020
Школа Панацея 03.09.2020 EUGR NSP CLUB Лекция 3 OMEGA-3 Обзор партнёра компании NSP спортивного врача И.И.Шашкова.
EUGR NSP CLUB Лекция 3 OMEGA-3 Обзор партнёра компании NSP спортивного врача И.И.Шашкова.