Содержание
- 2. Теория электролитической диссоциации. Изучив тему, следует знать: Основные положения теории электролитической диссоциации. Кислоты, основания и соли
- 3. Писать уравнения диссоциации кислот, оснований и солей. Определять реакции ионного обмена, идущие до конца, составлять уравнения
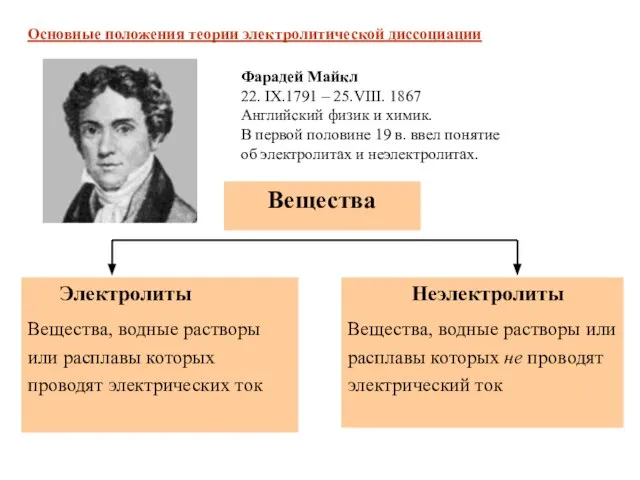
- 4. Основные положения теории электролитической диссоциации Фарадей Майкл 22. IX.1791 – 25.VIII. 1867 Английский физик и химик.
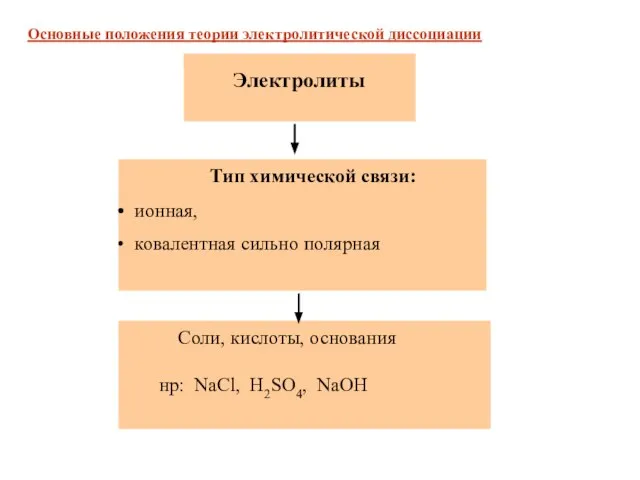
- 5. Тип химической связи: ионная, ковалентная сильно полярная Электролиты Соли, кислоты, основания нр: NaCl, H2SO4, NaOH Основные
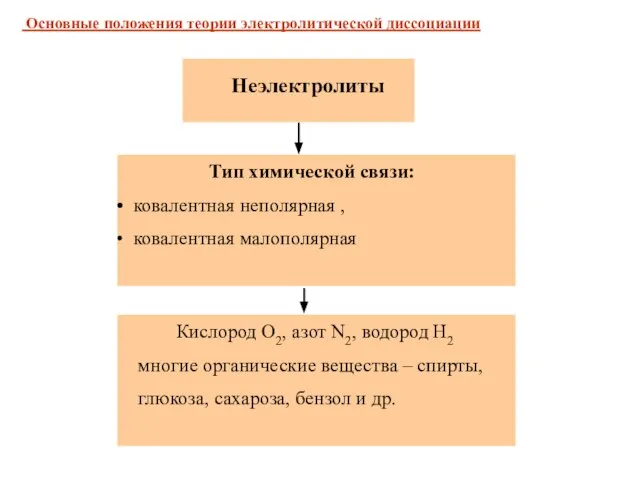
- 6. Неэлектролиты Тип химической связи: ковалентная неполярная , ковалентная малополярная Кислород O2, азот N2, водород H2 многие
- 7. Сванте Август Аррениус- 1859 – 1927 г.г. Шведский физико-химик. Автор теории электролитической диссоциации (1887 г.) В
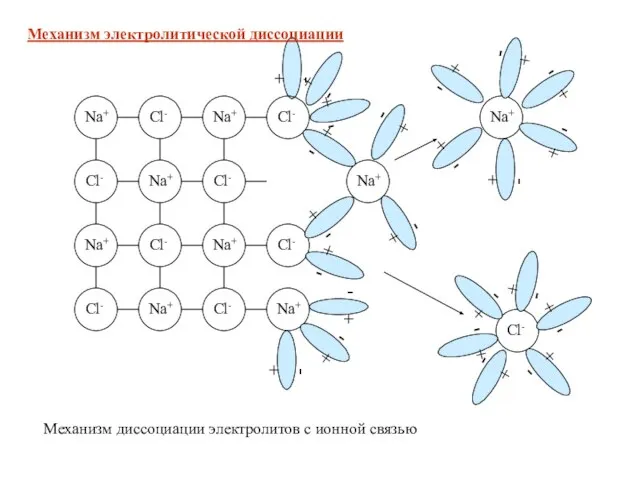
- 8. + - Механизм диссоциации электролитов с ионной связью Механизм электролитической диссоциации
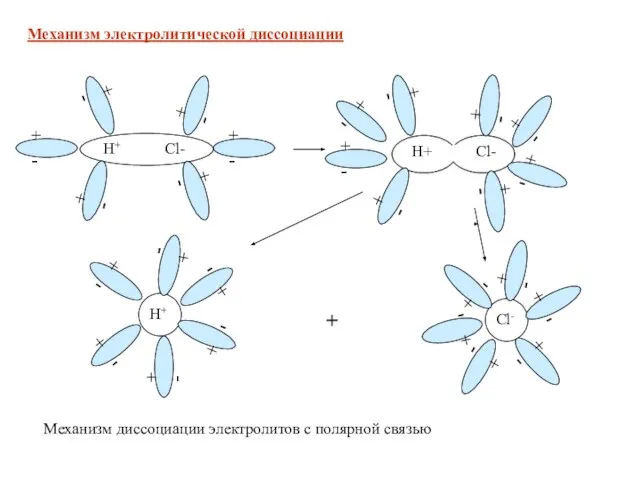
- 9. + - Механизм диссоциации электролитов с полярной связью Механизм электролитической диссоциации
- 10. Степень электролитической диссоциации. Сильные и слабые электролиты Степень электролитической диссоциации – число, показывающее, какая часть молекул
- 11. Степень диссоциации (α) зависит от природы растворяемого вещества и растворителя. концентрации раствора. При разбавлении раствора, α
- 12. Сильные электролиты (α → 1 или 100%) соли 2) сильные кислоты (H2SO4, HCl, HNO3, HClO4, HClO3,
- 13. Слабые электролиты (α → 0) 1) вода 2) cлабые кислоты (H2S, H2CO3, H2SiO3, HNO2, H3PO4, H2SO3,
- 14. Кд (NH4OH) = 1,8 · 10-5 Кд (H2O) = 1,8 · 10-16 Степень электролитической диссоциации. Сильные
- 15. Кислоты, основания и соли с точки зрения ТЭД Уравнение электролитической диссоциации сильных кислот: HCl ↔ H+
- 16. Уравнение диссоциации сильных оснований (щелочей) NaOH ↔ Na+ + OH- Ba(OH)2 ↔ Ba2+ + 2OH- Слабые
- 17. Уравнение электролитической диссоциации Zn(OH)2 (без учета ступенчатого характера) 2H+ + ZnO22- ↔ H2ZnO2 = Zn(OH)2 ↔
- 18. K2CO3 ↔ 2K+ + CO32- Al2(SO4)3 ↔ 2Al3+ + 3SO42- Средние (нормальные) соли – сильные электролиты,
- 19. NaHCO3 ↔ Na+ + HCO3- (α = 1) НСО3- ↔ Н+ + СО32- (α Кислые соли
- 20. Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из
- 21. Условия течения реакций ионного обмена до конца Реакции, протекающие между ионами, называются ионными реакциями.
- 22. образование малорастворимых веществ (осадки ↓) 2) образование газообразных или летучих веществ (↑) 3) образование малодиссоциирующих веществ
- 23. Реакции с образованием малорастворимых веществ, выпадающих в осадок молекулярное уравнение: AgNO3 + HCl → AgCl↓ +
- 24. 2. Реакции, протекающие с образованием газообразных или летучих веществ молекулярное уравнение: Na2CO3 + 2HCl → 2NaCl
- 25. 3. Реакции, идущие с образованием малодиссоциирующих веществ – слабых электролитов молекулярное уравнение: NaOH + HCl →
- 26. Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих
- 27. Диссоциация воды. Водородный показатель H2O ↔ H+ + OH- При 250С [Н+] = [ОН-] = 10-7
- 28. Диссоциация воды. Водородный показатель Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода Н+
- 29. Если [Н+] = 10-7 моль/л , то рН = - lg 10-7 = 7 среда раствора
- 31. Скачать презентацию




















![Диссоциация воды. Водородный показатель H2O ↔ H+ + OH- При 250С [Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/373229/slide-26.jpg)

![Если [Н+] = 10-7 моль/л , то рН = - lg 10-7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/373229/slide-28.jpg)
 Искусство Китая
Искусство Китая Хастл. Танец, как образ жизни
Хастл. Танец, как образ жизни Когда мы станем взрослыми (1 класс)
Когда мы станем взрослыми (1 класс) Воинские звания военнослужащих ВС РФ. Военная форма одежды
Воинские звания военнослужащих ВС РФ. Военная форма одежды Презентация на тему Явления природы (1 класс)
Презентация на тему Явления природы (1 класс) Булат Окуджава
Булат Окуджава Холодная война СССР и США
Холодная война СССР и США Что умеет компьютер
Что умеет компьютер Туркменистан
Туркменистан Ключевые направления работы психолога с детьми с ОВЗ и инвалидами
Ключевые направления работы психолога с детьми с ОВЗ и инвалидами Водородная связь
Водородная связь Проект WEB КП
Проект WEB КП Работа с lego mindstorms ev3. Задание № 6: датчик цвета
Работа с lego mindstorms ev3. Задание № 6: датчик цвета Пьянзина Александра - амбассадор Арткластера Таврида 2021
Пьянзина Александра - амбассадор Арткластера Таврида 2021 Ведение аккаунта в социальных сетях и таргет
Ведение аккаунта в социальных сетях и таргет Презентация на тему Магнитное поле земли
Презентация на тему Магнитное поле земли  Презентация на тему Задачи на увеличение уменьшение на несколько единиц
Презентация на тему Задачи на увеличение уменьшение на несколько единиц  Вышивка крестом
Вышивка крестом Гении эпохи Возрождения
Гении эпохи Возрождения Пять конституций РФ
Пять конституций РФ Ein kurzer Diskurs zu OM5 und ihre Vor-und
Ein kurzer Diskurs zu OM5 und ihre Vor-und Презентация на тему Colours (Цвета)
Презентация на тему Colours (Цвета)  Объединенная Консалтинговая Компания“Клиентс Риджинал Компани.”Полный Спектр Консалтинга на территории Российской Федерации,
Объединенная Консалтинговая Компания“Клиентс Риджинал Компани.”Полный Спектр Консалтинга на территории Российской Федерации, Новогодние загадки
Новогодние загадки Методы контроля при занятии физической культурой
Методы контроля при занятии физической культурой Экологический мониторинг школы
Экологический мониторинг школы Эскиз декоративного натюрморта. Графика. 5 класс
Эскиз декоративного натюрморта. Графика. 5 класс 568120
568120