Слайд 2ТЕМЫ:
Современные представления о строении атомов
Закономерности изменения химических свойств элементов и их

соединений по периодам и группам периодической системы химических элементов Д.И. Менделеева
Химическая связь
Слайд 3Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода с относительной

атомной массой равной 12
1) 4; 2)12; 3)6; 4)2
Слайд 4Строение атома
Атом (от греч. atomos - неделимый) - наименьшая химическая частица, состоящая

из массивного положительно заряженного ядра и движущихся в электрическом поле ядра отрицательно заряженных электронов
Слайд 5Атомные частицы и их свойства
Атом состоит из трёх видов частиц:
Электрон - (е)

- заряд отрицательный, . q=-1,6 . 10-19Кл. Масса mе =9,1.10-31кг
Протон – (р)- заряд положительный .
q = 1,6 . 10-19Кл, Масса mр = 1840 mе
Нейтрон –(n)- не заряжен, . Масса mn≈ mр
Слайд 6Строение атома
Ядро атома - образование из протонов и нейтронов, находящееся в центральной

части атома. Содержит в себе весь положительный заряд и большую часть массы атома (>99,95%).
Количество протонов в ядре, которое равно порядковому номеру элемента в Периодической системе Д.И.Менделеева и поэтому называется атомным номером элемента, определяет благодаря электронейтральности атома число электронов, а следовательно, электронное строение и определяемые им химические свойства элемента.
Количество нейтронов в ядрах атомов одного элемента может различаться; такие атомы называются изотопами этого элемента
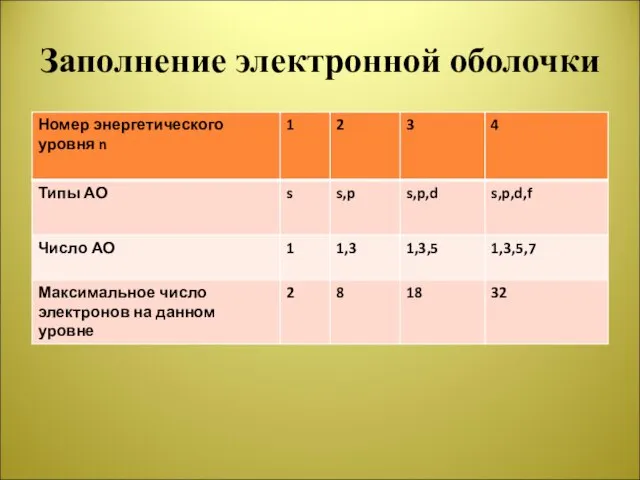
Слайд 7Заполнение электронной оболочки
Слайд 8Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода с относительной

атомной массой равной 12
1) 4; 2)12; 3)6; 4)2
Слайд 9Строение атома
Ядро любого химического элемента состоит из нуклонов.
2. Относительная масса одного нуклона

равна 1
3. Масса ядра изотопа углерода составляет 12 атомных единиц массы, следовательно, в составе его ядра 12 нуклонов.
4. В ядре химического элемента имеется два вида нуклонов, одни имеют заряд +1, другие 0.
5. Элементарная частица, имеющая массу 1 и заряд +1, называется протон.
6. В ядре атома изотопа углерода 12С находится 6 протонов
7. Элементарная частица, имеющая массу 1 и заряд 0, называется нейтрон.
8. Определим число нейтронов в ядре изотопа углерода 12С. С этой целью из числа нуклонов вычтем число протонов.
Число нейтронов = число нуклонов - число протонов.
В ядре атома изотопа углерода 12С находится нейтронов.
Ответ: в составе ядра изотопа углерода 12С имеется 6 протонов и 6 нейтронов
Слайд 10Строение атома
Составьте электронную формулу химического элемента № 17

Слайд 11Строение атома
1. Элемент № 17 называется хлор и имеет химический символ Cl.
2.

Элемент хлор находится в третьем периоде.
3. Внешним энергетическим уровнем в атоме хлора является уровень под номером 3.
4. Элемент хлор находится в группе номер VII.
5. Хлор входит в подгруппу А.
6. На внешнем электронном уровне атома хлора имеется 7 электронов.
7. Заряд ядра атома элемента хлора равен +17.
8. На трёх энергетических уровнях атома хлора располагаются 17 электронов.
9. На первом энергетическом уровне атома хлора располагаются 2 электрона.
10. Первый электронный уровень любого атома периодической системы, кроме атома водорода, можно представить так: 1s2.
Слайд 12Строение атома
11. На втором энергетическом уровне атома хлора находится 8 электронов.
17 -

(2 + 7) = 8
12. На втором энергетическом уровне имеются два подуровня s и р.
13. Число электронов в атоме хлора на втором s - подуровне равняется 2.
14. Число электронов в атоме хлора на втором р - подуровне равняется 6.
8 - 2 = 6
15. Число электронов находящихся на одной р -орбитали не может быть больше чем 2.
16. На втором энергетическом уровне в атоме хлора имеется три р - орбитали, расположенных перпендикулярно друг-другу.
17. Расположение электронов на втором энергетическом уровне можно записать так: 2s22p6. Если прибавить эту запись к ранее сделанной записи первого энергетического уровня, то получится:
1s22s22p6
Слайд 13Строение атома
18. На третьем энергетическом уровне в атоме хлора имеется три подуровня

s, р, d. Из них заполняется семью электронами только два s и р, d - подуровень остаётся пустым.
19. Расположение электронов на третьем энергетическом уровне можно записать так: 3s23p5. Если добавить эту запись к ранее сделанной записи первого и второго энергетического уровней, то получится электронная формула атома хлора:
1s22s22p63s23p5
Ответ: электронная формула атома хлора 1s22s22p63s23p5.
Слайд 14Строение атома
электронная формула иона Br-
1)… 2)…. 3)… 4)…

Слайд 15Строение атома
электронная формула атома брома Br0 1s22s22p63s23p63d104s24p5
атома брома Br0 превращается в ион

брома Br – присоединяя 1 e
электронная формула иона брома Br- 1s22s22p63s23p63d104s24p6
Слайд 16Строение атома
Атом металла имеет электронную конфигурацию 1s2 2s2 2p6 3s2, формула оксида,

гидроксида и сульфата этого элемента
1)ЭО; Э(ОН)2;ЭSO4 2) Э2О; ЭОН;Э2SO4
3)ЭО; ЭОН;ЭSO4 4)Э 2 О 2; Э(ОН)2;Э 2 SO4
Слайд 17Строение атома
1s2 2s2 2p6 3s2
Э+2
1)Э+2О-2; Э+2 (ОН)-2;Э+2SO4-2

Слайд 18ХИМИЧЕСКАЯ СВЯЗЬ
Задание :Укажите соединение с ионной связью
1) CaCl2; 2)SO2; 3)Br2 4)H2O

Слайд 19Окислительно-восстановительные процессы
Используя метод электронного баланса, составьте уравнение реакции:
Cr2O3 + … + KOH

→ KNO2+ K2CrO4 + …
Определите окислитель и восстановитель
Слайд 20Окислительно-восстановительные процессы
Cr2O3 + KNO3+ KOH → KNO2+ K2CrO4 + H2O

Слайд 21Окислительно-восстановительные процессы
1) Составлен электронный баланс:
N+5 + 2ē → N+3 3
2Cr+3– 6ē → 2Cr+6 1





















 Глагол have to
Глагол have to Усі знаки зодіаку
Усі знаки зодіаку Новое свойство квадратных уравнений
Новое свойство квадратных уравнений Бандитизм как социальная опасность
Бандитизм как социальная опасность Декоративно-прикладное искусство в современном мире
Декоративно-прикладное искусство в современном мире Занятие 14
Занятие 14 Недвижимость Санкт-Петербурга и Ленинградской области
Недвижимость Санкт-Петербурга и Ленинградской области Хлеб
Хлеб Музыкальные обработки
Музыкальные обработки Что такое гостиничный бизнес?
Что такое гостиничный бизнес? Анонимные Наркоманы
Анонимные Наркоманы  Презентация на тему Литература 18 века Классицизм в России
Презентация на тему Литература 18 века Классицизм в России  ФГОС ООО: особенности содержания, назначение
ФГОС ООО: особенности содержания, назначение Debaty_v_textovom_formate
Debaty_v_textovom_formate КОМПЬЮТЕР И ВИДЕОКАМЕРА КАК ИНСТРУМЕНТЫ ОБУЧЕНИЯ ФИЗИКЕ
КОМПЬЮТЕР И ВИДЕОКАМЕРА КАК ИНСТРУМЕНТЫ ОБУЧЕНИЯ ФИЗИКЕ Подготовленная аварийная посадка на воду
Подготовленная аварийная посадка на воду Ранняя профилактика социального неблагополучия и жестокого обращения с детьми в семьях
Ранняя профилактика социального неблагополучия и жестокого обращения с детьми в семьях Средства защиты информации
Средства защиты информации The strategic interests of the United States in the Balkans in the late 20th and early 21st centuries
The strategic interests of the United States in the Balkans in the late 20th and early 21st centuries Презентация на тему День победы
Презентация на тему День победы  Праздник Троицы
Праздник Троицы Кодирование информации
Кодирование информации Металлургический комплекс
Металлургический комплекс Финансы бюджетных учреждений
Финансы бюджетных учреждений Презентация1
Презентация1 Будь благословен
Будь благословен Презентация на тему Система и структура трудового права
Презентация на тему Система и структура трудового права  Графический дизайн. Азбука журналистики
Графический дизайн. Азбука журналистики