Слайд 2Цель:
Изучить электрические и химические процессы в электролитах.

Слайд 3Задачи:
Доказать что концентрация раствора электролита влияет на силу тока.
Установить, как влияет

расстояния между электродами на силу тока.
Выяснить, как влияет природа электролита на силу тока в нём.
Слайд 4План
I.Введение.
II.Основная часть.
К истории законов электролиза.
Библиографическая справка о М. Фарадеи.
Электрический ток в

электролитах.
III.Практическая часть.
IV. Выводы.
Слайд 6ФАРАДЕЙ (Faraday) Майкл
(1791-1867)
Английский физик, основоположник учения об электромагнитном поле, иностранный

почетный член Петербургской АН (1830). Обнаружил химическое действие электрического тока, взаимосвязь между электричеством и магнетизмом, магнетизмом и светом. Открыл (1831) электромагнитную индукцию — явление, которое легло в основу электротехники. Установил (1833-34) законы электролиза, названные его именем, открыл пара- и диамагнетизм, вращение плоскости поляризации света в магнитном поле (эффект Фарадея). Доказал тождественность различных видов электричества. Ввел понятия электрического и магнитного поля, высказал идею существования электромагнитных волн.
Слайд 7Термин
«электролит»
(от греческого
«разлагаемый электричеством»)
впервые предложил английский
химик и физик
М.Фарадей

Слайд 8Электролитами принято называть
проводящие среды, в которых
протекание электрического тока
сопровождается переносом

вещества.
Слайд 9Прохождение электрического тока через электролит сопровождается выделением веществ на электродах.
Это явление
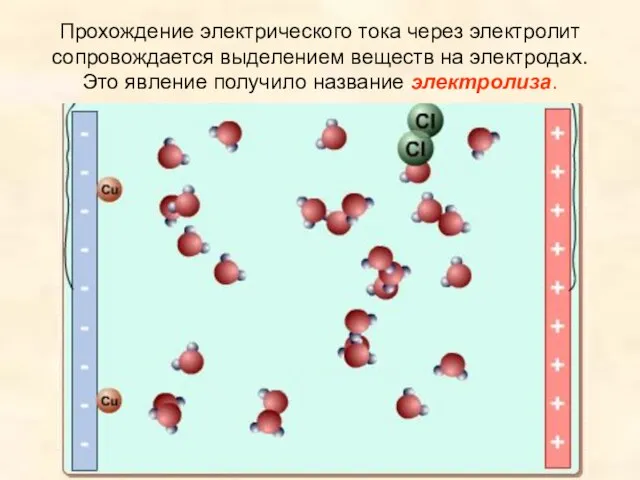
получило название электролиза.
Слайд 10Ток в растворах электролитов – это упорядоченное движение положительных и отрицательных ионов.
Электролиз
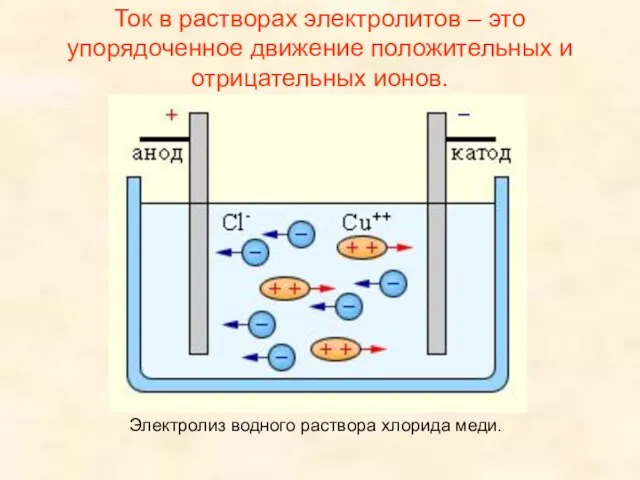
водного раствора хлорида меди.
Слайд 11Первый закон электролиза.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в

1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе.
Слайд 12Первый закон электролиза.
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q,

прошедшему через электролит:
m=kq=kIt.
Слайд 13Второй закон Фарадея
Данный закон отвечает на вопрос от чего зависит электрохимический

эквивалент.
Электрохимические эквиваленты различных веществ пропорциональны их атомным весам и обратно пропорциональны числам, выражающим их химическую валентность.
Слайд 16Практическая часть №1
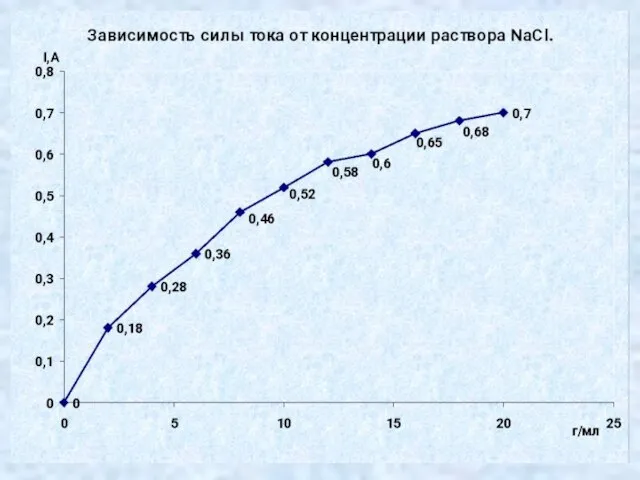
Доказать что концентрация раствора электролита влияет на силу тока.

Слайд 18Вывод № 1.
Сила тока зависит от концентрации раствора, чем насыщение раствор, тем

больше сила тока.
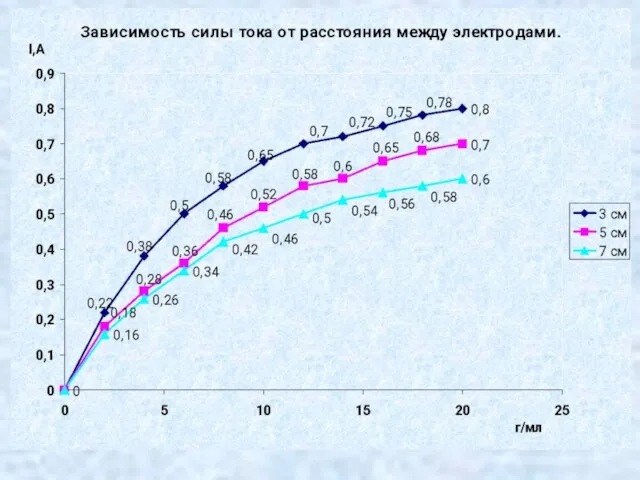
Слайд 19Практическая часть № 2.
Установить, как влияет расстояния между электродами на силу тока.

Слайд 21Вывод № 2.
Сила тока зависит от расстояния между электродами, чем меньше расстояние

тем больше сила тока и наоборот.
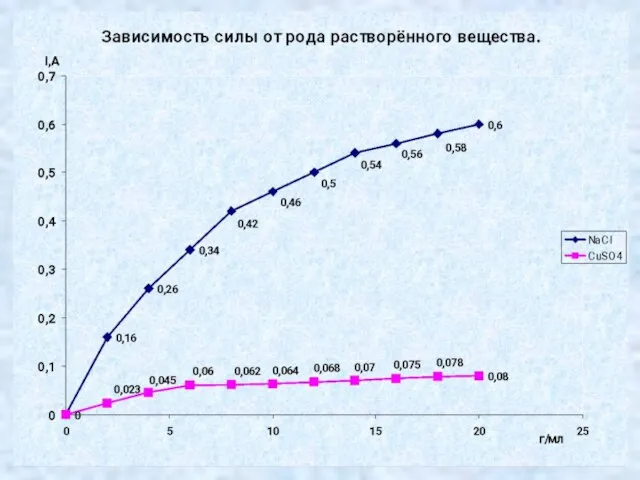
Слайд 22Практическая часть № 3.
Выяснить, как влияет природа электролита на силу тока в

нём.
Слайд 24Вывод № 3.
Различные электролиты по-разному проводят электрический ток.

Слайд 25Применение электролиза
Электрический метод получения чистых металлов.
Гальваностегия.
Гальванопластика.
Электрическая полировка.
Электрометаллургия.

Слайд 26Вывод:
Сам факт разложение электролитов при прохождении через них тока показывает, что в

них движения зарядов сопровождается движение атомов или групп атомов, связанных друг с другом; эти атомы или атомные группы представляют собой части молекулы растворенного вещества. Естественно предположить, что заряжены именно эти части молекул в растворе и что они являются носителями электрического заряда. Их перемещение под действием сил электрического поля и представляют собой электрический ток, идущий через электролит. Тщательно поставленные опыты позволили установить, что для электролитов справедлив закон Ома.





















 Unusual traditions of birthday celebrations
Unusual traditions of birthday celebrations Автомобили контейнерые и контейнеры
Автомобили контейнерые и контейнеры Коррекционно-образовательное значение литературы в обучении школьников с ТНР
Коррекционно-образовательное значение литературы в обучении школьников с ТНР Муниципальное образовательное учреждение для детей дошкольного и младшего школьного возраста «Начальная школа – детский сад с.
Муниципальное образовательное учреждение для детей дошкольного и младшего школьного возраста «Начальная школа – детский сад с. Зевс. Бог неба, грома и молний, ведающий всем миром
Зевс. Бог неба, грома и молний, ведающий всем миром Смета на материалы для изготовления панно
Смета на материалы для изготовления панно Творческая биография А.Н. Бенуа
Творческая биография А.Н. Бенуа Ландшафтная архитектура
Ландшафтная архитектура Влияние Великой Отечественной войны на развитие химической науки. Вклад ученых-химиков в Победу.
Влияние Великой Отечественной войны на развитие химической науки. Вклад ученых-химиков в Победу. www.e-society.mk Ширењето на хакерскиот дух (интернет, слободен софтвер и нови медиуми) Новица Наков Слободен софтвер Македонија
www.e-society.mk Ширењето на хакерскиот дух (интернет, слободен софтвер и нови медиуми) Новица Наков Слободен софтвер Македонија Презентация на тему Риск. Виды рисков, методы нейтрализации рисков
Презентация на тему Риск. Виды рисков, методы нейтрализации рисков  Оптика 11 класс
Оптика 11 класс Популяризация театра
Популяризация театра Молекулярные машины
Молекулярные машины Confusing words: rubbish, garbage, trash, litter, waste, junk, debris
Confusing words: rubbish, garbage, trash, litter, waste, junk, debris Certificate
Certificate Домик из фруктов
Домик из фруктов Перестановка слагаемых (1 класс)
Перестановка слагаемых (1 класс) Eastern cousine
Eastern cousine ВКР: Выбор варианта доставки крупногабаритной строительной техники из республики Корея в Российскую Федерацию
ВКР: Выбор варианта доставки крупногабаритной строительной техники из республики Корея в Российскую Федерацию Методика применения электронного учебного пособияпо базовому курсу информатики Руководитель проекта: Огарков А.Ю., учитель инфо
Методика применения электронного учебного пособияпо базовому курсу информатики Руководитель проекта: Огарков А.Ю., учитель инфо АКЦИЯ «ТЕРРИТОРИЯ ЗДОРОВОГО ПИТАНИЯ» в г.Новосибирске 2009г.
АКЦИЯ «ТЕРРИТОРИЯ ЗДОРОВОГО ПИТАНИЯ» в г.Новосибирске 2009г. Избирательная система в РФ
Избирательная система в РФ Тестоделители и тестоокруглители
Тестоделители и тестоокруглители Crm. Клиентские исследования. Управление поведением. Лояльность
Crm. Клиентские исследования. Управление поведением. Лояльность Тоннелдегі бұрғылауаттыру жұмыстарын маркшейдерлік жұмыспен қамтамасыз ету
Тоннелдегі бұрғылауаттыру жұмыстарын маркшейдерлік жұмыспен қамтамасыз ету Семейство Бобовые и Пасленовые
Семейство Бобовые и Пасленовые Spraw, abyśmy wrócili do Twojej jedności
Spraw, abyśmy wrócili do Twojej jedności