Содержание
- 2. Объяснение формы электрокапилярной кривой по модели Гельмгольца
- 3. Поверхностно-активные и поверхностно-неактивные частицы Поверхностно-неактивные: F-, OH-, SO42-, ClO4-, HCO3-, NO3- , катионы щелочных и щелочноземельных
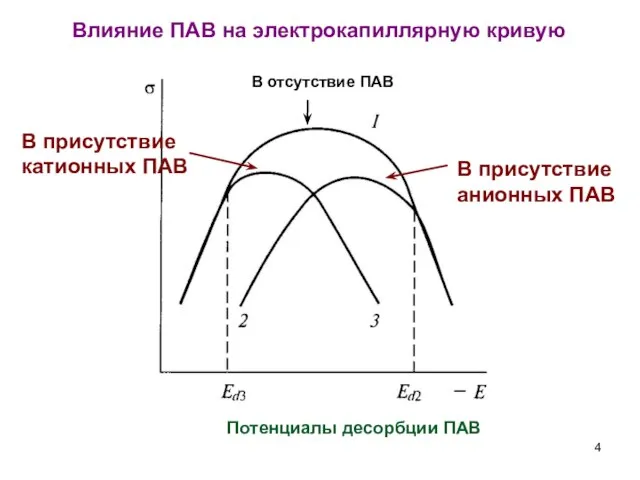
- 4. Влияние ПАВ на электрокапиллярную кривую В отсутствие ПАВ В присутствие анионных ПАВ В присутствие катионных ПАВ
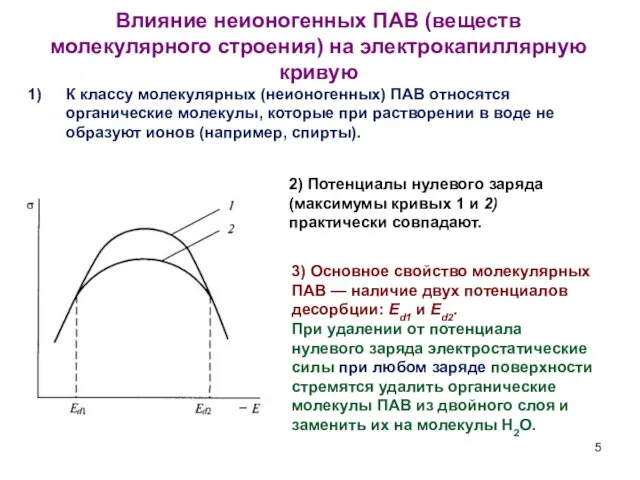
- 5. Влияние неионогенных ПАВ (веществ молекулярного строения) на электрокапиллярную кривую 2) Потенциалы нулевого заряда (максимумы кривых 1
- 6. Электрохимическая кинетика. Электрохимическая поляризация и перенапряжение Скорость электрохимических процессов обычно выражается в единицах плотности тока и
- 7. Элементарные стадии электрохимического процесса Электродный процесс, как и любой гетерогенный химический процесс, может включать несколько элементарных
- 8. Электрохимическая (электродная) поляризация Разность между потенциалом электрода под током (Еi) и его равновесным потенциалом (Еp) называется
- 9. Поляризационные кривые Зависимости «плотность тока–электродный потенциал», называют поляризационными кривыми или вольтамперограммами. Их анализ является одним из
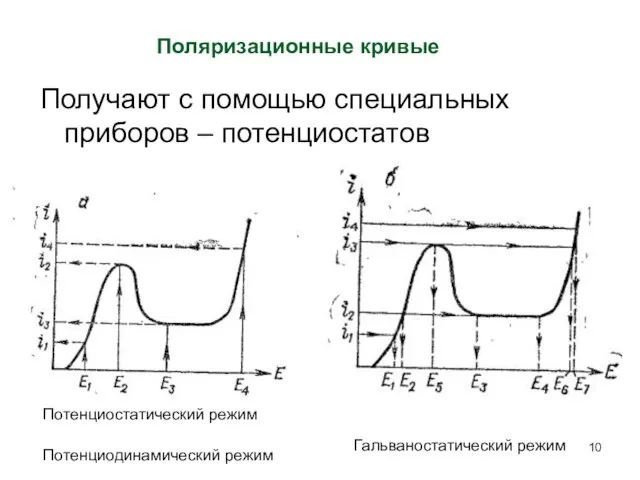
- 10. Получают с помощью специальных приборов – потенциостатов Поляризационные кривые Потенциостатический режим Гальваностатический режим Потенциодинамический режим
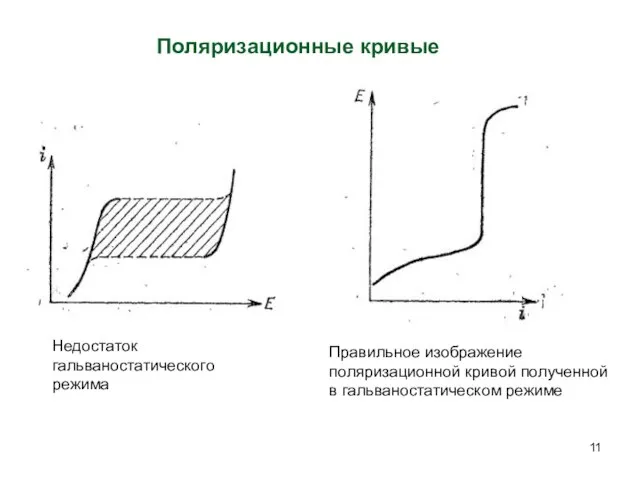
- 11. Недостаток гальваностатического режима Поляризационные кривые Правильное изображение поляризационной кривой полученной в гальваностатическом режиме
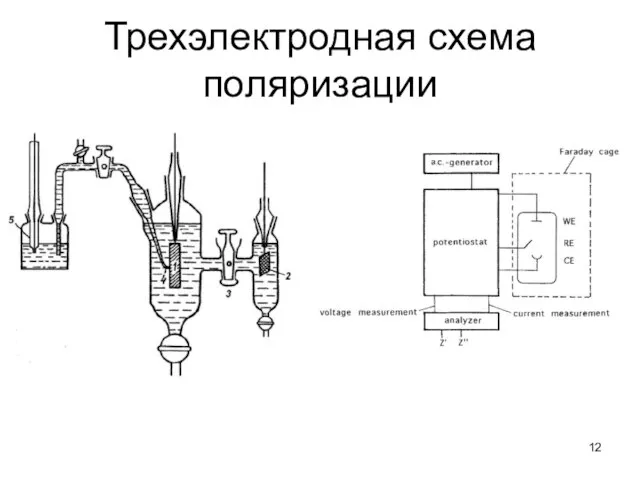
- 12. Трехэлектродная схема поляризации
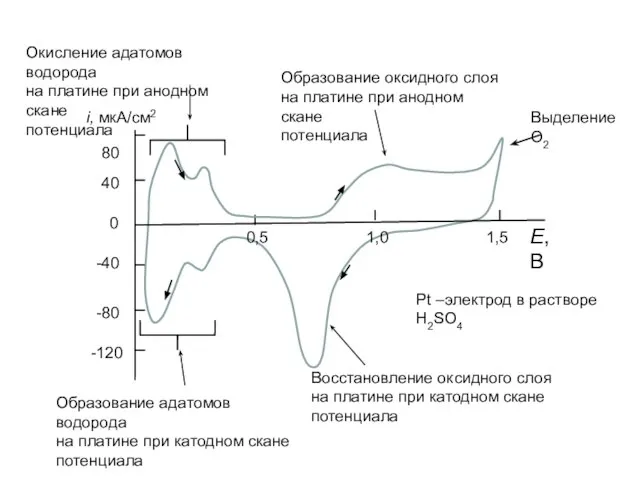
- 13. Образование оксидного слоя на платине при анодном скане потенциала Выделение О2 Восстановление оксидного слоя на платине
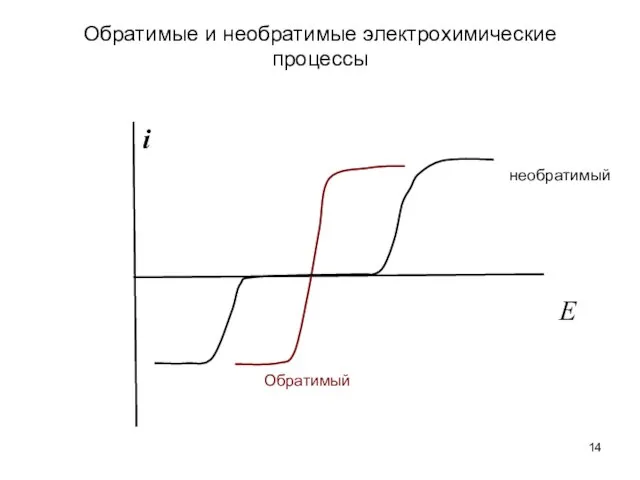
- 14. Обратимые и необратимые электрохимические процессы i E необратимый Обратимый
- 15. Перенапряжение Термин «перенапряжение» относится не к электроду, а к процессу. Величину перенапряжения обозначают буквой η: η
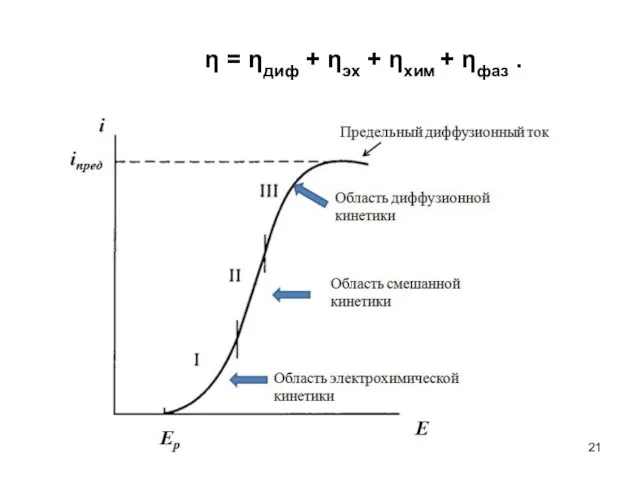
- 17. Виды перенапряжения В соответствии с возможным характером элементарных стадий рассматривают несколько видов перенапряжения. 1) Диффузионное перенапряжение
- 18. Виды перенапряжения 2) Электрохимическое перенапряжение ηэл. Электрохимическим перенапряжением называют вид перенапряжения, связанный со стадией замедленного (то
- 19. Виды перенапряжения Перенапряжение химической реакции ηхим. Перенапряжением химической реакции называют вид перенапряжения, обусловленный конечной скоростью химической
- 20. Виды перенапряжений Фазовое перенапряжение ηфаз. Фазовым перенапряжением называют вид перенапряжения, связанный с торможением сложной электродной реакции
- 21. η = ηдиф + ηэх + ηхим + ηфаз .
- 22. Одноэлектронный перенос В электрохимических (ОВР) процессах рассматривается перенос только одного электрона, так как одновременный перенос нескольких
- 23. На электроде процессы переноса одного, двух и (если они есть) последующих электронов происходят одновременно (параллельно), но
- 24. Перенапряжение электрохимической стадии Пусть для электрохимической стадии протекает полуреакция: Ox + e = Red Такая реакция
- 25. Константа скорости электрохимической реакции Значения k не зависит от активности вещества, но в электродных реакциях зависит
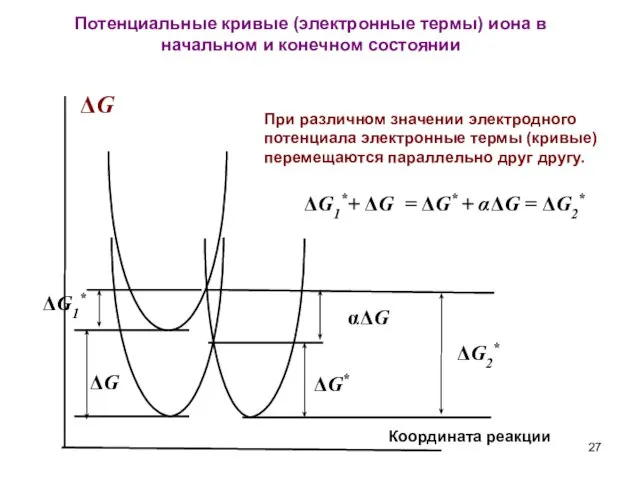
- 26. Коэффициент переноса Фрумкин предложил рассматривать электрохимические реакции, протекающие при различных значениях электродного потенциала, как однотипные химические
- 27. ΔG Координата реакции ΔG αΔG При различном значении электродного потенциала электронные термы (кривые) перемещаются параллельно друг
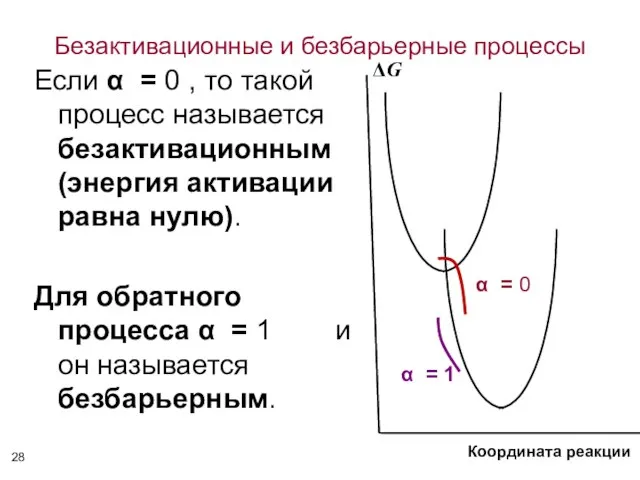
- 28. Безактивационные и безбарьерные процессы Если α = 0 , то такой процесс называется безактивационным (энергия активации
- 29. Ox + e = Red Различие знаков связано с тем, что изменение скачка потенциала на гетерогранице
- 30. Ток обмена В условиях равновесия: Плотность тока обмена равновесный Уравнение Нернста для гальвани-потенциала
- 31. Полное уравнение поляризационной кривой Плотность тока, протекающего через электрод, равна разности частных плотностей тока: перенапряжение Уравнение
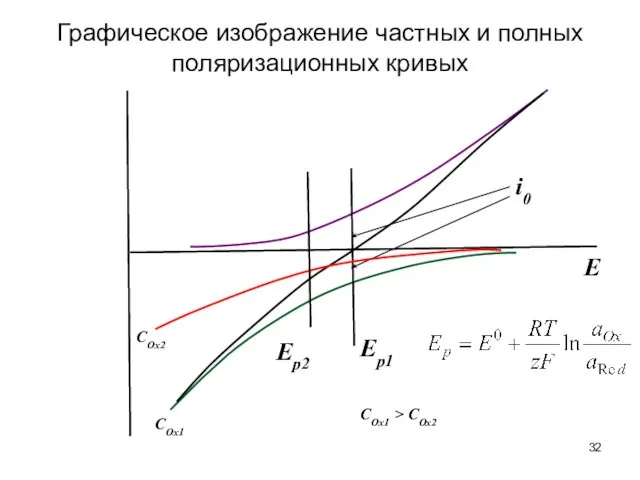
- 32. Графическое изображение частных и полных поляризационных кривых E i0 Ep1 Ep2 COx1 COx2 COx1 > COx2
- 33. Ток обмена При i0→0 - идеально поляризуемый электрод При i0→∞ - идеально неполяризуемый электрод
- 34. Поляризационное сопротивление Допустим, что электрохимическая система незначительно отклоняется от состояния равновесия (перенапряжение η→0). Разложим каждую экспоненту
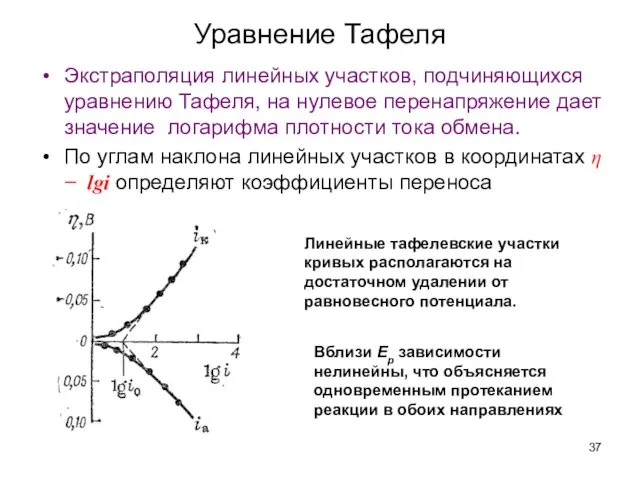
- 35. Уравнение Тафеля Юлиус Тафель 1862 – 1918 гг. Предложил уравнение для связи скорости электрохимической реакции и
- 36. Уравнение Тафеля Предположим, что система существенно отклоняется от Ep и Тогда
- 37. Экстраполяция линейных участков, подчиняющихся уравнению Тафеля, на нулевое перенапряжение дает значение логарифма плотности тока обмена. По
- 38. Перенапряжение диффузии Диффузионным перенапряжением ηD называют перенапряжение, связанное с заторможенностью стадии диффузионного подвода реагентов из раствора
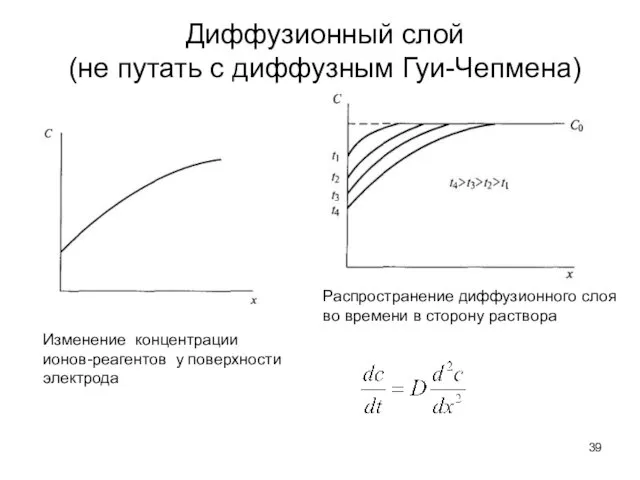
- 39. Диффузионный слой (не путать с диффузным Гуи-Чепмена) Изменение концентрации ионов-реагентов у поверхности электрода Распространение диффузионного слоя
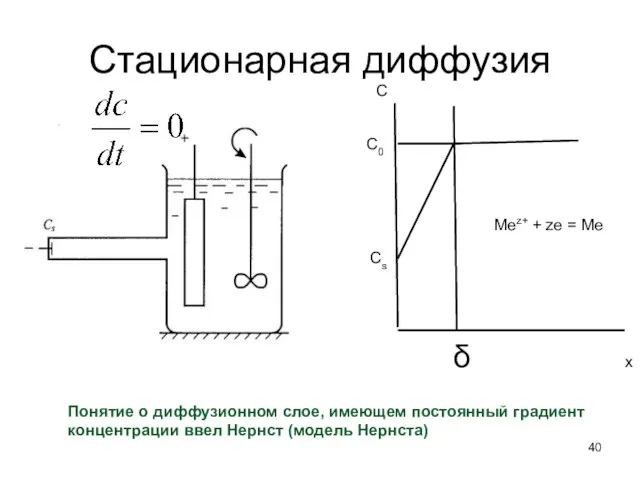
- 40. Стационарная диффузия С С0 Сs δ x Понятие о диффузионном слое, имеющем постоянный градиент концентрации ввел
- 41. Предельный диффузионный ток Для стационарной диффузии:
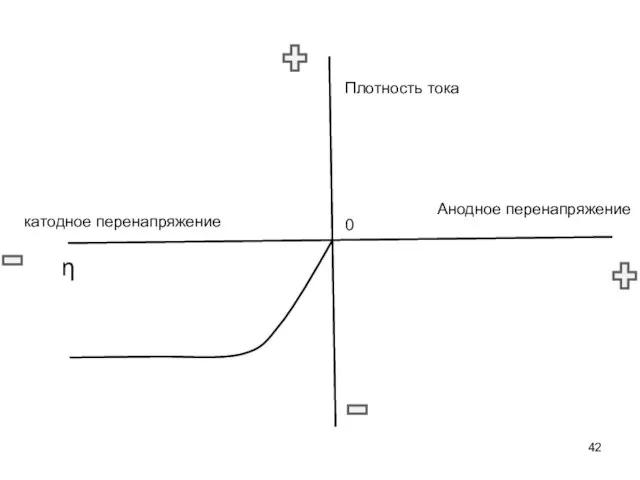
- 42. Анодное перенапряжение катодное перенапряжение 0 η Плотность тока
- 44. Скачать презентацию

























 Архитектура и живопись русского классицизма
Архитектура и живопись русского классицизма О ВЛИЯНИИ ЭКСПЕРИМЕНТАЛЬНЫХ УСТРОЙСТВ НА ФИЗИКУ И БЕЗОПАСНОСТЬ ИССЛЕДОВАТЕЛЬСКИХ РЕАКТОРОВ XIII ЕЖЕГОДНОЕ РОССИЙСКОЕ СОВЕЩАНИЕ «
О ВЛИЯНИИ ЭКСПЕРИМЕНТАЛЬНЫХ УСТРОЙСТВ НА ФИЗИКУ И БЕЗОПАСНОСТЬ ИССЛЕДОВАТЕЛЬСКИХ РЕАКТОРОВ XIII ЕЖЕГОДНОЕ РОССИЙСКОЕ СОВЕЩАНИЕ « Нанотехнологии - инвестиционный ресурс развития Удмуртской Республики
Нанотехнологии - инвестиционный ресурс развития Удмуртской Республики Правила санитарии, гигиены и безопасной работы
Правила санитарии, гигиены и безопасной работы Система аварийного ввода бора (СБВБ) на АЭС
Система аварийного ввода бора (СБВБ) на АЭС История эволюционных идей. Карл Линней
История эволюционных идей. Карл Линней Формирование исполнительского мастерства в условиях образовательной среды в ДШИ
Формирование исполнительского мастерства в условиях образовательной среды в ДШИ Документация как информационное обеспечение бухгалтерского учета
Документация как информационное обеспечение бухгалтерского учета Современная научная космология.
Современная научная космология. Расписание дня школьника
Расписание дня школьника Перспективы развития мультимодальных грузовых перевозок в Ульяновской области
Перспективы развития мультимодальных грузовых перевозок в Ульяновской области Почему невозможно утонуть в грязевом вулкане?
Почему невозможно утонуть в грязевом вулкане? Лекция 3Показатели энергосбережения и повышения энергетической эффективности
Лекция 3Показатели энергосбережения и повышения энергетической эффективности Образец бренда
Образец бренда Летняя оздоровительная кампания 2010год
Летняя оздоровительная кампания 2010год Компания Xerographic Print Service основана в 1994 г.в Нидерландах. Производственные филиалы работают в странах ЕС и Китае.
Компания Xerographic Print Service основана в 1994 г.в Нидерландах. Производственные филиалы работают в странах ЕС и Китае. Функциональное зонирование участка
Функциональное зонирование участка Һөйләмдең баш һәм эйәрсән киҫәктәре
Һөйләмдең баш һәм эйәрсән киҫәктәре Презентация на тему Поздравление с Новым годом
Презентация на тему Поздравление с Новым годом УМК для начальной школы
УМК для начальной школы Методическое объединение педагогов дополнительного образования и учителей художественно-эстетического цикла
Методическое объединение педагогов дополнительного образования и учителей художественно-эстетического цикла ЭКОЛОГ - Профессия XXI века?
ЭКОЛОГ - Профессия XXI века? Система контроля безопасности СКБ Dog
Система контроля безопасности СКБ Dog Детальный Углеводородный Анализ продуктов первичной переработки нефти, продуктов риформинга, готовой продукции
Детальный Углеводородный Анализ продуктов первичной переработки нефти, продуктов риформинга, готовой продукции Рекреационные ресурсы Луганщины
Рекреационные ресурсы Луганщины Filippovich_i_Bashkatova_1
Filippovich_i_Bashkatova_1 12 Декабря - День Конституции Российской Федерации
12 Декабря - День Конституции Российской Федерации Естественнонаучный турнир
Естественнонаучный турнир