Содержание
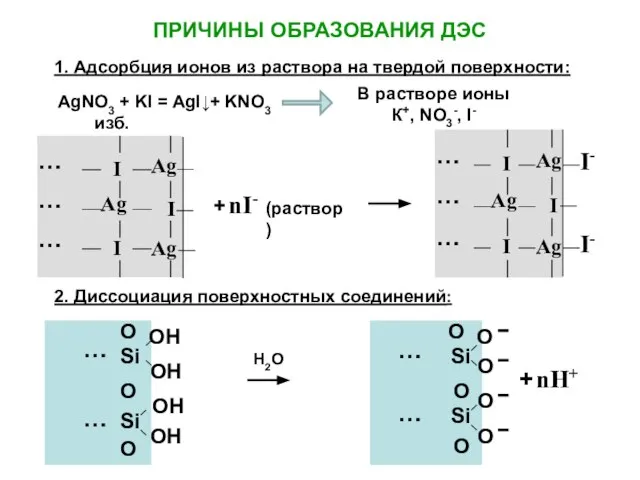
- 2. ПРИЧИНЫ ОБРАЗОВАНИЯ ДЭС 1. Адсорбция ионов из раствора на твердой поверхности: 2. Диссоциация поверхностных соединений: AgNO3
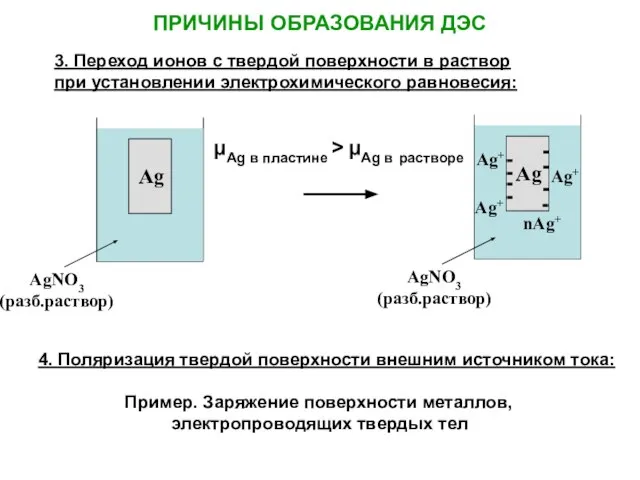
- 3. 3. Переход ионов с твердой поверхности в раствор при установлении электрохимического равновесия: 4. Поляризация твердой поверхности
- 4. Терминология ДЭС Приготовление золя AgI с отрицательным зарядом коллоидной частицы: AgNO3 + KI = AgI↓+ KNO3
- 5. ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛ, ОПИСЫВАЮЩИЙ СОСТОЯНИЕ ИОНОВ В РАСТВОРЕ
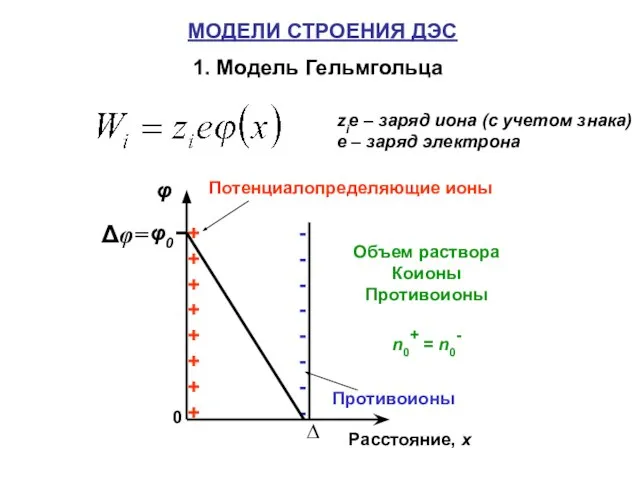
- 6. МОДЕЛИ СТРОЕНИЯ ДЭС 1. Модель Гельмгольца zie – заряд иона (с учетом знака) е – заряд
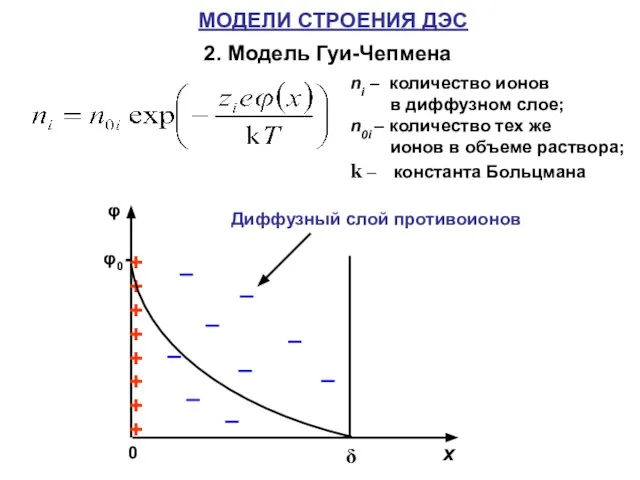
- 7. МОДЕЛИ СТРОЕНИЯ ДЭС 2. Модель Гуи-Чепмена ni – количество ионов в диффузном слое; n0i – количество
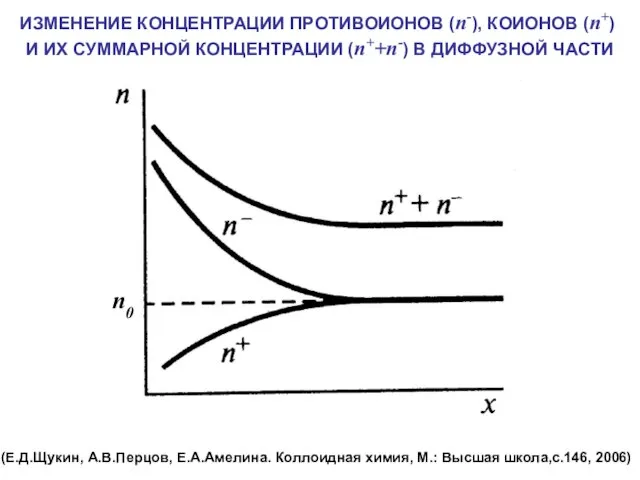
- 8. ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ПРОТИВОИОНОВ (n-), КОИОНОВ (n+) И ИХ СУММАРНОЙ КОНЦЕНТРАЦИИ (n++n-) В ДИФФУЗНОЙ ЧАСТИ (Е.Д.Щукин, А.В.Перцов,
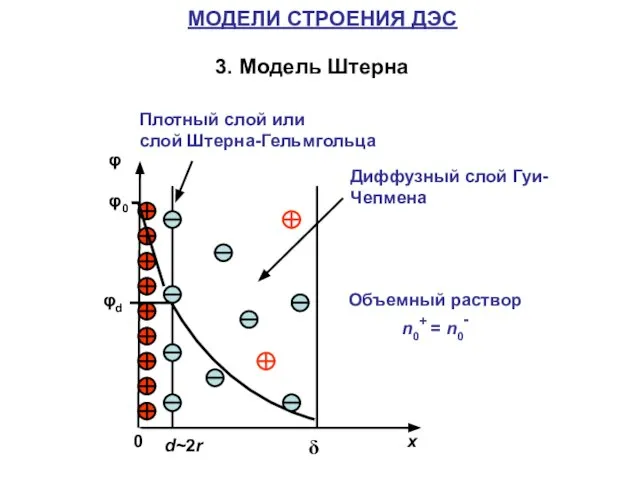
- 9. МОДЕЛИ СТРОЕНИЯ ДЭС 3. Модель Штерна
- 10. Для плоской поверхности раздела и для симметричного электролита Краевые условия: 1. 2. Уравнение Пуассона ЗАВИСИМОСТЬ ПОТЕНЦИАЛА
- 11. ЗАВИСИМОСТЬ ПОТЕНЦИАЛА ДИФФУЗНОГО СЛОЯ ОТ РАССТОЯНИЯ ОТ ТВЕРДОЙ ПОВЕРХНОСТИ где при ;
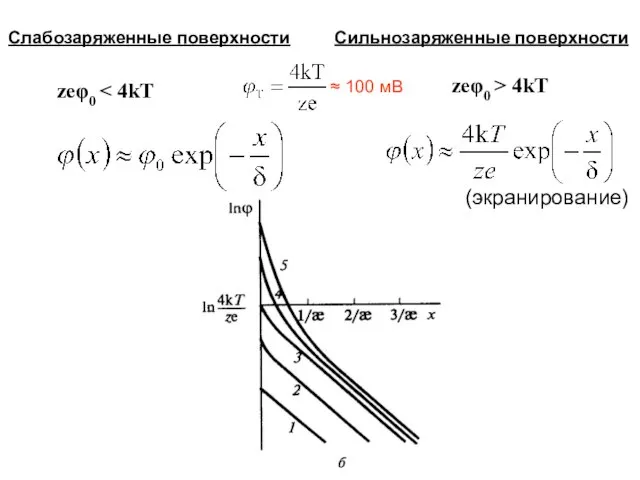
- 12. Слабозаряженные поверхности Сильнозаряженные поверхности (экранирование) zeφ0 zeφ0 > 4kT
- 13. ФОРМУЛА МИЦЕЛЛЫ ГИДРОФОБНОГО ЗОЛЯ AgI { (mAgI) nI- (n-x)K + } x- xK +
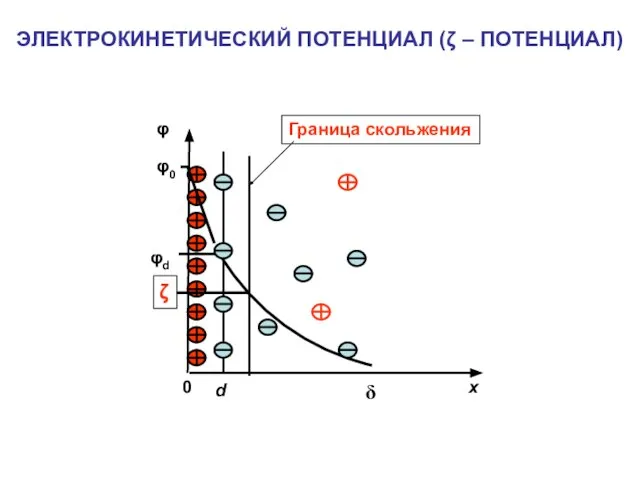
- 14. - Электрокинетический потенциал ζ ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ДЭС: - Толщина плотного слоя d - Эффективная толщина диффузного
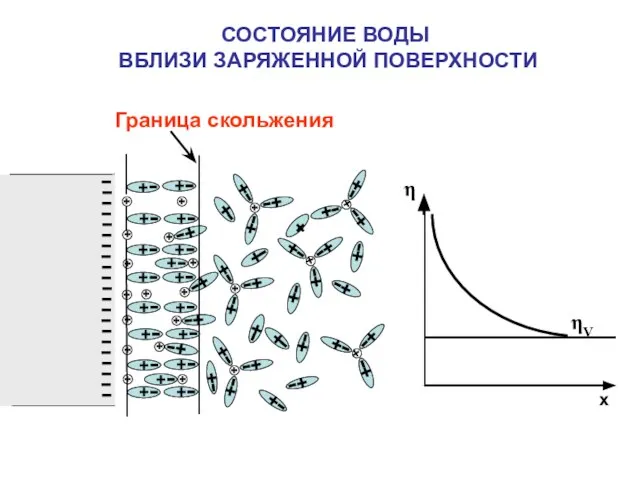
- 15. СОСТОЯНИЕ ВОДЫ ВБЛИЗИ ЗАРЯЖЕННОЙ ПОВЕРХНОСТИ
- 16. ЭЛЕКТРОКИНЕТИЧЕСКИЙ ПОТЕНЦИАЛ (ζ – ПОТЕНЦИАЛ)
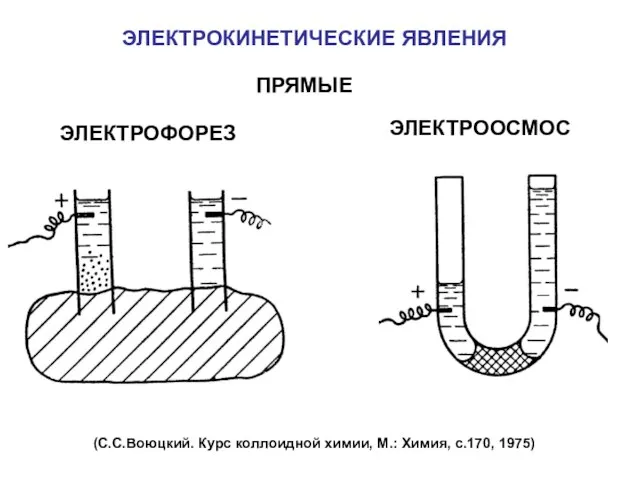
- 17. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ ЭЛEКТРОФОРЕЗ ЭЛЕКТРООСМОС ПРЯМЫЕ (С.С.Воюцкий. Курс коллоидной химии, М.: Химия, с.170, 1975)
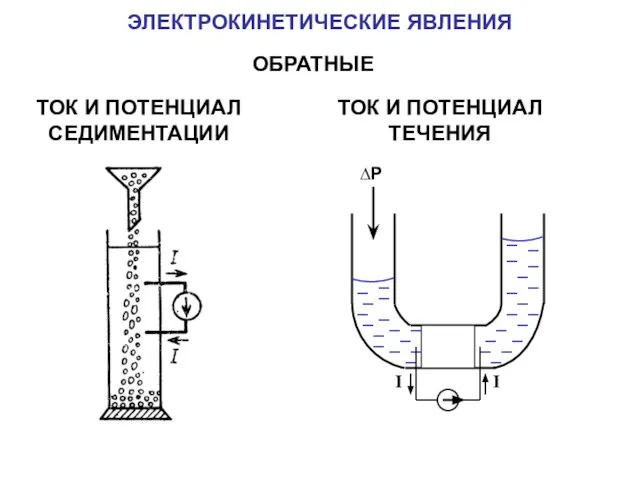
- 18. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ ОБРАТНЫЕ ТОК И ПОТЕНЦИАЛ СЕДИМЕНТАЦИИ ТОК И ПОТЕНЦИАЛ ТЕЧЕНИЯ
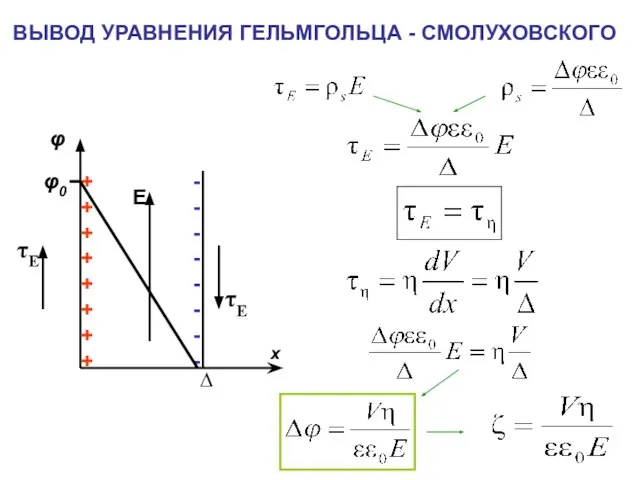
- 19. ВЫВОД УРАВНЕНИЯ ГЕЛЬМГОЛЬЦА - СМОЛУХОВСКОГО
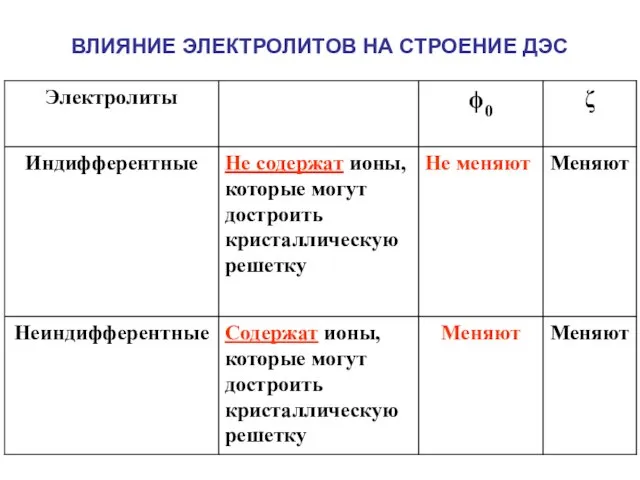
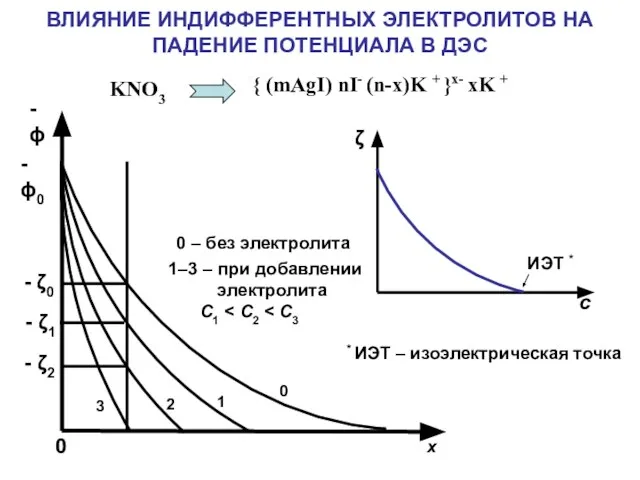
- 20. ВЛИЯНИЕ ЭЛЕКТРОЛИТОВ НА СТРОЕНИЕ ДЭС
- 21. х - ϕ - ϕ0 0 - ζ0 - ζ1 - ζ2 0 1 2 3
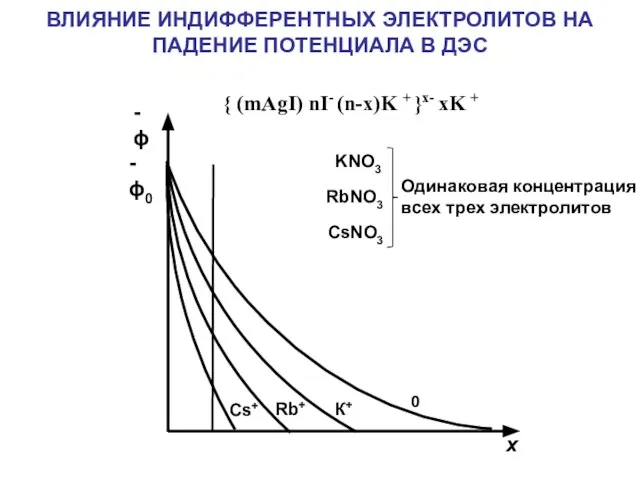
- 22. { (mAgI) nI- (n-x)K + }x- xK + 0 К+ Rb+ Cs+ - ϕ - ϕ0
- 23. ЛИОТРОПНЫЕ РЯДЫ Ряды ионов с убывающей адсорбционной способностью называются лиотропными рядами. Примеры: Одновалентные катионы Cs+ >
- 24. ИОННЫЙ ОБМЕН Уравнение Никольского ci – концентрация в двойном слое аi – активность в растворе Φi
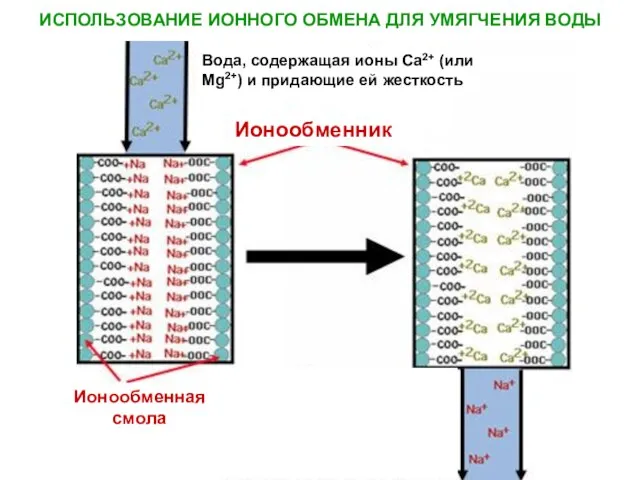
- 25. ИСПОЛЬЗОВАНИЕ ИОННОГО ОБМЕНА ДЛЯ УМЯГЧЕНИЯ ВОДЫ
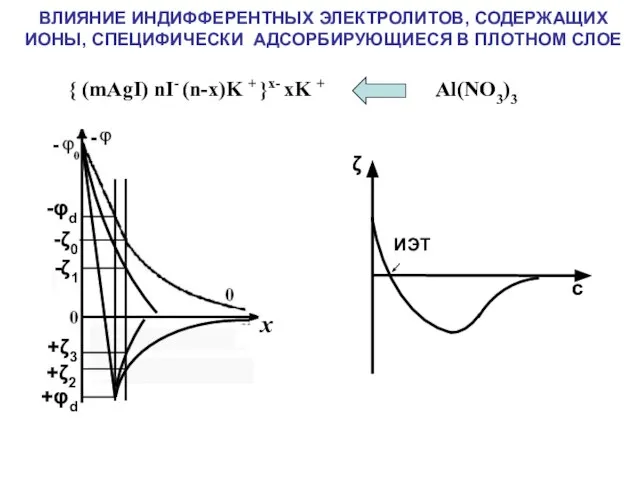
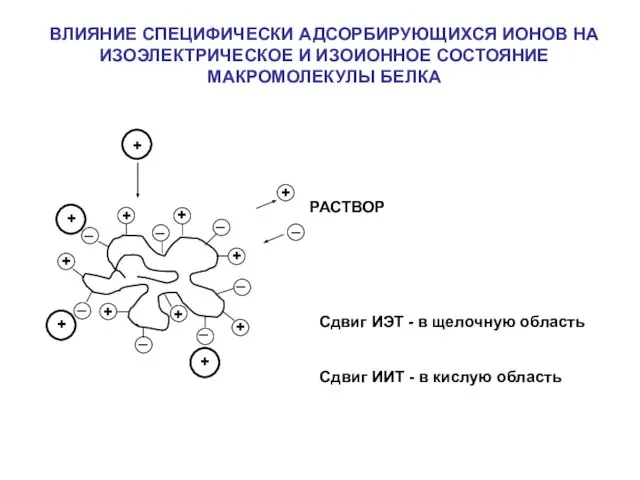
- 26. ВЛИЯНИЕ ИНДИФФЕРЕНТНЫХ ЭЛЕКТРОЛИТОВ, СОДЕРЖАЩИХ ИОНЫ, СПЕЦИФИЧЕСКИ АДСОРБИРУЮЩИЕСЯ В ПЛОТНОМ СЛОЕ -φd +φd -ζ0 +ζ2 { (mAgI)
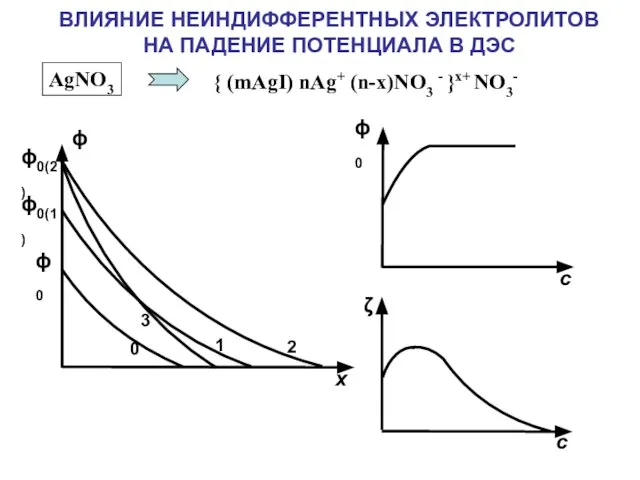
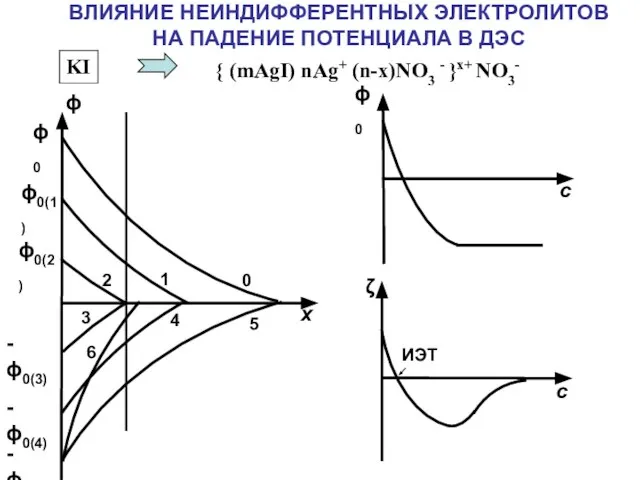
- 27. ВЛИЯНИЕ НЕИНДИФФЕРЕНТНЫХ ЭЛЕКТРОЛИТОВ НА ПАДЕНИЕ ПОТЕНЦИАЛА В ДЭС { (mAgI) nAg+ (n-x)NO3 - }x+ NO3- AgNO3
- 28. 0 1 2 3 4 5 6 ϕ ϕ0 ϕ0(1) ϕ0(2) - ϕ0(3) - ϕ0(4) -
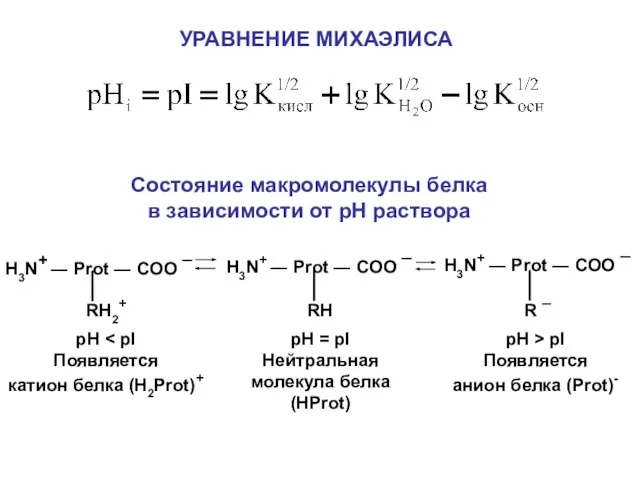
- 29. УРАВНЕНИЕ МИХАЭЛИСА Состояние макромолекулы белка в зависимости от рН раствора
- 30. + + + + + + + _ _ _ _ _ _ _ Сдвиг ИЭТ
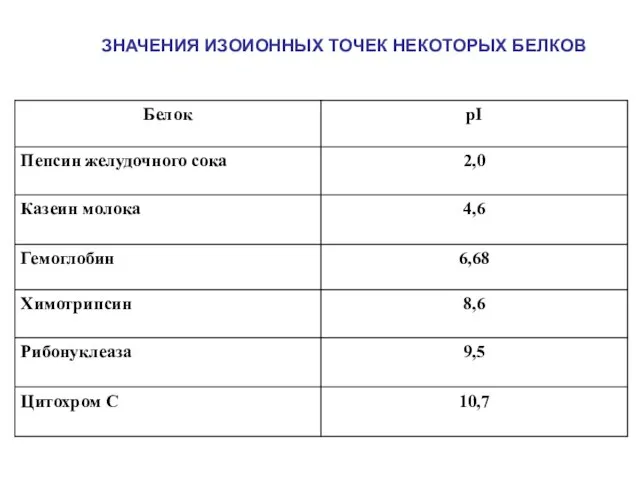
- 31. ЗНАЧЕНИЯ ИЗОИОННЫХ ТОЧЕК НЕКОТОРЫХ БЕЛКОВ
- 32. Электрофорез клеток Клетки позвоночных имеют отрицательный заряд. В гематологии: Аналитический и препаративный клеточный электрофорез: количественная оценка
- 33. Исследование электрофоретической подвижности эритроцитов периферической крови детей. 1. Установлено понижение электрофоретической подвижности эритроцитов периферической крови детей
- 34. ПРИМЕНЕНИЕ ЭЛЕКТРОКИНЕТИЧЕСКИХ ЯВЛЕНИЙ (Д.А.Фридрихсберг. Курс коллоидной химии, Санкт-Петербург: Химия, с.219, 1995) Электрофореграммы плазмы крови человека: здорового
- 36. Скачать презентацию











 Особенности истории России. Место России в мировом историческом процессе
Особенности истории России. Место России в мировом историческом процессе Оппортунистические инфекции
Оппортунистические инфекции  Всемирный день борьбы со СПИДом
Всемирный день борьбы со СПИДом Доказательная медицина и стандарты медицинской деятельности
Доказательная медицина и стандарты медицинской деятельности Система счетов и двойная запись
Система счетов и двойная запись Презентация на тему Лепка из пластилина
Презентация на тему Лепка из пластилина  Ночевала тучка золотая
Ночевала тучка золотая Revision
Revision Материально-производственная деятельность человека.
Материально-производственная деятельность человека. Как помочь ребёнку быть внимательным.
Как помочь ребёнку быть внимательным. Защитники земли русской. Работы учеников
Защитники земли русской. Работы учеников Презентация на тему ПОЛИТИЧЕСКИЙ ПРОГНОЗ: сущность, научные основы и принципы
Презентация на тему ПОЛИТИЧЕСКИЙ ПРОГНОЗ: сущность, научные основы и принципы  Словообразование (6 класс)
Словообразование (6 класс) 1 сентября. Классный час «От пера до компьютера».
1 сентября. Классный час «От пера до компьютера». Грамматические особенности перевода арабских фильмов на русский язык
Грамматические особенности перевода арабских фильмов на русский язык 1.3.2 Логические элементы ЭВМ
1.3.2 Логические элементы ЭВМ HTML
HTML Психологический климат в трудовом коллективе
Психологический климат в трудовом коллективе НОУ СОШ Гармония
НОУ СОШ Гармония Китайско-конфуцианская цивилизация
Китайско-конфуцианская цивилизация Каракули. Упражнение 2
Каракули. Упражнение 2 Презентация на тему Треугольники 7 класс геометрия
Презентация на тему Треугольники 7 класс геометрия  Moral Crisis in south Africa
Moral Crisis in south Africa Промоагентство
Промоагентство Презентация на тему Проблема темперамента и характера
Презентация на тему Проблема темперамента и характера Мой творческий путь в прозе и стихах
Мой творческий путь в прозе и стихах ПРОГРАММА«ТРИ ШАГА К УНИКАЛЬНОМУ СЕРВИСУ»GLOBAL SOLUTIONS Ltd.
ПРОГРАММА«ТРИ ШАГА К УНИКАЛЬНОМУ СЕРВИСУ»GLOBAL SOLUTIONS Ltd. Политические режимы. Типы политических режимов
Политические режимы. Типы политических режимов