Содержание
- 2. Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ
- 3. Задачи урока: Повторить общие химические свойства металлов Объяснить зависимость свойств металлов от их положения в ЭХРНМ
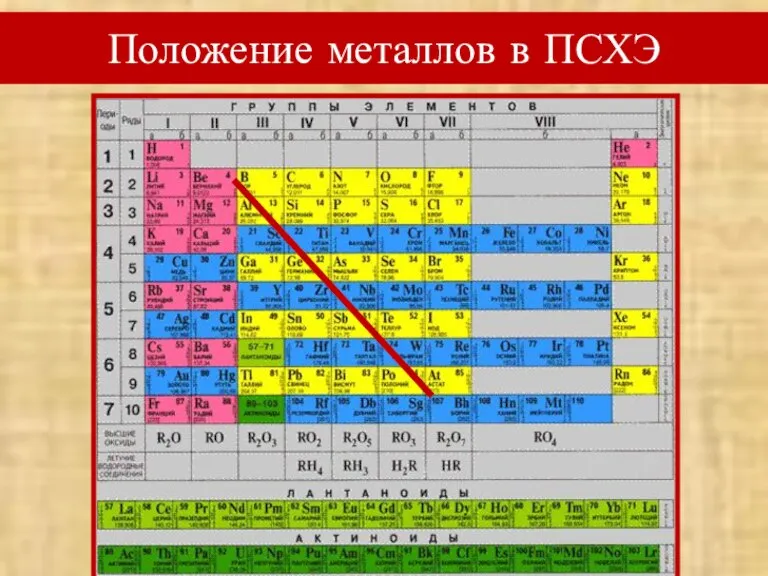
- 4. Вспомним! Положение металлов в ПСХЭ Особенности строения атомов металлов (радиус атома, количество электронов на внешнем энергетическом
- 5. Положение металлов в ПСХЭ
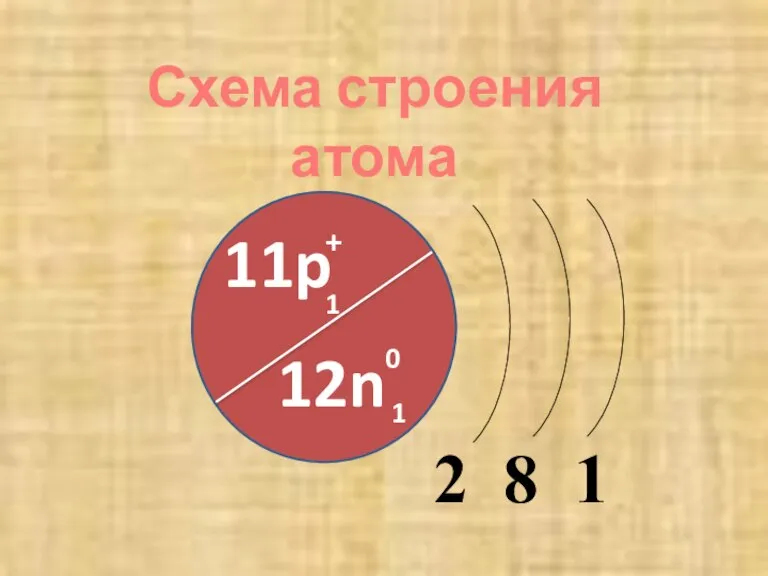
- 6. 2 8 1 11p + 1 12n 0 1 Схема строения атома
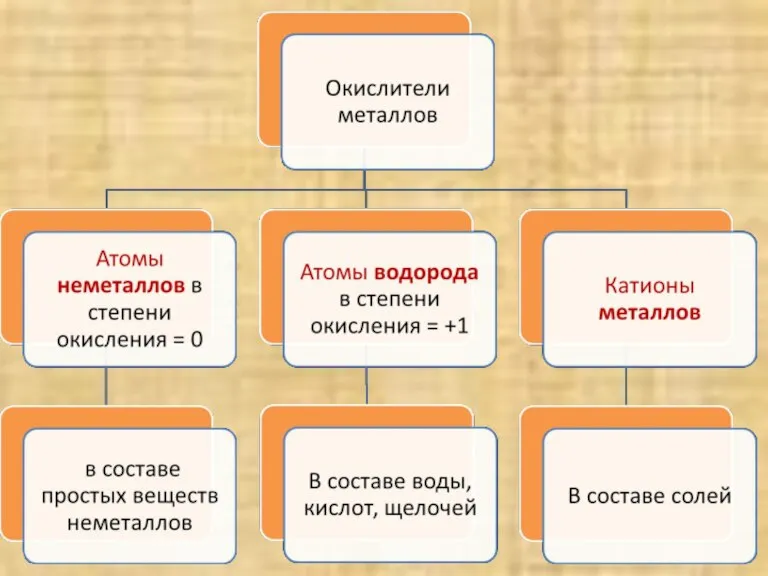
- 7. Вывод: Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ……………………….. отдают восстановителями
- 8. Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
- 10. Металлы взаимодействуют С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.) С водой
- 11. Электрохимический ряд напряжений металлов. Стр. 201
- 12. 4 правила ЭХРНМ 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является
- 13. Металлы после водорода… Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2H2SO4 = CuSO4 +
- 14. Металлы после водорода… Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт - 4 Cu + 4HNO3
- 15. Металлы после водорода… 3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl4]
- 16. Подведем черту… Металл + кислород = оксид металла Металл + хлор = хлорид металла Металл +
- 17. Подведем черту… Металл + серная кислота (к) = соль + вода + «Х», где «Х» -
- 18. Напишите реакции: калий + вода = гидроксид калия + водород кальций + вода = гидроксид кальция
- 19. железо + соляная кислота = хлорид железа (II) + водород никель + серная кислота = сульфат
- 20. железо + сульфат меди (II) = медь + сульфат железа (II) медь + нитрат ртути (II)
- 21. Диагностика Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной кислотой, хлоридом меди(II) Напишите реакцию
- 22. Решение диагностики: 1. 2Mg +O2 = 2MgO Mg +Cl2 = MgCl2 3Mg +N2 = Mg3N2 Mg
- 24. Скачать презентацию


















 Алгоритм презентации на защиту
Алгоритм презентации на защиту Современная киноиндустрия
Современная киноиндустрия Кто придумал ноль ?
Кто придумал ноль ? Направления деятельности изостудии Росинка
Направления деятельности изостудии Росинка Объединение Мир искусства. Часть 3
Объединение Мир искусства. Часть 3 Адаптация профессиональных спортсменов к выполнению предусмотренных нагрузок
Адаптация профессиональных спортсменов к выполнению предусмотренных нагрузок es-Persona индивидуальные заказы
es-Persona индивидуальные заказы Основы графической грамоты. Трудовое обучение
Основы графической грамоты. Трудовое обучение Установка разделения изотопов бора методом экстрактивной ректификации
Установка разделения изотопов бора методом экстрактивной ректификации Оценка уровня развития базовых способностей обучающихся
Оценка уровня развития базовых способностей обучающихся Презентация на тему Занятие по профориентации «Профессия - ветеринар»
Презентация на тему Занятие по профориентации «Профессия - ветеринар» История про маленьких лягушат….
История про маленьких лягушат…. Очистка и дезинфекция медицинских инструментов.
Очистка и дезинфекция медицинских инструментов. Особенности кредитно-модульной организации учебного процесса
Особенности кредитно-модульной организации учебного процесса Современные PLC телекоммуникации
Современные PLC телекоммуникации Здоровьесберегающие образовательные технологии на уроках английского языка
Здоровьесберегающие образовательные технологии на уроках английского языка Результаты инновационной работы педагогов ДОУ, представленных в СМИ 2011г.
Результаты инновационной работы педагогов ДОУ, представленных в СМИ 2011г. «Стабильный успех»
«Стабильный успех» Технологические среды в микроэлектронике. Газоподготовка в электронной технике
Технологические среды в микроэлектронике. Газоподготовка в электронной технике Я через 15 лет
Я через 15 лет The Golden Age
The Golden Age Машинные швы
Машинные швы РазработкаГосударственной Стратегии по развитию рынка трудадо 2020 года.
РазработкаГосударственной Стратегии по развитию рынка трудадо 2020 года. Криптосистемы с открытым ключем
Криптосистемы с открытым ключем Экскурсия в город Мастеров и Мастериц
Экскурсия в город Мастеров и Мастериц Битва за Днепр
Битва за Днепр Насилие в произведениях искусства
Насилие в произведениях искусства Страховая Компания «Согласие» является одной из крупнейших отечественных компаний, успешно работающей на Российском рынке страх
Страховая Компания «Согласие» является одной из крупнейших отечественных компаний, успешно работающей на Российском рынке страх