Слайд 2мел
тонкозернистый, мягкий, белый известняк, состоящий из мелких обломков и целых известковых скелетов

микроорганизмов (кокколитов, фораминифер и др.). Применяют в цементной, стекольной, резиновой и др. отраслях промышленности.
Слайд 3мрамор
от греч. marmaros — блестящий камень, горная порода, образовавшаяся в результате перекристаллизации

и метаморфизма известняков и доломитов. Разнообразен по окраске, нередко с красивым узором, хорошо принимает полировку. Декоративный и поделочный камень.
Слайд 4известняк
осадочная горная порода, состоящая главным образом из кальцита, редко — из арагонита;

часто с примесью доломита, глинистых и песчаных частиц. Известняки нередко содержат остатки известковых скелетов ископаемых организмов. Используется в металлургии (флюсы ), строительстве, химической промышленности и др.
Слайд 5 кораллы
КАЛЬЦИТ (известковый шпат),
минерал класса карбонатов, СаСО3.
Примеси Mg, Fe, Mn

и др.
Твердость 3; плотность 2,7 г/см3.
Разновидности: исландский шпат, бумажный шпат (листоватый), антраконит — черный кальцит.
Строительный и поделочный материал; металлургический флюс.
Слайд 6Гипс
от греч. gypsos —
мел, известь,
минерал класса сульфатов, CaSO4·2H2O.
Бесцветные, белые, серые

кристаллы,
Твердость 1,5-2; плотность 2,3 г/см3.
Разновидности: гипсовый шпат (полупрозрачные кристаллы); атласный шпат, или уральский селенит (параллельно-волокнистые агрегаты с шелковистым блеском), и алебастр (снежно-белый тонкозернистый гипс).
Используется в строительстве, для гипсования почв, в медицине.
Слайд 7Поваренная соль
НАТРИЯ ХЛОРИД (поваренная соль), NaCl, бесцветные кристаллы. Растворяется в воде. В

природе натрия хлорид широко распространен в виде каменной соли (галита), содержится в морской воде. Важная пищевая приправа; идет на получение едкого натра, хлора, соды.
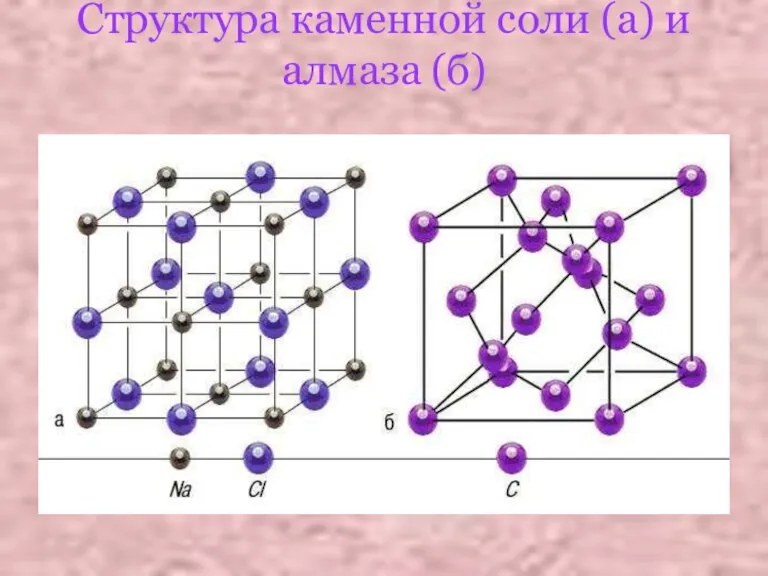
Слайд 8Структура каменной соли (а) и алмаза (б)
Слайд 9СОДА
Техническое название карбонатов
натрия. Нормальный карбонат
Na2CO3 называется содой кальцинированной;

гидрокарбонат NaHCO3 — питьевой
(пищевой).
Бесцветные кристаллы, раствори-
мость соответственно 14,9 г и 9,6 г в 100 г
воды при 20 °С; водные растворы имеют
щелочную реакцию. Na2CO3 получают
главным образом насыщением NH3 и СО2
раствора NaCl и дальнейшим нагрева-
нием до 1400 -160 °С, Na2CO3 применяют в
стекольной, мыловаренной, текстильной, целлюлозно-бумажной промышленности, для очистки нефти и т. д.
NaHCO3 — в производстве искусственных минеральных вод, в медицине, быту.
Слайд 10МЕДИ СУЛЬФАТ
CuSO4 - сернокислая медь. Растворяется в воде. Из водных растворов кристаллизуется

CuSO4 5H2O — медный купорос (ярко-синего цвета), который применяется в сельском хозяйстве (для борьбы с вредителями и для протравливания зерна) и при получении минеральных красок.
Слайд 11АММОНИЯ ХЛОРИД
NH4Cl- нашатырь, бесцветные кристаллы. Азотное удобрение
(до 25% N) для нейтральных

и щелочных почв под культуры,
слабо реагирующие на избыток
хлора (сахарная свекла, рис,
кукуруза). Применяют также в производстве сухих гальва-
нических элементов, при
паянии и лужении, в медицине,
как дымообразователь.
Слайд 12КАЛИЯ ПЕРМАНГАНАТ
KMnO4, темно-фиолетовые кристаллы. Растворим в воде. Цвет раствора красно-фиолетовый. Сильный окислитель.

Применяют для отбеливания тканей, в фотографии, аналитической химии, как антисептическое средство в медицине.
Марганцевые руды:
Слайд 13ХЛОРАТЫ
соли хлорноватой кислоты HClO3. Кристаллы; при обычной температуре устойчивы, при нагревании взрывоопасны.

Важны: калия хлорат (бертоллетова соль), хлорат натрия NaClO3 и хлорат магния Mg(ClO3)2. Хлораты применяют как окислители, гербициды и дефолианты. Ядовиты.
Слайд 14БУРА
Na2B4O7.10H2O.
В природе — минерал класса боратов, химический осадок усыхающих бороносных соляных

озер (напр., оз. Серлс, США).
Бесцветные кристаллы, tпл 60,8 °С, плохо растворяется в воде.
Компонент флюсов для сварки металлов, шихты для глазурей, стекла и керамики, моющих средств, антисептик, консервирующее средство.
Слайд 15НИТРАТЫ
соли азотной кислоты HNO3,
твердые хорошо растворимые в воде вещества.
Традиционное русское

название некоторых нитратов щелочных и щелочноземельных металлов и аммония — селитры (аммонийная селитра NH4NO3, калийная селитра КNO3, кальциевая селитра Са(NO3)2 и др.
Слайд 16Нахождение в природе и получение
Нитрат натрия NаNO3 (чилийская селитра) и нитрат калия

КNO3 (индийская селитра) встречаются в природе в Индии и в Чили.
В России натриевую селитру в виде белого налета получали при гниении различных органических остатков растительного и животного происхождения. Так как нитрат натрия гигроскопичен и не годится для изготовления пороха, его превращали в нитрат калия обработкой горячим насыщенным раствором КСl.
В настоящее время нитраты натрия и калия получают при нейтрализации азотной кислоты с использованием соды Na2CO3, поташа K2CO3 и др.
Слайд 17Физиологическое действие
Нитраты токсичны. Неорганические нитраты вызывают отек легких, тошноту, рвоту, острую сердечно-сосудистую

недостаточность. Смертельная доза для человека 8-15 мг/л, допустимое суточное потребление 5мг/л. Для суммы нитратов Na, K, Ca, NH4 Пдк: в воде 45 мг/л, в почве 130 мг/кг, в овощах и фруктах (мг/кг): картофель 250, капуста белокочанная поздняя 500, морковь поздняя 250, свекла 1400, лук репчатый 80, кабачки 400, дыни 90, арбуз, груши, яблоки 60.
Вдыхание паров органических нитратов, попадание их на кожу и в пищеварительный тракт вызывает головную боль, учащенное сердцебиение. Окисляют гемоглобин в метгемоглобин.
















 Станковая скульптура: бюст
Станковая скульптура: бюст Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г
Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г Системный подход на благо людей и природы
Системный подход на благо людей и природы Живете
Живете Этико-правовые проблемы конца жизни человека
Этико-правовые проблемы конца жизни человека ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ.
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ. УСПЕНСКИЙ СОБОР
УСПЕНСКИЙ СОБОР Опале листя: користь чи шкода
Опале листя: користь чи шкода Государственное управление в области природопользования и охраны окружающей среды
Государственное управление в области природопользования и охраны окружающей среды Магнитная гидродинамика солнечных явлений
Магнитная гидродинамика солнечных явлений Пишем проект!
Пишем проект! Этапы речевого развития
Этапы речевого развития Растения Чувашской республики
Растения Чувашской республики Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование)
Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование) Стресс и пути его преодоления
Стресс и пути его преодоления Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л
Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л Западный и Восточный типы культуры
Западный и Восточный типы культуры Упражнение Настроение
Упражнение Настроение Выполняй правила безопасности на дороге!
Выполняй правила безопасности на дороге! Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150
Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150 ОРКиСЭ
ОРКиСЭ Непревзойденные преимущества систем T2Red + T2Reflecta
Непревзойденные преимущества систем T2Red + T2Reflecta Модели данных
Модели данных  Модель организации внеурочной деятельности на основе краткосрочных курсов
Модель организации внеурочной деятельности на основе краткосрочных курсов История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России
История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России Высокоранговые и Низкопримативные правят миром
Высокоранговые и Низкопримативные правят миром Ртуть
Ртуть Презентация на тему: клавиатура.Авторы: Суханов Г.
Презентация на тему: клавиатура.Авторы: Суханов Г.