Содержание
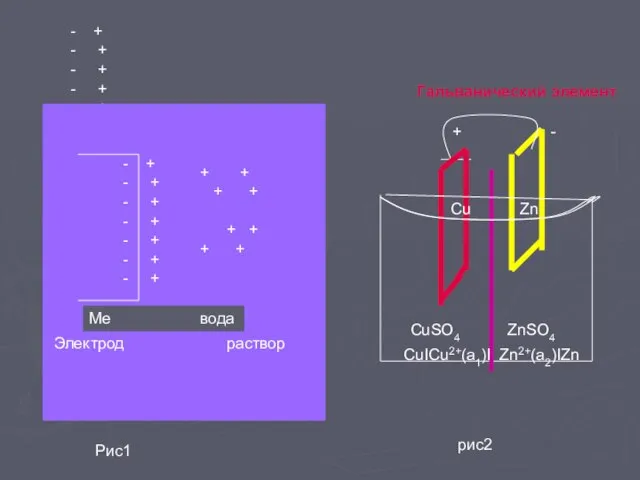
- 2. - + - + - + - + - + - + - + - +
- 3. ЭДС Е = φ1 - φ2 Е = Е0 + RT nF ln aм Где Е0
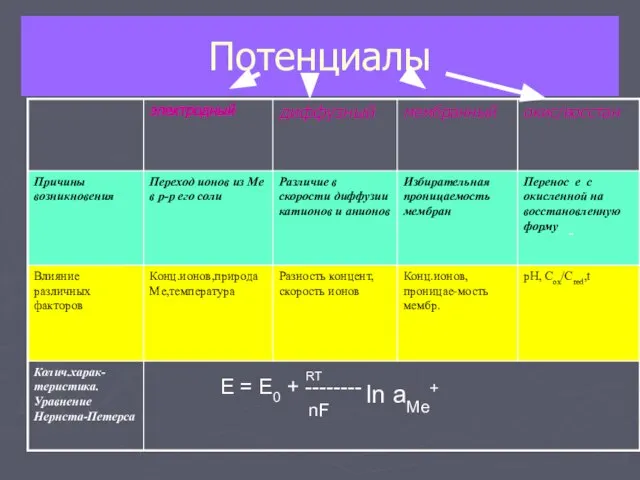
- 4. Потенциалы - E = E0 + -------- RT nF ln aMe+
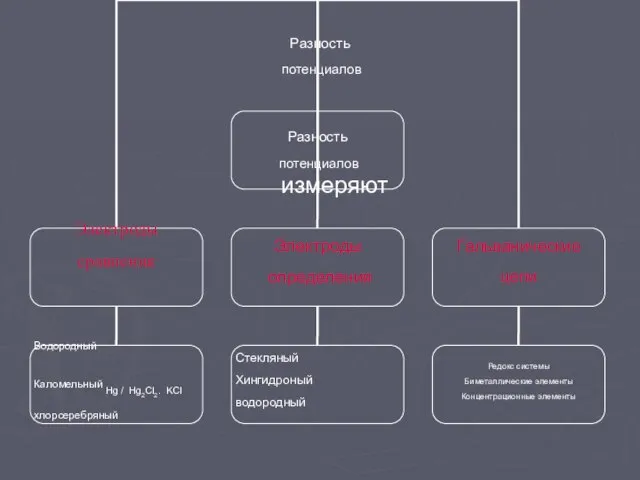
- 5. Разность потенциалов измеряют
- 6. E E (cu2+/ Cu0) = + 0,34в E(Ag+/Ag) = + 0,8 B E (Zn2+/ Zn0) =
- 7. 2 Hg + 2Ag+ 2Ag0 + Hg2+ E(Ag+/Ag) = +0,74B окислитель E(Hg2+/Hg) = +0,67B восстановитель ∆E
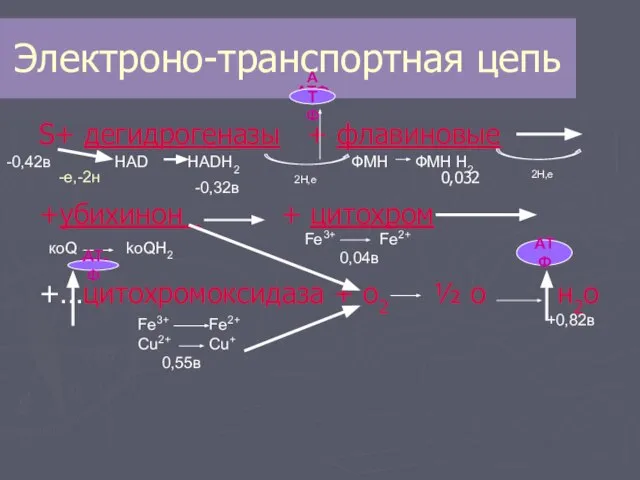
- 8. Электроно-транспортная цепь S+ дегидрогеназы + флавиновые +убихинон + цитохром +…цитохромоксидаза + о2 ½ о н2о -0,42в
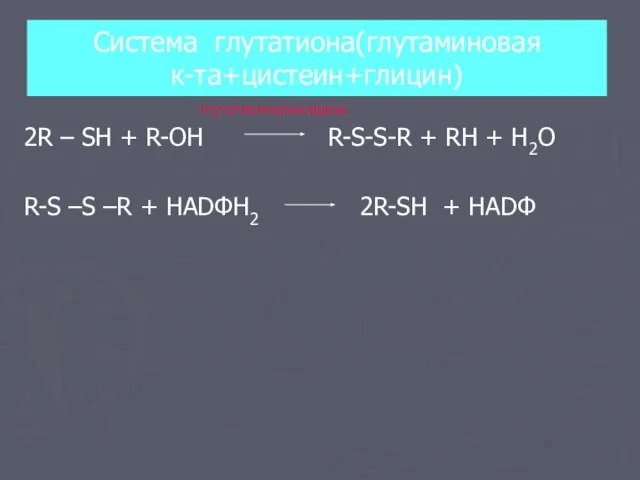
- 9. Система глутатиона(глутаминовая к-та+цистеин+глицин) 2R – SH + R-OH R-S-S-R + RH + H2O R-S –S –R
- 11. Скачать презентацию



 Повышение эффективности сотрудников с помощью современных технологий.
Повышение эффективности сотрудников с помощью современных технологий. j6u5
j6u5 Физическая культура в детском саду
Физическая культура в детском саду Особенности организации воспитательного процесса в Лучановской средней общеобразовательной школе
Особенности организации воспитательного процесса в Лучановской средней общеобразовательной школе Художник-пейзажист Исаак Ильич Левитан
Художник-пейзажист Исаак Ильич Левитан FB'I. Информация о фитнес-клубе
FB'I. Информация о фитнес-клубе История Конституции Российской Федерации
История Конституции Российской Федерации НОВАЯ ЭКОНОМИЧЕСКАЯ ГЕОГРАФИЯВ СТРУКТУРЕ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ СПБФ НИУ ВШЭ
НОВАЯ ЭКОНОМИЧЕСКАЯ ГЕОГРАФИЯВ СТРУКТУРЕ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ СПБФ НИУ ВШЭ ИНТЕГРАЦИЯ И КОНВЕРГЕНЦИЯ МЕТОДОВ МОДЕЛИРОВАНИЯ ИАС ДЛЯ РЕШЕНИЯ ЗАДАЧ УПРАВЛЕНИЯ ЗНАНИЯМИ
ИНТЕГРАЦИЯ И КОНВЕРГЕНЦИЯ МЕТОДОВ МОДЕЛИРОВАНИЯ ИАС ДЛЯ РЕШЕНИЯ ЗАДАЧ УПРАВЛЕНИЯ ЗНАНИЯМИ Уроки макияжа Глаза-зеркало души
Уроки макияжа Глаза-зеркало души Мультимедийная презентация“Цена победы”Тема:“Сталинградская эпопея”
Мультимедийная презентация“Цена победы”Тема:“Сталинградская эпопея” Перспективы энергетики и последняя информация о проекте «Сахалин-1»
Перспективы энергетики и последняя информация о проекте «Сахалин-1» О ходе строительства Федерального высокотехнологичного центра медицинской радиологии в г. Димитровграде ФМБА РОССИИ Докладчик: Р
О ходе строительства Федерального высокотехнологичного центра медицинской радиологии в г. Димитровграде ФМБА РОССИИ Докладчик: Р Иван Сергеевич Шмелев
Иван Сергеевич Шмелев Обратные тригонометрические функции (11 класс)
Обратные тригонометрические функции (11 класс) Участие работодателей в программе государственного софинансирования пенсии
Участие работодателей в программе государственного софинансирования пенсии Тринитарные высказывания Елены Уайт. Что на самом деле говорила и писала Елена Уайт
Тринитарные высказывания Елены Уайт. Что на самом деле говорила и писала Елена Уайт КИСЛОТНЫЙ СОСТАВ ДЛЯ НАПРАВЛЕННОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА
КИСЛОТНЫЙ СОСТАВ ДЛЯ НАПРАВЛЕННОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА Тайна имени
Тайна имени План перепланировки квартиры
План перепланировки квартиры О работе ШРР
О работе ШРР Русские художники-пейзажисты
Русские художники-пейзажисты Архиваторы.
Архиваторы. Внешнее строение листа. Учитель Рудак В.П.
Внешнее строение листа. Учитель Рудак В.П. Раскол русской церкви и его сущность
Раскол русской церкви и его сущность Фотоотчет RTS Decaux ECCO
Фотоотчет RTS Decaux ECCO Владимир Владимирович Маяковский 1893-1930
Владимир Владимирович Маяковский 1893-1930 Домашние опасности (2 класс)
Домашние опасности (2 класс)