Слайд 2Фтор – довольно распространенный элемент. Из минералов фтора наибольшее значение имеют СаF2

— плавиковый шпат (флюорит), Nа3А1F6 — криолит и Са5(РО4)3F— фторапатит. Фтористые соединения содержатся в организме человека (в основном в зубах и костях). В природе встречается только один изотоп 19F. Искусственно получены малоустойчивые изотопы (с массовыми числами от 16 до 21).
Слайд 3Простое вещество. Подобно водороду фтор образует двухатомные молекулы F2, что соответствует следующей

электронной конфигурации:
( σsсв)2 (σs разр)2 (σхсв)2 ( πy, zсв )4 (πy, zразр)4.
Поскольку на связывающих орбиталях имеется на два электрона больше, чем на разрыхляющих, порядок связи в молекуле F2 принимается равным 1.
Слайд 4Молекула фтора F2 имеет относительно небольшую массу и достаточно подвижна, поэтому фтор

в обычных условиях — газ (светло-желтого цвета), обладает низкой температурой плавления (—223 °С) и кипения (—187 oС).
Из-за высокой окислительной активности фтора и большой прочности его соединений фтор получают в свободном состоянии электролизом его расплавленных соединений. Для этих целей обычно используют эвтектическую смесь НF – КF или фторогидрогенаты калия (например K[HF2] - дифторогидрогенат калия).
Фтор и его соединения сильно ядовиты (исключение составляют CF4, SF6 - элегаз и некоторые другие вещества).
Слайд 5Вследствие высокой химической активности фтор вызывает коррозию почти всех материалов. В качестве

материала аппаратуры для получения фтор, его хранения и перевозки используется нержавеющая сталь, медь; никель (и некоторые его сплавы), который устойчив к действию фтора за счет образования защитной пленки NiF2.
В целом проблема эта разрешена, и фтор перевозится в больших количествах в гигантских автоцистернах (обычно в сжиженном виде).
Слайд 6Широкое применение фтора началось в связи с работами по разделению изотопов урана

(в виде 235UF6 и 238UF6) диффузионным методом. UF4 используется для получения металлического урана. (Фтор также используется в технологии редких элементов Nb, Ta и др.). В настоящее время фтор широко применяется для синтеза различных хладоагентов и полимерных материалов—фторопластов, отличающихся высокой химической стойкостью.
Жидкий фтор и ряд его соединений применяются в качестве окислителя ракетного топлива.
Слайд 7Фтор исключительно активен химически, он — сильнейший окислитель. Высокая химическая активность фтора

объясняется тем, что его молекула имеет низкую энергию диссоциации (159 кДж/моль), в то время как химическая связь в большинстве соединений фтора отличается большой прочностью (порядка 200—600 кДж/моль). (Энергия связи E(H-F) =566, E(Si-F)=582 кДж/моль). Кроме того, энергия активации реакций с участием атомов фтора низка (≤ 4 кДж/моль). Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы.
Низкое значение энергии связи молекулы F2 можно объяснить сильным отталкиванием электронных пар, находящихся на π-орбиталях, обусловленным малой длиной связи F-F.
Слайд 8По образному выражению акад. А. Е. Ферсмана, фтор «всесъедающий». В атмосфере фтора

горят такие стойкие вещества, как стекло (в виде ваты), вода:
SiO2 + 2F2 = SiF4 + O2;
2Н2O + 2F2 = 4НF + O2 (О3, ОF2).
В этих реакциях в качестве одного из продуктов горения образуется кислород (!), т. е фтор как окислитель сильнее кислорода.
Pt сгорает во фторе Pt + F2 = PtF6 (Тпл. = 61, Ткип. = 69 оС) получается летучее кристаллическое вещество темно-красного цвета. Относится к числу самых сильных окислителей, является сильнейшим фторирующим реагентом.
Слайд 9Исключительно активно протекает взаимодействие фтора с большинством простых веществ. С серой и

фосфором он взаимодействует даже при температуре жидкого воздуха (—190 °С):
S + 3F2 = SF6 (г), ΔНo298 = -1207 кДж/моль;
2P + 3F2 = 2PF3 (ж), ΔНo298 = -311,7кДж/моль;
2Р + 5F2 =2РF5 (кр), ΔНo298 = -3186 кДж/моль.
Реакции с фтором водородсодержащих веществ (H2O, H2, NH3, B2H6, SiH4, AlH3 и др.) сопровождается образованием HF.
2NH3(г) + 3F2(г) = 6HF(г) + N2(г); ΔGo = —1604 кДж/моль
2NH3(г) +6F2(г) = 6HF(г) + 2NF3(г); ΔGo = —1772 кДж/моль
Первая протекает при высоких Т (ΔS>0) вторая – при более низких Т (ΔS<0).
Слайд 10Фтор окисляет некоторые так называемые инертные газы: (при нормальном Р)
Хе + 2F2

= ХеF4(к), ΔНo298 = – 252 кДж/моль;
Хе + 3F2 = ХеF6(к) (при повышенном Р = 6МПа)
Хе + F2 = ХеF2(к) (электр. разр., УФ-излучение)
2ХеF2 = Хе + ХеF4; 3ХеF4 = Хе + 2ХеF6.
ХеF6 + H2O = ХеOF4(ж) + 2HF;
ХеOF4 +2H2O = ХеO3(т) + 4HF
Xe + PtF6 = Xe+[PtF6]-.
Непосредственно фтор не взаимодействует лишь с гелием, неоном и аргоном.
Слайд 11Е АОF MOXeF AOXe
σразр
σ
5p
2р
σсв
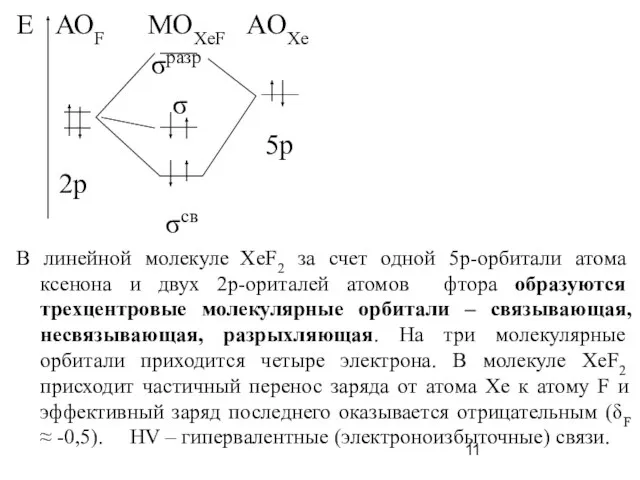
В линейной молекуле ХеF2 за счет одной 5р-орбитали атома ксенона и двух 2р-ориталей атомов фтора образуются трехцентровые молекулярные орбитали – связывающая, несвязывающая, разрыхляющая. На три молекулярные орбитали приходится четыре электрона. В молекуле XeF2 присходит частичный перенос заряда от атома Xe к атому F и эффективный заряд последнего оказывается отрицательным (δF ≈ -0,5). HV – гипервалентные (электроноизбыточные) связи.
Слайд 12В соответствии с закономерным изменением характера элементов по периодам и группам периодической

системы закономерно изменяются и свойства фторидов, например:
Химическая природа
NaF, MgF2 основная
AlF3 амфотерная
AlF63-
SiF4, PF5, SF6, (ClF5) кислотная
SiF62-, PF6-, SF60, (ClF6-)
Известно много прочных комплексов ([BF4]-, [BeF4]2-,
[SiF6]2-, [AlF6]3- и др.). WF6>ReF6> OsF6>IrF6>PtF6
Слайд 13Ионные фториды кристаллические вещества с высокой температурой плавления. Координационное число иона фтора

6 (NаF) или 4 (СаF2).
Ковалентные фториды газы или жидкости.
Промежуточное положение между ионными и ковалентными фторидами занимают фториды с высокой степенью полярности связи, которые можно назвать ионно-ковалентными соединениями.
К последним, например, можно отнести кристаллические ZnF2, МnF2, СоF2, NiF2, в которых эффективные заряды электроположительных атомов составляют 1,56; 1,63; 1,46; 1,40 соответственно.
Слайд 14Многие фториды металлов в низких степенях окисления получают действием раствора HF на

оксиды, гидроксиды, карбонаты и пр., например:
3НF + Аl(ОН)3 = АlF3 + 3H2О
Фториды неметаллов и металлов в высоких степенях окисления получают фторированием простых веществ или низших фторидов, например:
F2 + Cl2 = 2СlF; СlF + F2 = СlF3; СlF3 + F2 = СlF5
I2 + 7F2 = 2IF7
Стабильность фторидов возрастает с увеличением положительной степени окисления галогенов.
Согласно методу МО, трифториды характеризуются неравноценными связями Г-F: одной трехцентровой F-Г-F и одной двухцентровой Г-F.
(2- трехцентровых и 1-двухцентровых связей соответственно у пентафторида.)
Слайд 15По химической природе ионные фториды являются основными соединениями, а ковалентные фториды —

кислотными. Так в реакции
2NаF + SiF4 = Nа2[SiF6]
основный кислотный гексафторосиликат натрия
ионный NаF выступает в качестве донора, а ковалентный SiF4 — в качестве акцептора электронных пар, носителем которых является фторид-ион F-.
Слайд 16Основные фториды при гидролизе создают щелочную среду, а кислотные фториды — кислотную

NaF + H2O = NaOH + HF
SiF4 + 3Н2O = Н2SiО3 + 4НF
Амфотерные фториды взаимодействуют как с основными, так и с кислотными фторидами. В последнем случае образуются смешанные фториды, например:
2КF + ВеF2= К2[ВеF4]
(ВеF2 как кислотное соединение)
ВеF2 + SiF4 = Be[SiF6]
(ВеF2 как основное соединение)
Слайд 17
В неводных растворах PF5 взаимодействует с основными фторидами
KF + PF5 =

KPF6
С жидким HF образует
НF + PF5 = HPF6 – гексафторофосфорная кислота (водный раствор – очень сильная кислота)
Слайд 18Комплексные фториды весьма разнообразны. Координационное число по фтору для элементов 2-го периода

равно 4, для элементов других периодов типичное координационное число 6. Кроме того, встречаются комплексные фториды, в которых координационное число комплексообразователя равно 7, 8 и 9, например:
К2[ВеF4] К3[А1F6] К2[NbF7] К2[ReF9]
Эти же примеры показывают, что во фторокомплексах стабилизируется. высшая степень окисления центральных атомов.
Производные фторокомплексов представляют собой преимущественно ионые соединения либо относятся к смешанным (полимерным) фторидам (например, ВеSiF6).
Соединения с водородом типа НВF4, НРF6, Н2SiF6 в свободном состоянии неустойчивы. Их водные растворы — очень сильные кислоты (типа HClO4).
Слайд 19Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в

отличие от хлора) в темноте с образование фтористого водорода
H2 + F2 = 2HF↑
Обычно фтористый водород получают при нагревании действием серной кислоты на флюорит:
CaF2 + H2SO4 = CaSO4 + 2HF↑
Слайд 20Молекула фторида водорода НF сильно полярна и имеет большую склонность к ассоциации

за счет водородных связей в зигзагообразные цепи. Поэтому фторид водорода в обычных условиях — бесцветная жидкость (Тпл. -83 °С, Ткип. 19,5 оС) с резким запахом, сильно дымящая на воздухе. Даже в состоянии газа фторид водорода состоит из смеси полимеров Н2F2, Н3F3, Н4F4, Н5F5, Н6F6. Простые молекулы НF существуют лишь при температурах выше 90 °С. Вследствие высокой прочности связи (энергия диссоциации 565 кДж/моль) термический распад НF на атомы становится заметным выше 3500 oC.
Слайд 21Собственная ионизация жидкого НF незначительна (К = 2,07⋅10-11). Она происходит путем перехода

протона (или соответственно иона фтора) от одной молекулы к другой, сопровождающегося превращением водородной связи из межмолекулярной в межатомную и в ковалентную. При этом образуются сольватированные фтороний-ион FH2+ и фторогидрогенат-ион НF2- по схеме
Н—F⋅⋅⋅Н—F⋅⋅⋅Н—F ↔ [H—F—H]+ + [F—Н—F]-
Слайд 22Жидкий фторид водорода - сильный ионизирующий растворитель. В нем хорошо растворяются вода,

фториды, сульфаты и нитраты s-элементов I группы, несколько хуже аналогичные соединения s-элементов II группы. При этом растворенные вещества, отнимая от молекул НF протоны, увеличивают концентрацию отрицательных ионов (HF2-), т. е. ведут себя как основания. Например:
КNO3 + 2НF ↔ К+ + НNO3 + HF2-
Слайд 23Даже НNО3 в этих условиях ведет себя как основание:
НNО3 + 2НF ↔

NО3Н2+ + HF2-
индифферентный в воде этиловый спирт в жидком фториде водорода оказывается таким же сильным основанием, как КОН в воде:
С2Н5ОН + 2НF ↔ С2Н5OН2+ + HF2-
Слайд 24В жидком НF ведут себя как кислоты вещества — акцепторы фторид-ионов, например

BF3, SbF5:
BF3 + 2НF = FH2+ + ВF4-
SbF5 + 2НF = FH2+ + SbF6-
При растворении кислот увеличивается концентрация положительных фто-роний-ионов FH2+.
Слайд 25Амфотерными соединениями в жидком НF являются, например, фториды алюминия и хрома (III):
3NаF

+ АIF3 = 3Nа+ + А1F63-
(АIF3 как кислотное соединение)
АlF3 + 3ВF3 = А13+ + 3ВF4-
(АIF3 как основное соединение)
Слайд 26HF неограниченно растворяется в воде. HF ионизируется с образованием ионов OH3+ и

F-.
Последние взаимодействуя с HF, образуют фторогидрогенат-ионы: 2HF +Н2О = OH3+ +НF2-.
Раствор НF (плавиковая кислота) (фтороводородная = фтористоводородная) является кислотой средней силы (К=6,2⋅10-4). В растворе содержатся также комплексные ионы Н2F3-, Н3F4-, НnFn+1-. Поэтому при нейтрализации растворов плавиковой кислоты образуются не фториды, а фторогидрогенаты типа К[НF2].
Слайд 27При нейтрализации HF образуются фторогидрогенаты
2HF + KOH = K[HF2] +
![При нейтрализации HF образуются фторогидрогенаты 2HF + KOH = K[HF2] + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361954/slide-26.jpg)
H2O
КНF2, КH2F3, КH3F4, КH4F5
Тпл соответственно 239, 62, 66, 72 оС
Эти соединения, как правило, хорошо кристаллизуются и плавятся без разложения Полимерные гидрогенат-ионы имеют зигзагообразную форму. Они образованы за счет водородной связи.
Слайд 28Термическое разложение фторогидрогенатов используется для получения чистого НF и фторида металла:
KHF2

= KF + HF
К [НnFn+1] = К [Нn-1Fn] + НF
Слайд 29Характерная особенность плавиковой кислоты (фтористоводородной = фтороводородной) ее способность взаимодействовать с диоксидом

кремния:
SiO2 (к) + 4НF (р) = SiF4 (г) + 2Н2O (ж)
SiF4 (г) + 2НF (р) = H2SiF6 (р)
Поэтому ее обычно хранят в сосудах из свинца, каучука, полиэтилена или парафина, а не в стеклянной посуде. Она токсична, при попадании на кожу вызывает плохо заживающие болезненные язвы.
Плавиковая кислота применяется для травления стекла, удаления песка с металлического литья, получения фторидов и т. д. Фторид водорода в основном используется в органическом синтезе.
Слайд 30В соединениях со фтором у кислорода проявляется электроположительная поляризация атомов.
Простейший представитель

такого рода соединений — дифторид кислорода ОF2: его получают при быстром пропускании фтора через охлажденный 2%-ный раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O.
ОF2 в воде малорастворим и с ней не взаимодей-ствует. Он смешивается (не реагируя) с Н2, СН4 или СО. При пропускании через такую смесь искры происходит сильный взрыв. Смеси ОF2 с Cl2, Br2 и I2 взрываются при комнатной температуре. ОF2 выделяет остальные галогениды из их кислот и солей:
ОF2 +4НX (ag) = 2X2 + 2HF + H2O.
Слайд 31Молекула ОF2 имеет угловую форму. Дифторид кислорода ядовитый газ бледно-желтого цвета, термически
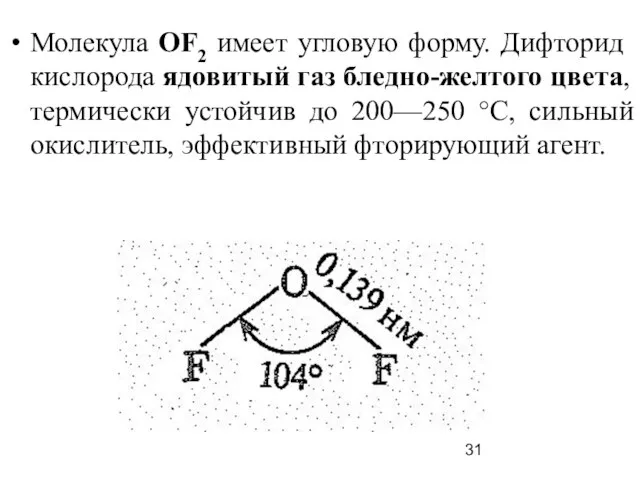
устойчив до 200—250 °С, сильный окислитель, эффективный фторирующий агент.
Слайд 32 ОF2 довольно легко гидролизуется основаниями, водой – гораздо медленнее:
OF2 +

2NaOH = 2NaF + O2 + H2O.
Но с горячим паром происходит взрыв:
ОF2 + Н2О = О2 + 2HF.
Молекула О2F2 образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). (Разлагается при – 57 оС). Оранжево-желтый газ при н.у. Диамагнитна (все электроны спарены). В диоксидифториде О2F2 радикал О22+ ковалентно связан с атомами фтора.
Слайд 33Длина связи О-О в О2F2 значительно короче связи О-О в Н2О2 и
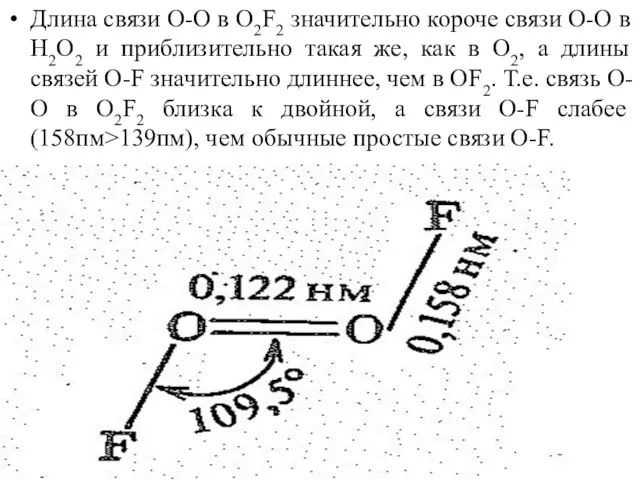
приблизительно такая же, как в О2, а длины связей О-F значительно длиннее, чем в ОF2. Т.е. связь О-О в О2F2 близка к двойной, а связи О-F слабее (158пм>139пм), чем обычные простые связи О-F.
Слайд 34Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль).

























![При нейтрализации HF образуются фторогидрогенаты 2HF + KOH = K[HF2] + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361954/slide-26.jpg)







 Презентация на тему Вода - главный источник жизни
Презентация на тему Вода - главный источник жизни Презентация на тему Великие русские писатели
Презентация на тему Великие русские писатели  Использование игровых технологий на уроках географии
Использование игровых технологий на уроках географии Использование инновационных форм компьютерных технологий в обучении иностранному языку
Использование инновационных форм компьютерных технологий в обучении иностранному языку Основные понятия и определения изучаемые в разделе акробатика с элементами гимнастики
Основные понятия и определения изучаемые в разделе акробатика с элементами гимнастики Ostrov_mechty
Ostrov_mechty Физико - математические науки
Физико - математические науки Справится ли местоимение с ролью обращения?
Справится ли местоимение с ролью обращения? Современное и эффективное средство продвижения вашего продукта. Впервые на рынке Украины!
Современное и эффективное средство продвижения вашего продукта. Впервые на рынке Украины! Применение современных моделей автоматизации в профессиональной деятельности повара, кондитера
Применение современных моделей автоматизации в профессиональной деятельности повара, кондитера Крылатые крыловские слова
Крылатые крыловские слова Предупредим конфликт интересов. Викторина
Предупредим конфликт интересов. Викторина 70 лет снятия блокады Ленинграда
70 лет снятия блокады Ленинграда Культура Древнего Египта
Культура Древнего Египта  Свадебный рушник. Семейная реликвия семьи Коньшина Данила
Свадебный рушник. Семейная реликвия семьи Коньшина Данила TeleBingo new таблица
TeleBingo new таблица Программа фундаментальных исследований Президиума РАН № 27 «ОСНОВЫ ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ НАНОТЕХНОЛОГИЙ И НАНОМАТЕРИАЛО
Программа фундаментальных исследований Президиума РАН № 27 «ОСНОВЫ ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ НАНОТЕХНОЛОГИЙ И НАНОМАТЕРИАЛО Восточный базар
Восточный базар Презентация на тему Освоение Земли человеком (7 класс)
Презентация на тему Освоение Земли человеком (7 класс) Презентация на тему Второй и третий признаки подобия треугольников
Презентация на тему Второй и третий признаки подобия треугольников  Основы военной подготовки
Основы военной подготовки Презентация
Презентация Презентация на тему Технология обработки текстовой информации
Презентация на тему Технология обработки текстовой информации Манна
Манна 200-летию Победы России в Отечественной войне 1812 года посвящается
200-летию Победы России в Отечественной войне 1812 года посвящается Микрогибридные аккумуляторные технологии
Микрогибридные аккумуляторные технологии Социально-экономическое развитие пореформенной России в условиях экономического спада
Социально-экономическое развитие пореформенной России в условиях экономического спада Москва многонациональная
Москва многонациональная