Содержание
- 2. Тематический план лекций Элементы химической термодинамики, термодинамики растворов и химической кинетики Биологически активные низкомолекулярные неорганические и
- 3. Тематический план лекций 4. Физико-химия поверхностных явлений в функционировании живых систем 5. Физико-химия дисперсных систем в
- 4. Литература 1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа, 2007. -976 с. 2.
- 5. 3.Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для студентов мед. вузов. - 3-е изд.,
- 6. Интернет-источники http://www.chemlib.ru http://http://www.chem.msu.su http://www.xumuk.ru/ http://www.alhimik.ru/ http://alhimikov.net/ http://chemistry.narod.ru/ http://www.chemport.ru/
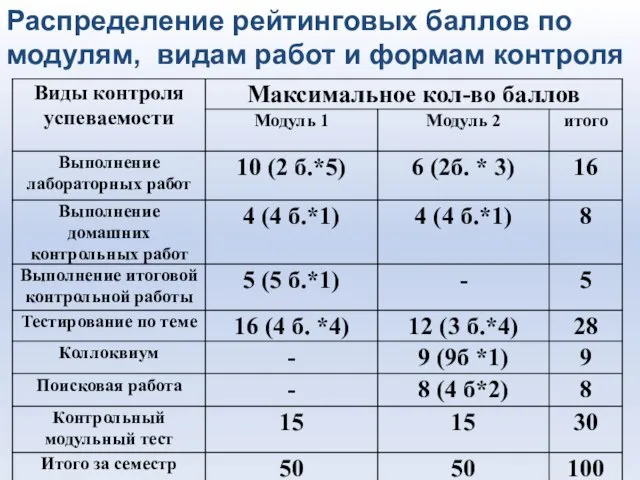
- 7. Распределение рейтинговых баллов по модулям, видам работ и формам контроля
- 8. I. Элементы химической термодинамики, термодинамики растворов и химической кинетики
- 9. План 1. Основные понятия химической термодинамики 2. Первое начало термодинамики. Энтальпия. Закон Гесса. 3. Второе начало
- 10. Значение химии в медицине 78 химических элементов входят в состав живых организмов. 44 элемента составляют лекарственные
- 11. 5. В организме человека реализуется около 100 тысяч химических превращений. 6. Живая клетка функционирует по строгим
- 12. Задача, стоящая перед медиками в ближайшее время, предупреждать, а не лечить болезни. Чтобы стать высококвалифицированным специалистом
- 13. Термодинамика - наука, изучающая общие законы взаимного превращения одной формы энергии в другую.
- 14. К настоящему времени термодинамика содержит два основных раздела: 1.Равновесная термодинамика (термодинамика изолированных систем) 2. Неравновесная термодинамика
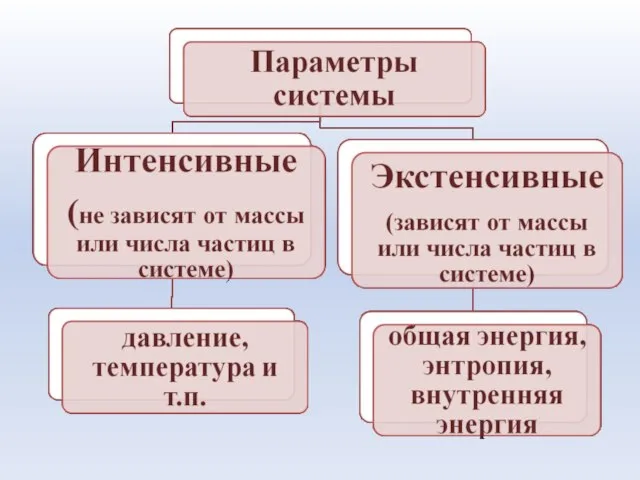
- 15. Система – это совокупность материальных объектов (тел), ограниченных каким-либо образом от окружающей среды Элементы системы -
- 16. Возможны два способа передачи энергии. Упорядоченная форма передачи энергии, которая связана с изменением внешних (объема и
- 17. Термодинамические системы: • Гомогенная – система, в которой каждое ее свойство (параметр) имеет одно и то
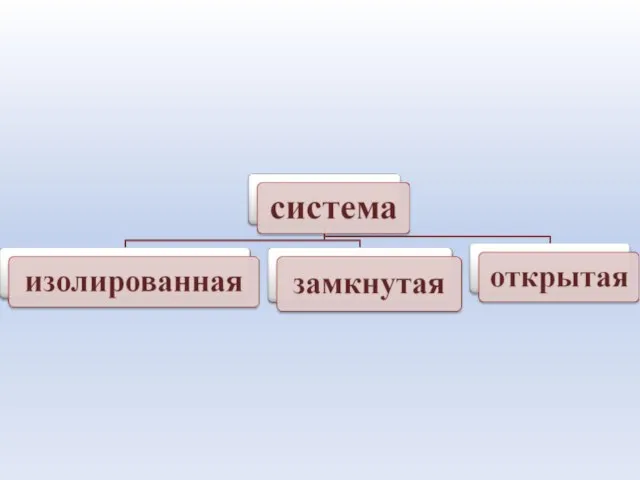
- 19. Изолированная система – система , которая не обменивается с окружающей средой ни веществом, ни энергией в
- 20. Открытая система – система, которая обменивается с окружающей средой и энергией, и веществом. Живые организмы –
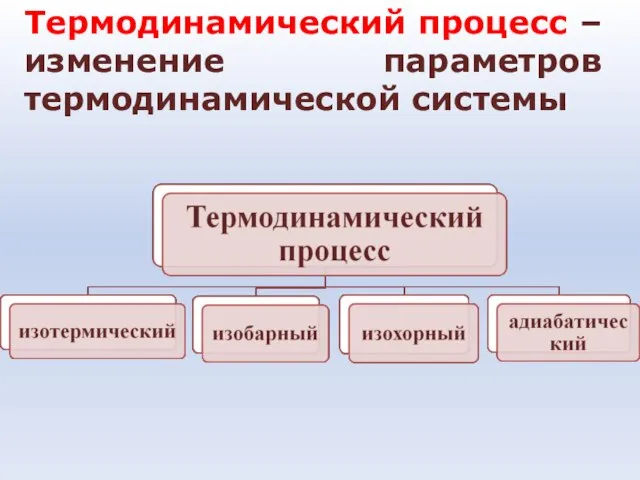
- 22. Термодинамический процесс – изменение параметров термодинамической системы
- 23. Энергия системы (W) - совокупность двух частей: зависящей от движения и положения системы как целого (Wц)
- 24. Внутренняя энергия системы - энергия теплового движения частиц, химическая и ядерная энергия, определяющая поступательное, колебательное и
- 25. U = G + Wсв Свободная энергия (G) – та часть внутренней энергии, которая может быть
- 26. Первое начало термодинамики термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт
- 27. Невозможно построить такую машину, которая, совершая произвольное число раз один и тот же циклический процесс, приводила
- 28. Энтальпия (Н) Q v = ΔU (1) Qp= ΔU + A (2), где А – работа
- 29. Энтальпия Н - энергия расширенной системы, или внутреннее теплосодержание системы Для экзотермических реакций Q>0, ΔH Для
- 30. Количество теплоты, выделяющееся или поглощающееся в результате химической реакции, называется тепловым эффектом химической реакции. Термохимия –
- 31. Закон Гесса: Тепловой эффект химических реакций, протекающих при постоянном давлении или при постоянном объёме, не зависит
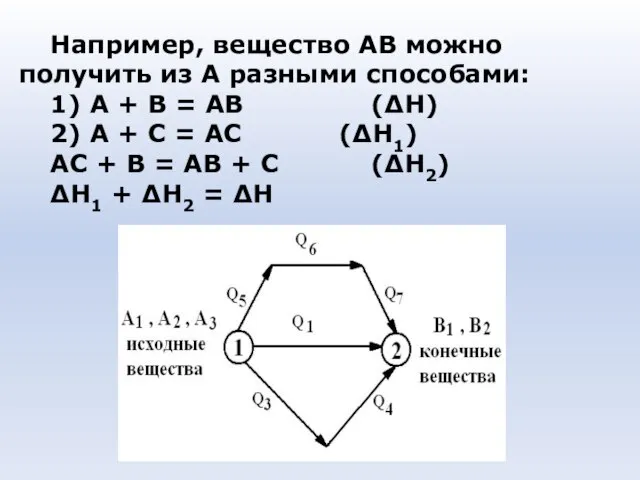
- 32. Например, вещество АВ можно получить из А разными способами: 1) А + В = АВ (ΔН)
- 33. В термодинамике принята следующая запись теплот химических реакций: С(тв)+О2(г)=СО2(г); ∆НР=-405,8 кДж в термохимии: С(тв) + О2(г)
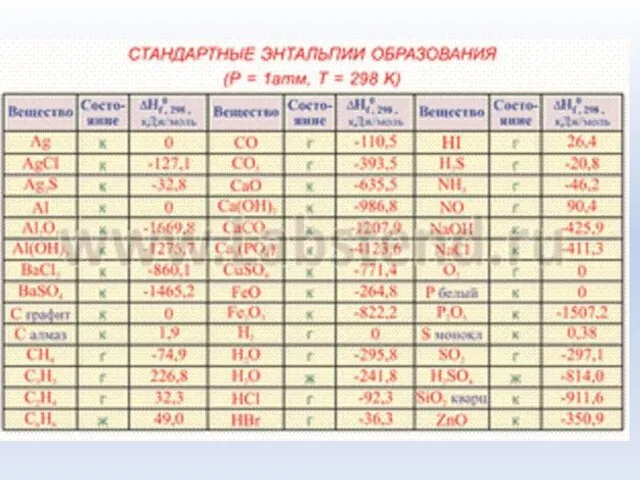
- 34. Стандартная теплота образования вещества - тепловой эффект реакции образования одного моль вещества из простых веществ в
- 36. Пример: Определить тепловой эффект реакции на основе экспериментальных данных при 0°С и давлении 1 атм. С
- 37. Первое следствие закона Гесса: Теплота реакции равна сумме теплот сгорания начальных участников реакции за вычетом суммы
- 38. Теплотой сгорания вещества называется тепловой эффект реакции сгорания его (1 моль) с образованием устойчивых продуктов (для
- 39. II следствие закона Гесса: Теплота реакции равна сумме теплот образования конечных веществ за вычетом суммы теплот
- 40. Пример: аА + bB→сС + dD ∆ HР = (с ∆Hобр(С) + d ∆Hобр(D)) – (а
- 41. NH3 PH3 AsH3 SbH3 BiH3 - 46,15 +12,56 +66,38 +145 - кДж/моль Чем меньше ΔН, тем
- 42. Второй закон термодинамики Неравновесный процесс, протекающий в направлении достижения равновесия без воздействия внешних условий, называется самопроизвольным
- 43. Второе начало термодинамики Постулат Клаузиуса Единственным результатом любой совокупности процессов не может быть переход теплоты от
- 44. Постулат Томсона Теплота наиболее холодного из участвующих в процессе тел не может служить источником работы. (Теплота
- 45. Вечный двигатель второго рода невозможен, т.е. невозможно построить такую машину, которая производила бы работу за счет
- 46. Энтропия – функция состояния термодинамической системы, используемая во втором законе т/д для выражения через нее возможности
- 47. Изменение энтропии определяется отношением количества теплоты, сообщенного системе или отведенного от нее, к температуре системы: где
- 48. Если энтропия увеличивается (S > 0), то самопроизвольный неравновесный процесс возможен, если S
- 49. Все самопроизвольные процессы в изолированных системах идут в сторону увеличения энтропии до достижения равновесия, где она
- 50. Л. Больцман (1887): высокая упорядоченность имеет относительно низкую вероятность S = k lnP где k —
- 51. Изобарно-изотермический потенциал (Свободная энергия Гиббса) ΔG = ΔH – T · ΔS где ΔH – изменение
- 52. Третье начало термодинамики В. Нернст (1906) (тепловой закон Нернста): энтропия S любой системы стремится к конечному
- 53. Всеобщий закон биологии Бауэра «Все и только живые системы никогда не бывают в равновесии и исполняют
- 54. Особенности живых организмов с позиции термодинамики 1.Живой организм – открытая система, непрерывно обменивающаяся с окружающей средой
- 55. 3. Все биохимические процессы, происходящие в клетках живых организмов, протекают при постоянной температуре, давлении, при незначительных
- 56. Главными компонентами пищи являются углеводы, жиры и белки. Калорийность, то есть энергия, выделяемая в процессе диссимиляции
- 57. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём
- 58. Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов реакции, при котором энтропия системы
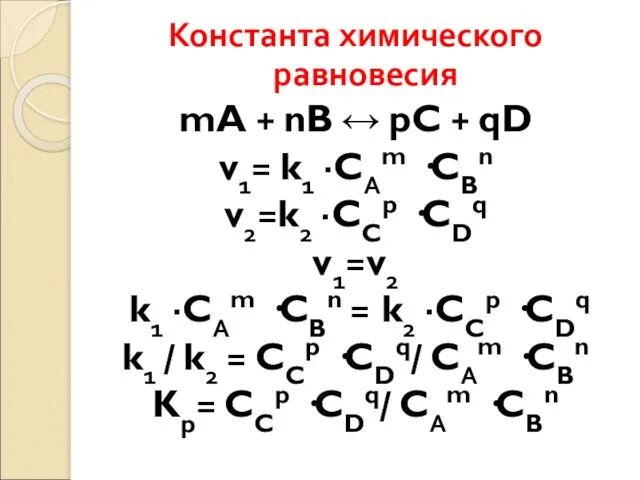
- 59. Константа химического равновесия mA + nB ↔ pC + qD v1= k1 ·CАm ·CBn v2=k2 ·CCp
- 60. Константа равновесия Кр - частное от деления произведения равновесных концентраций продуктов и исходных веществ реакции (является
- 61. Константа равновесия и энергия Гиббса. Константа химического равновесия зависит от природы реагентов, от температуры и связана
- 62. Объединяя уравнения ΔG = ΔH – T · ΔS и ΔG°= -RT lnK через величину ΔG
- 63. Смещение химического равновесия. Принцип Ле Шателье: если на систему, находящуюся в равновесии, воздействовать извне, то в
- 64. • Влияние давления. Повышение давления, согласно принципу Ле-Шателье, должно смещать равновесие в сторону образования меньшего количества
- 65. Влияние температуры на константу равновесия химической реакции выражается уравнениями изобары и изохоры Вант-Гоффа: где ΔН= QP,
- 66. II. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
- 67. ПЛАН 1. Основные понятия химической кинетики 2. Факторы, влияющие на скорость химической реакции а) Закон действующих
- 68. Химическая кинетика занимается исследованием механизмов реакций и течения их во времени
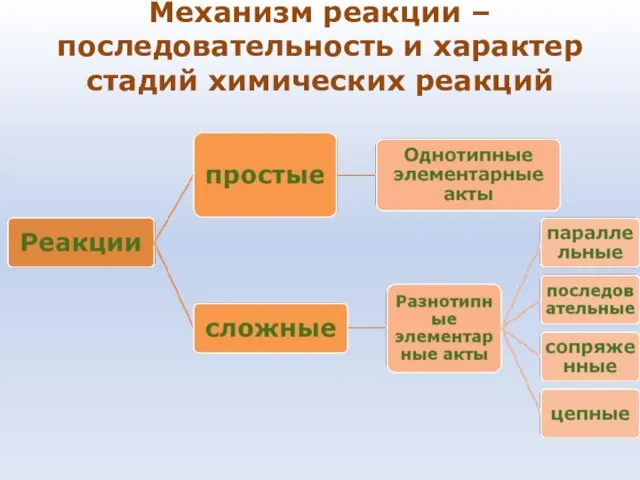
- 69. Механизм реакции – последовательность и характер стадий химических реакций
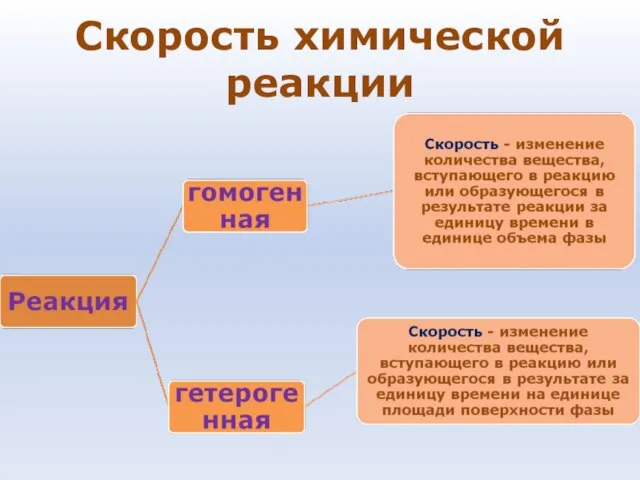
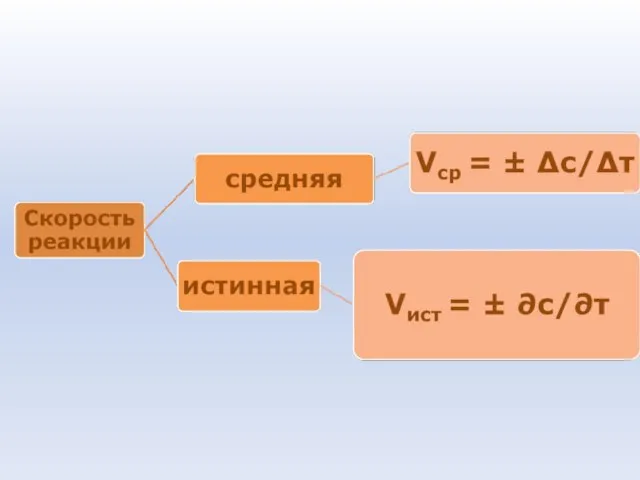
- 70. Скорость химической реакции
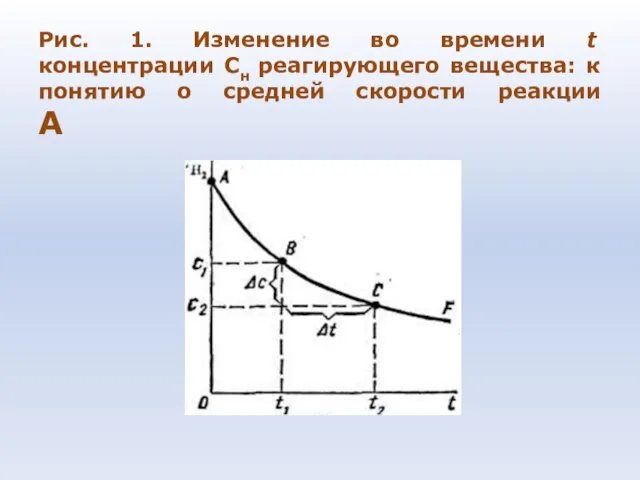
- 72. Рис. 1. Изменение во времени t концентрации Сн реагирующего вещества: к понятию о средней скорости реакции
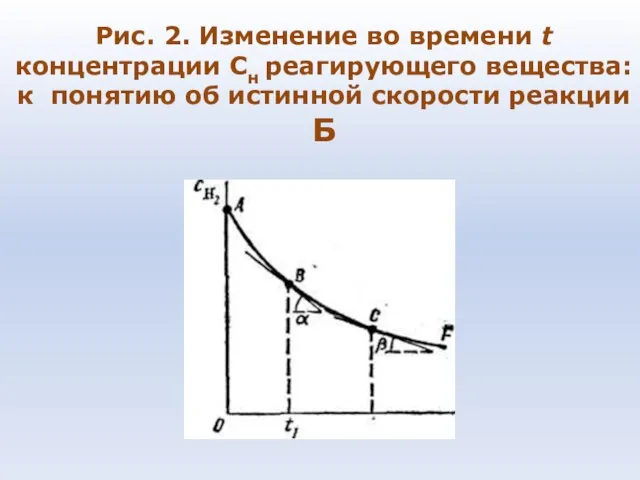
- 73. Рис. 2. Изменение во времени t концентрации Сн реагирующего вещества: к понятию об истинной скорости реакции
- 74. Факторы, влияющие на скорость химической реакции Природа реагирующих веществ Концентрация реагирующих веществ Температура Присутствие катализаторов
- 75. Закон действующих масс (К. Гульдберг и П. Вааге) при постоянной температуре скорость химической реакции прямо пропорциональна
- 76. Константа скорости k не зависит от концентраций веществ Закон действующих масс применим только к газообразным и
- 77. Молекулярность и порядок реакций Молекулярность реакции - число молекул, участвующих в элементарном акте химического взаимодействия Порядок
- 78. ПРИМЕРЫ СuО(к) + Н2 (г) = Сu (к) + Н2О (г) v=kC(H2) H2(г) + I2(г) =
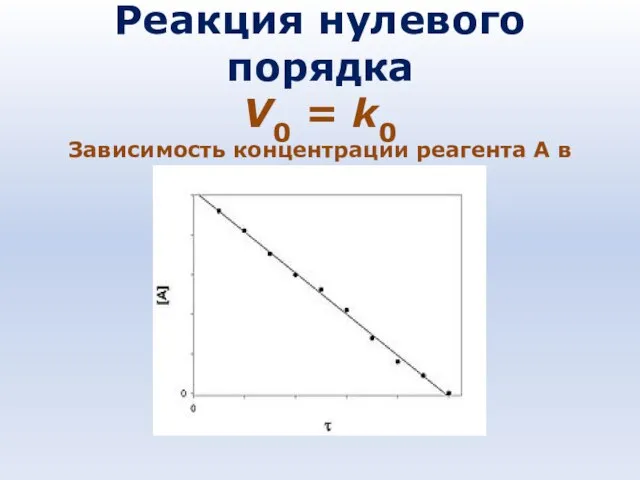
- 79. Реакция нулевого порядка V0 = k0 Зависимость концентрации реагента A в реакции A → B от
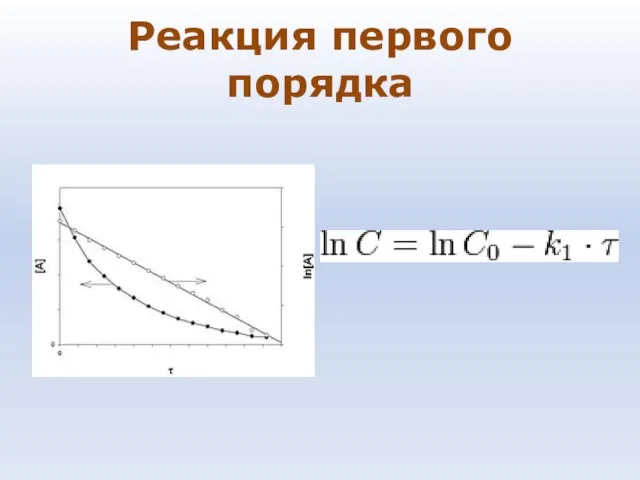
- 80. Реакция первого порядка
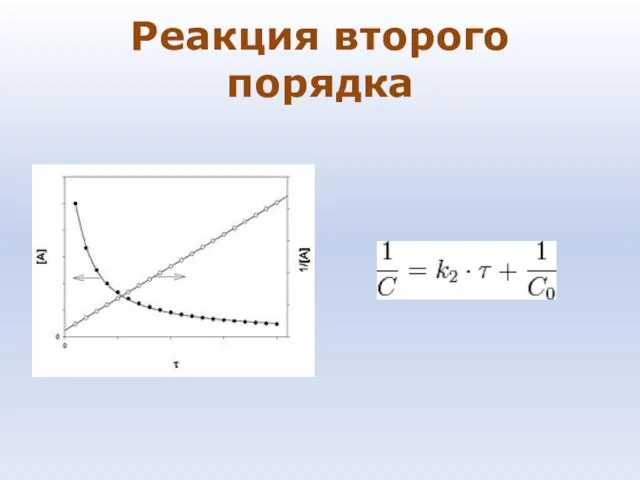
- 81. Реакция второго порядка
- 82. Время, в течение которого прореагировала половина начального количества вещества, называется временем полураспада и обозначается τ1/2. Для
- 83. Зависимость скорости реакции от температуры. Правило Вант-Гоффа при повышении температуры на каждые 10° скорость реакции увеличивается
- 84. Температурный коэффициент реакции (γ) -число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры
- 85. Уравнение Аррениуса
- 86. Энергия активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести
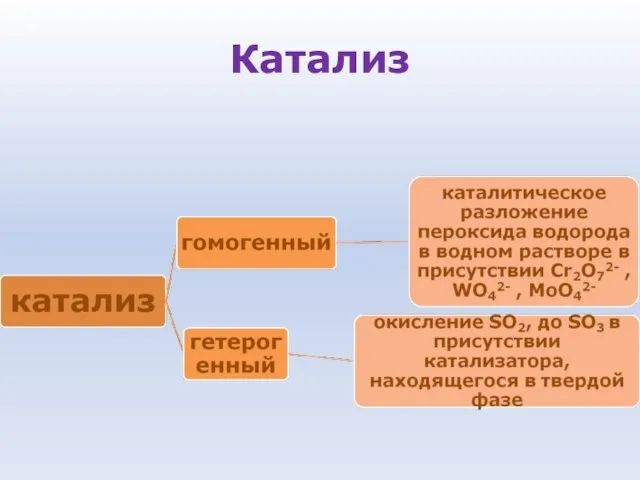
- 87. Катализ Катализ - процесс увеличения скорости реакции с помощью катализатора Катализаторы - вещества, которые увеличивают скорость
- 88. Особенности катализаторов: • Ускоряют реакцию, присутствуя в очень малых количествах • Избирательность действия, то есть катализатор
- 89. Катализ
- 90. Механизм гомогенной каталитической реакции А+В К АВ A + K = AK AK + B =
- 91. Ферменты – биологические катализаторы, ускоряющие биохимические реакции в растениях и животных организмах
- 93. Скачать презентацию
































































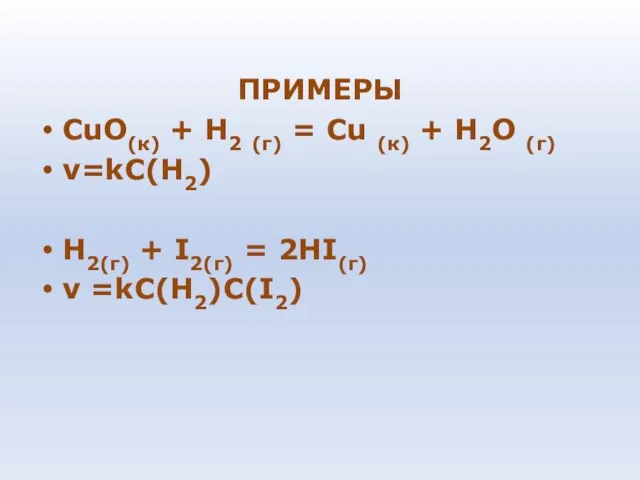









 Заведения
Заведения Генерация идей и оценка их привлекательности
Генерация идей и оценка их привлекательности Презентация на тему Cказуемые
Презентация на тему Cказуемые  Плеврит, сухой плеврит
Плеврит, сухой плеврит «Литература»
«Литература» Границы России
Границы России Презентация на тему Расчет сопротивления проводников
Презентация на тему Расчет сопротивления проводников  Программа кандидата в члены президиума студенческого совета ЭФ СПбГУ 2012 г. созыва Половозовой Натальи Андреевны
Программа кандидата в члены президиума студенческого совета ЭФ СПбГУ 2012 г. созыва Половозовой Натальи Андреевны Основы нравственного воспитания в процессе обучения по ФГОС второго поколения
Основы нравственного воспитания в процессе обучения по ФГОС второго поколения Организация проектно-исследовательской деятельности
Организация проектно-исследовательской деятельности ПСИХОЛОГИЧЕСКАЯ ПОДГОТОВКА ВЫПУСКНИКОВ К ЭКЗАМЕНАМ.
ПСИХОЛОГИЧЕСКАЯ ПОДГОТОВКА ВЫПУСКНИКОВ К ЭКЗАМЕНАМ. Стратегии приобретений компаний-поставщиков комплектующих для автомобильной промышленности
Стратегии приобретений компаний-поставщиков комплектующих для автомобильной промышленности Тест. Искусство в моём городе (селе)
Тест. Искусство в моём городе (селе) Избирательные системы
Избирательные системы Весёлый русский язык
Весёлый русский язык Шапки
Шапки Антиправительственное движение в 1901-1904 гг
Антиправительственное движение в 1901-1904 гг Альфальфа НСП Alfalfa NSP
Альфальфа НСП Alfalfa NSP Электроника. Лекция 15
Электроника. Лекция 15 Петр Великий. Российская империя.
Петр Великий. Российская империя. Маркетинговое исследование рынка шоколада факультет экономики и управления
Маркетинговое исследование рынка шоколада факультет экономики и управления Ziemas prieki
Ziemas prieki Формирование фонда капитального ремонта в МКД
Формирование фонда капитального ремонта в МКД Прогрессивное, регрессивное и пропорциональное налогообложение: сравнительная характеристика и опыт государств
Прогрессивное, регрессивное и пропорциональное налогообложение: сравнительная характеристика и опыт государств Цель:
Цель: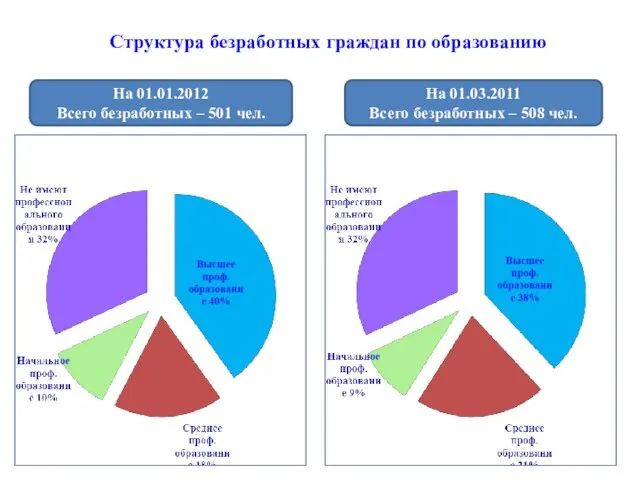 Структура безработных граждан по образованию
Структура безработных граждан по образованию Мы готовим для вас настоящие домашние торты
Мы готовим для вас настоящие домашние торты Фаина Раневская: "Чеховская героиня в советских декорациях..."
Фаина Раневская: "Чеховская героиня в советских декорациях..."