Содержание
- 2. Общие свойства ферментов и неорганических катализаторов: Катализируют только термодинамически возможные реакции. Не расходуются в процессе реакции.
- 3. Отличия ферментов от неорганических катализаторов
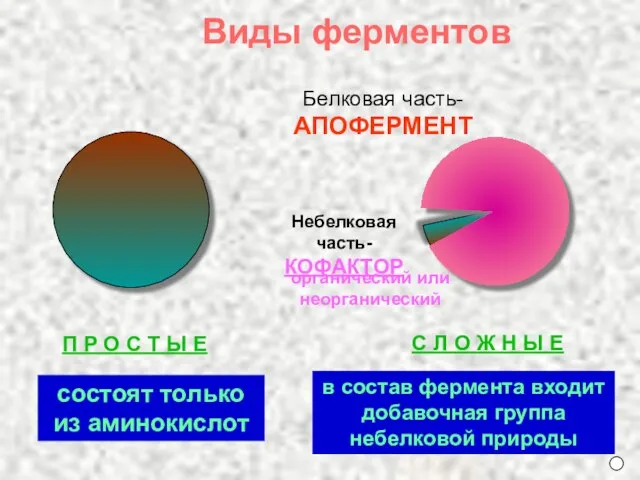
- 4. П Р О С Т Ы Е Белковая часть- АПОФЕРМЕНТ С Л О Ж Н Ы
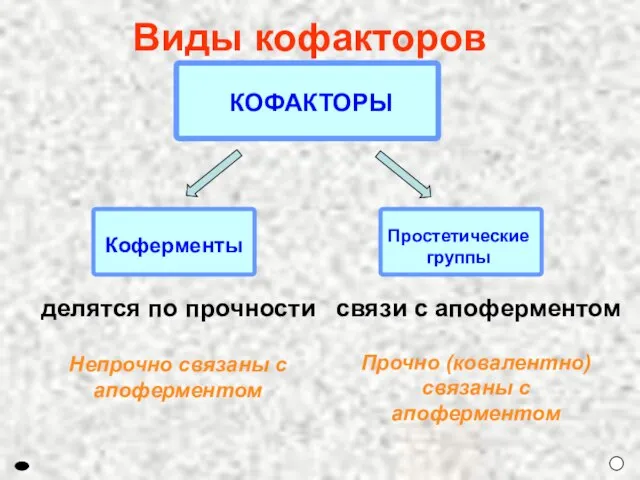
- 5. Непрочно связаны с апоферментом Прочно (ковалентно) связаны с апоферментом Виды кофакторов делятся по прочности связи с
- 6. Активный центр фермента Активный центр – это участок фермента, в котором происходит специфическое связывание субстрата и
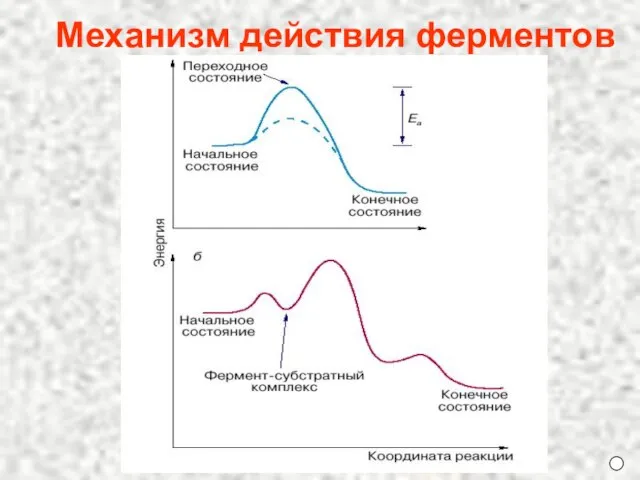
- 7. Механизм действия ферментов
- 8. Факторы, влияющие на каталитическую эффективность ферментов Сближение и ориентация реакционного центра субстрата под каталитическую группу фермента.
- 9. Факторы, влияющие на каталитическую эффективность ферментов Напряжение и деформация, как субстрата, так и фермента, приводящие к
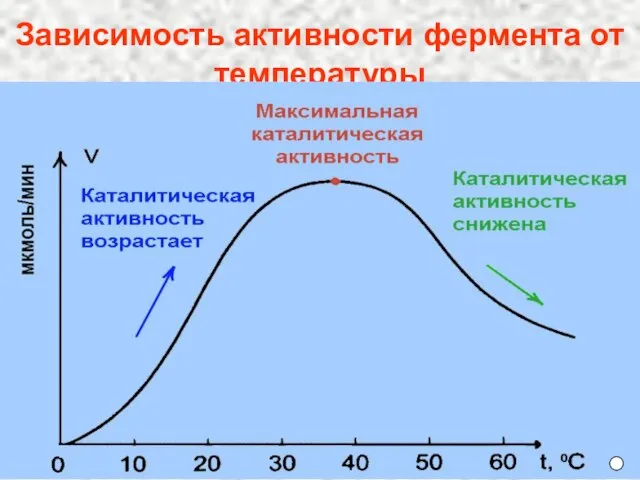
- 10. Зависимость активности фермента от температуры
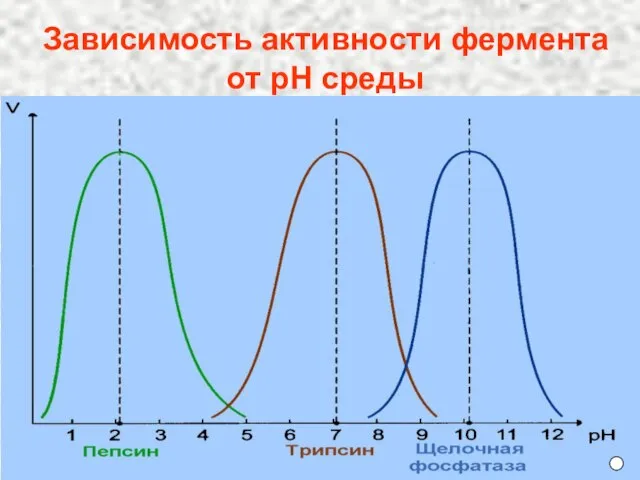
- 11. Зависимость активности фермента от рН среды
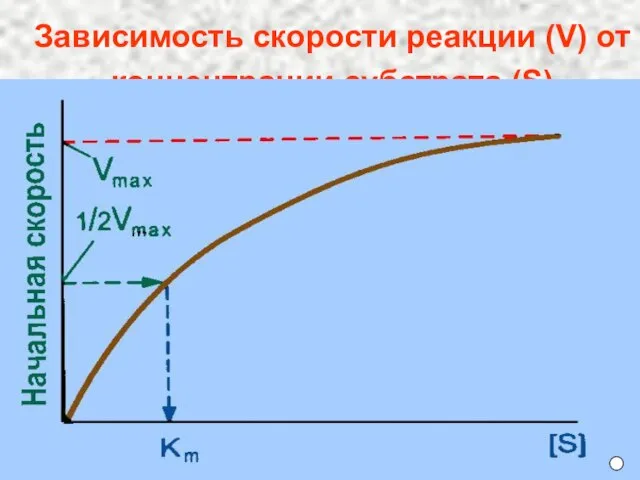
- 12. Зависимость скорости реакции (V) от концентрации субстрата (S)
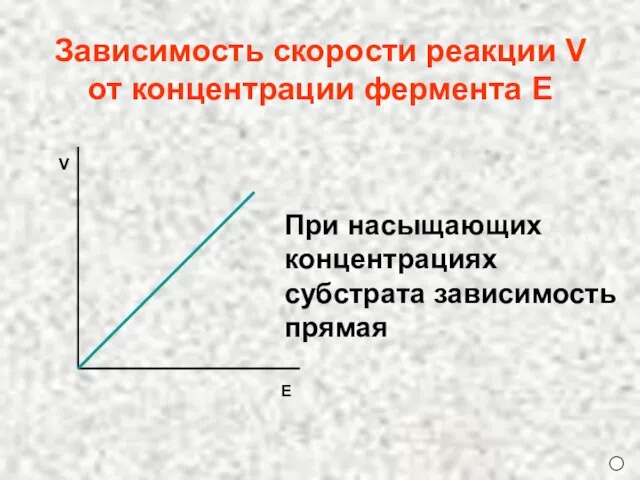
- 13. Зависимость скорости реакции V от концентрации фермента E При насыщающих концентрациях субстрата зависимость прямая V Е
- 14. Определение активности фермента Активность ферментов определяют: по скорости убывания субстрата по скорости накопления продукта
- 15. 1 катал (кат) соответствует такому количеству фермента, которое превращает 1 моль субстрата в 1 с. 1
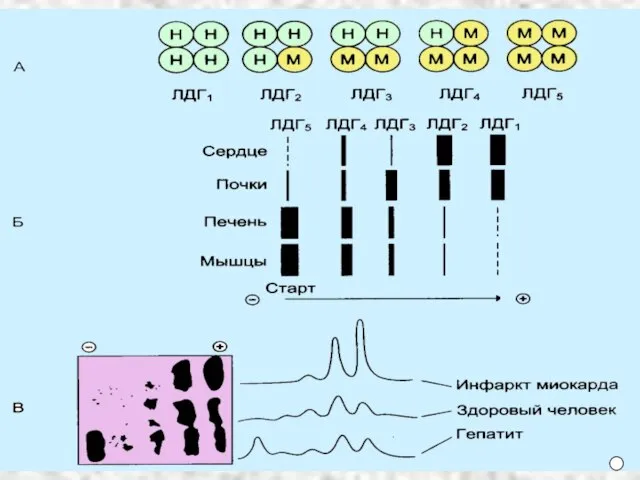
- 16. Изоферменты - это разновидности ферментов, катализирующие одну реакцию, но отличающиеся по своему составу и физико-химическим свойствам.
- 17. Изоферменты различаются 1. По кинетическим параметрам (Vмакс и Км). 2. Тканевой локализации. 3. Электрофоретической подвижности. 4.
- 19. Аллостерический механизм регуляции Регулятор действует на аллостерический центр. Аллостерический центр – это участок фермента, пространственно не
- 20. Изменение химической структуры фермента путем присоединения или отщепления за счет ковалентных связей каких-либо химических групп в
- 21. Химическая или ковалентная модификация Может осуществляться путем: - фосфорилирования - дефосфорилирования; - метилирования - деметилирования; -
- 22. Это процесс отщепления какой-либо части фермента в виде олиго- или полипептида. В результате формируется активный центр.
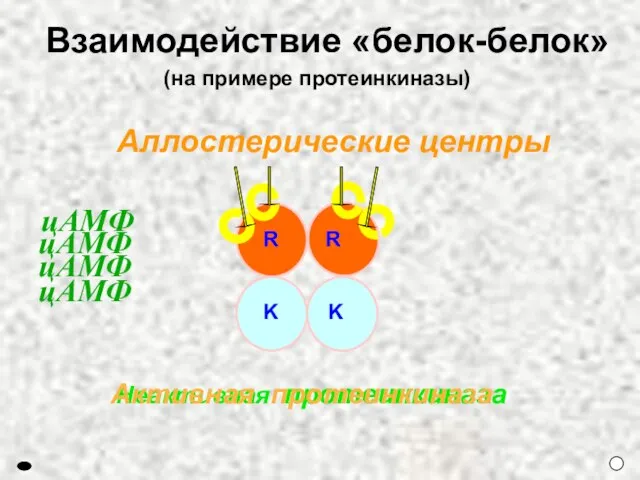
- 23. цАМФ цАМФ Неактивная протеинкиназа Аллостерические центры Взаимодействие «белок-белок» (на примере протеинкиназы) Активная протеинкиназа R R цАМФ
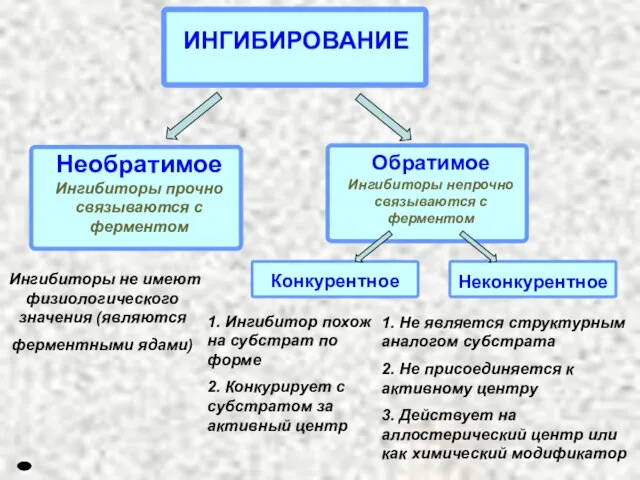
- 24. Ингибиторы не имеют физиологического значения (являются ферментными ядами) ИНГИБИРОВАНИЕ 1. Ингибитор похож на субстрат по форме
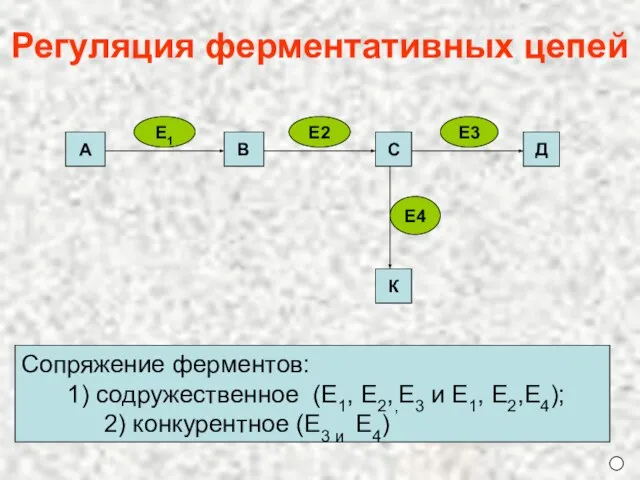
- 25. Сопряжение ферментов: 1) содружественное (Е1, Е2,,Е3 и Е1, Е2,Е4); 2) конкурентное (Е3 и Е4) Регуляция ферментативных
- 26. Ключевыми ферментами являются: а) фермент, стоящий в начале цепи; б) лимитирующий фермент (имеет наименьшую скорость в
- 27. 1. Оксидоредуктазы – катализируют окислительно- восстановительные реакции. 2. Трансферазы – катализируют реакции переноса химических групп. 3.
- 28. Значение ферментов в медицине Энзимо-патология Энзимо-диагностика Изучает значение нарушений активности ферментов в развитии заболеваний. 1. Определение
- 29. Энзимотерапия. Использование ферментов в качестве лекарств: при нарушении пищеварения (фестал, энзистал, креон, мезим-форте и другие); для
- 30. Энзимодиагностика 1. Применение ферментов для определения различных веществ в биологических жидкостях. - глюкозооксидазу используют для определения
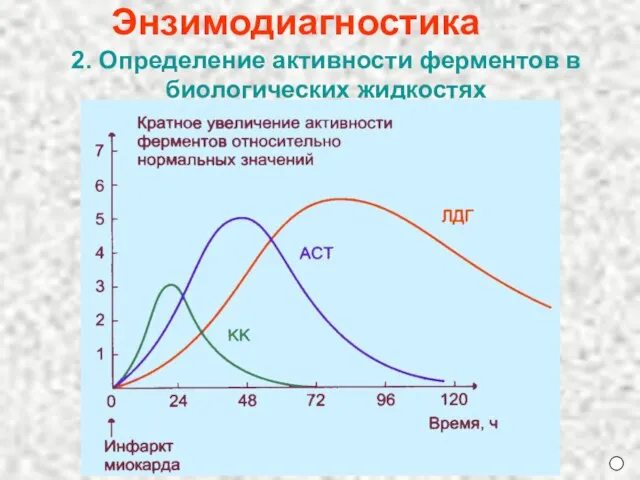
- 31. Энзимодиагностика 2. Определение активности ферментов в биологических жидкостях
- 32. Общие сведения Окисление - это отщепление от вещества электронов; восстановление - это присоединение электронов. Метаболизм -
- 33. Способы передачи электронов Fe2+ + Cu2+ → Fe3+ + Cu+ Прямой перенос электронов: Перенос электронов в
- 34. Отличия биологического окисления от окисления в неживой природе Процесс передачи водорода на кислород происходит поэтапно, через
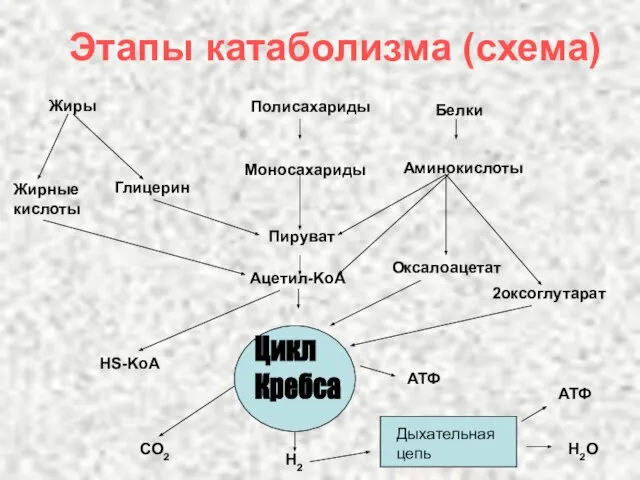
- 35. Этапы катаболизма (схема) Цикл Кребса Дыхательная цепь Жирные кислоты Жиры Полисахариды Белки Моносахариды Аминокислоты Глицерин Пируват
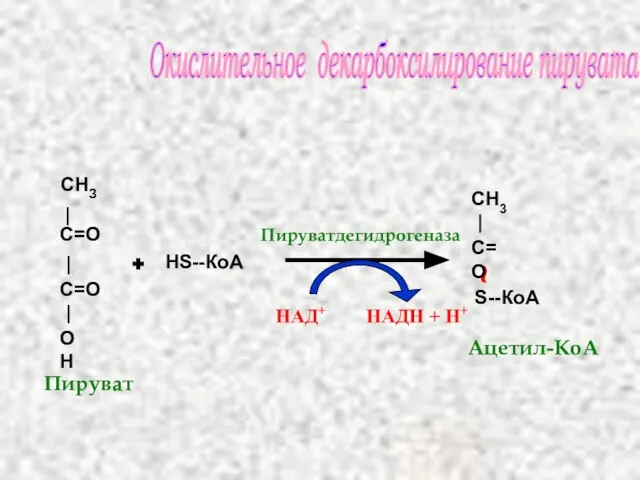
- 36. Окислительное декарбоксилирование пирувата НS--КоА НАД+ НАДН + Н+ Пируватдегидрогеназа + Ацетил-КоА Пируват
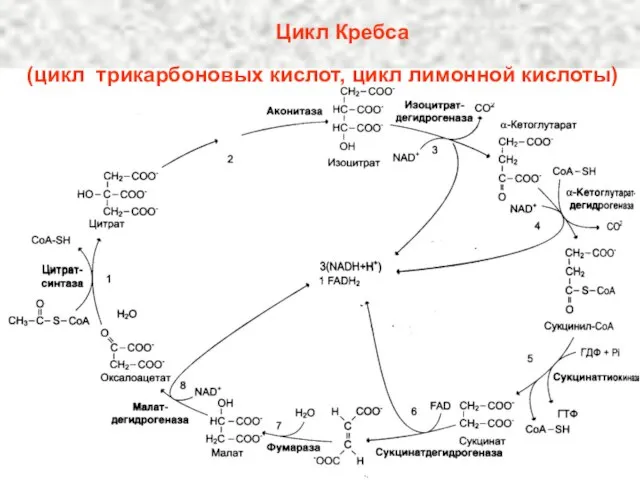
- 37. Цикл Кребса (цикл трикарбоновых кислот, цикл лимонной кислоты)
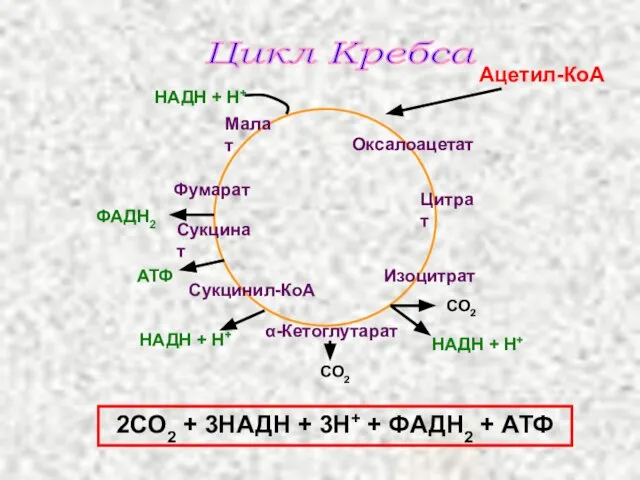
- 38. Ацетил-КоА ФАДН2 Оксалоацетат Малат Цитрат Изоцитрат α-Кетоглутарат Сукцинил-КоА Сукцинат Фумарат НАДН + Н+ АТФ НАДН +
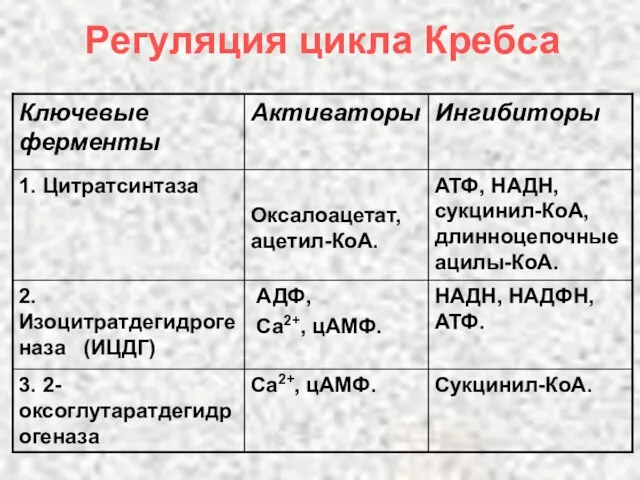
- 39. Регуляция цикла Кребса
- 40. Регуляция цикла Кребса Регуляция гормонами Активируют цикл Кребса: инсулин, катехоламины, глюкагон, йодтиронины.
- 41. Значение цикла Кребса 1. Катаболическое и энергетическое Общий заключительный этап распада всех классов органических соединений Образование
- 42. Значение цикла Кребса 3. Регуляторное (метаболиты - цитрат и АТФ - регуляторы других процессов: активируют синтез
- 43. Дыхательная цепь Дыхательная цепь (цепь переноса электронов) - это цепь сопряженных окислительно-восстановительных реакций, в ходе которых
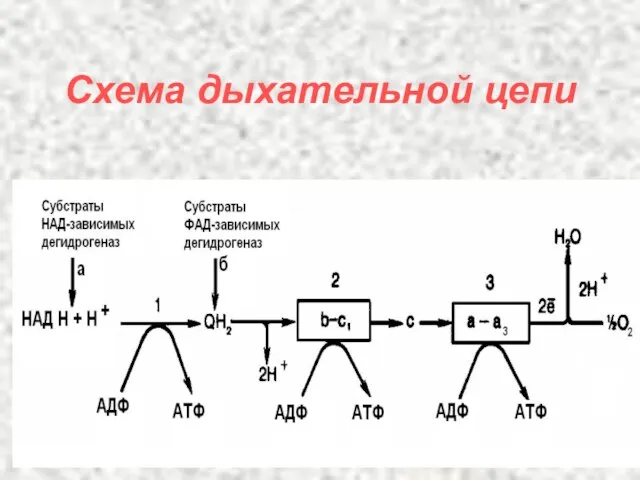
- 44. Схема дыхательной цепи
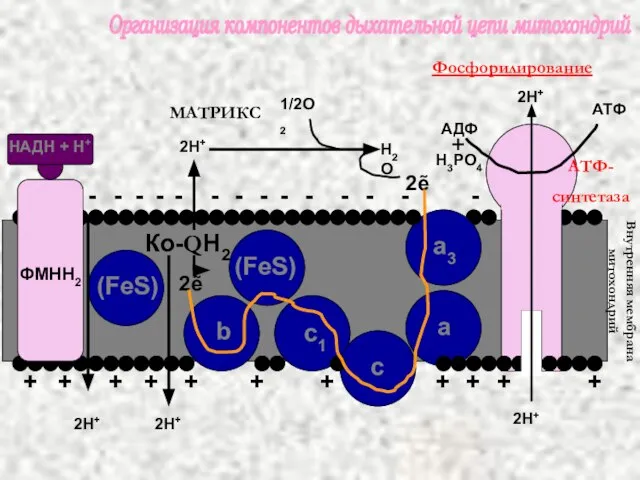
- 45. Организация компонентов дыхательной цепи митохондрий 2ẽ 1/2О2 2ẽ Н2О АТФ 2Н+ 2Н+ 2Н+ 2Н+ 2Н+ АТФ-
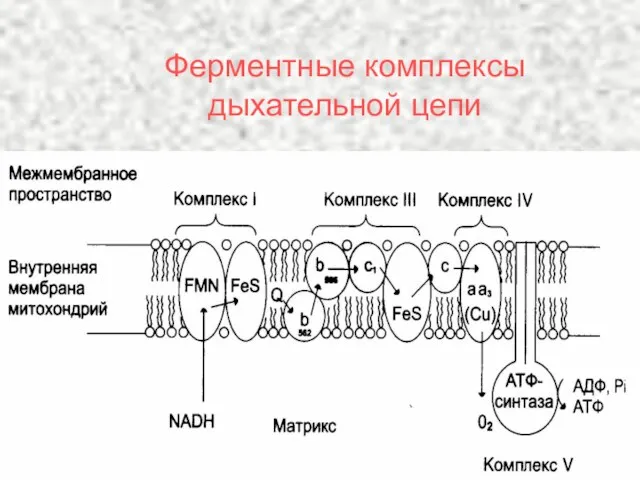
- 46. Ферментные комплексы дыхательной цепи
- 47. Пункты сопряжения окисления и фосфорилирования Синтез АТФ, сопряженный с переносом электронов по дыхательной цепи, называется окислительным
- 48. Пункты сопряжения окисления и фосфорилирования 1. между НАДН и КоQ, 2. на участке цитохромов b -
- 49. Сопряжение и разобщение в дыхательной цепи Сопряжение в дыхательной цепи - это такое состояние, когда окисление
- 50. Сопряжение и разобщение в дыхательной цепи Разобщители: 2,4-динитрофенол яды промышленного производства токсины ионофоры жирные кислоты (естественные
- 51. Регуляция дыхательной цепи АДФ стимулирует работу дыхательной цепи. Это явление называется дыхательным контролем. АТФ тормозит работу
- 52. Блокаторы дыхательной цепи Ротенон блокирует дыхательную цепь на участке НАДН – КоQ. Амитал, антимицин - на
- 53. Нефосфорилирующее (свободное) окисление Это окисление без образования АТФ. Ферменты свободного окисления: - оксидазы, - оксигеназы, -
- 54. Значение свободного окисления: терморегуляция; образование биологически важных соединений (катехоламинов, стероидных гормонов, коллагена, активного витамина Д и
- 55. Тканевые и возрастные особенности окислительных процессов Анаэробные ткани получают энергию без кислорода. Анаэробные ткани: Скелетные мышцы,
- 57. Скачать презентацию


































 «1С:Зарплата и управление персоналом 8» Сложные вопросы учета отпусков, командировок и листов нетрудоспособности на практически
«1С:Зарплата и управление персоналом 8» Сложные вопросы учета отпусков, командировок и листов нетрудоспособности на практически Презентация на тему Профилактика алкоголизма
Презентация на тему Профилактика алкоголизма Верхнеднепровский таможенный пост
Верхнеднепровский таможенный пост Latviešu virtuve
Latviešu virtuve 198188, г. Санкт-Петербург, пр. Стачек, 72, тел.(812)924-2-925
198188, г. Санкт-Петербург, пр. Стачек, 72, тел.(812)924-2-925 Мировая Религия. Буддизм
Мировая Религия. Буддизм Психология формирования ученического коллектива
Психология формирования ученического коллектива Особенности организации губок
Особенности организации губок Чары. Секретный день…
Чары. Секретный день… Ю Е К О И Ь Н Я Р ЮОИЕЯ КНР Ь Ю Е К О И Ь Н Я Р.
Ю Е К О И Ь Н Я Р ЮОИЕЯ КНР Ь Ю Е К О И Ь Н Я Р. ФОРМИРОВАНИЕКОММУНИКАТИВНОЙ КОМПЕТЕНТНОСТИ УЧАЩИХСЯ НА УРОКАХ ИНОСТРАННОГО ЯЗЫКА
ФОРМИРОВАНИЕКОММУНИКАТИВНОЙ КОМПЕТЕНТНОСТИ УЧАЩИХСЯ НА УРОКАХ ИНОСТРАННОГО ЯЗЫКА Инвестиционный проект. Аспекты анализа инвестиционных проектов. Жизненный цикл проекта. Принципы анализа проектов.
Инвестиционный проект. Аспекты анализа инвестиционных проектов. Жизненный цикл проекта. Принципы анализа проектов. Ночь искусств
Ночь искусств Вольная борьба, специфика, методы, направления
Вольная борьба, специфика, методы, направления Программное обеспечение для ювелирной отрасли
Программное обеспечение для ювелирной отрасли РЕГИОНАЛЬНАЯ ГЕОГРАФИЯ
РЕГИОНАЛЬНАЯ ГЕОГРАФИЯ Техника безопасности на уроках гимнастики
Техника безопасности на уроках гимнастики Якутские охотничьи традиции и обряды
Якутские охотничьи традиции и обряды Родительское собрание в дистанционном режиме: итоги психолого-педагогической работы в группе
Родительское собрание в дистанционном режиме: итоги психолого-педагогической работы в группе Газбен улану
Газбен улану Scientific research work
Scientific research work Психология риска
Психология риска Феварин (флувоксамин) в амбулаторном лечении алкогольной зависимости, осложненной психическими расстройствами
Феварин (флувоксамин) в амбулаторном лечении алкогольной зависимости, осложненной психическими расстройствами Пространство и время в кино
Пространство и время в кино 20140130_konkurs._ugaday_stranu
20140130_konkurs._ugaday_stranu Коммерческая деятельность в розничной торговой (корпоративной) сети, пути ее развития
Коммерческая деятельность в розничной торговой (корпоративной) сети, пути ее развития Интуитивные игры. Развиваем интуицию с научным подходом
Интуитивные игры. Развиваем интуицию с научным подходом Английский фольклор
Английский фольклор