Содержание
- 2. Международная классификация ферментов КФ 1 (EC 1): Оксидоредуктазы, катализирующие окисление или восстановление. Примеры: каталаза, катализирующие окисление
- 3. Нуклеаза (EC-3) - фермент, расщепляющий нуклеиновые кислоты в живых организмах. Нуклеазы участвуют: - в переваривании нуклеиновых
- 4. Энзиматический гидролиз Экзо- и эндонкулеазы с 3’- или 5’-конца либо по середине цепи Расщепление цепи по
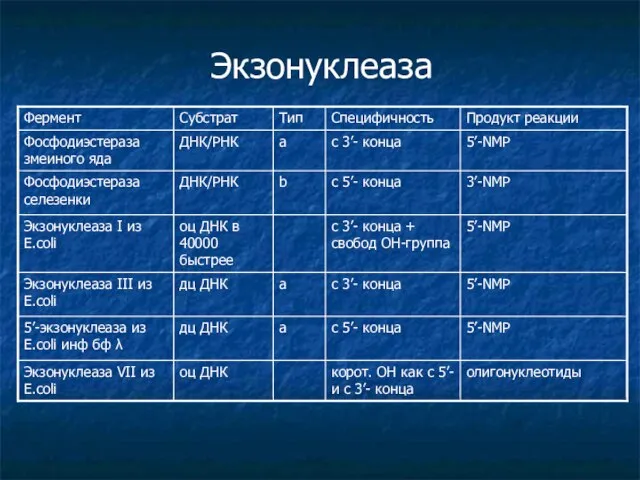
- 5. Экзонуклеаза 5’-NMP с 5’- конца a дц ДНК 5’-экзонуклеаза из E.coli инф бф λ 5’-NMP с
- 6. Эндонуклеазы
- 7. Эндонуклеазы рестрикции (рестриктазы)
- 8. В 1973 году Смит и Натанс предложили номенклатуру рестриктаз, включающую следующие пункты: 1. Аббревиатура названия каждого
- 9. Рестрикция ДНК и гель-электрофорез рестриктных фрагментов
- 10. Ферменты синтеза нуклеиновых кислот ДНК-полимераза РНК-зависимая ДНК полимераза РНК-полимераза Poly(A)-полимераза ДНК-лигаза РНК-лигаза Терминальная трансфераза Полинуклеотидкиназа Щелочная
- 11. ДНК-полимераза I (E.coli) Фермент состоит из одной полинуклеотидной цепи (мол. Масса 109 000) обладающей тремя типами
- 12. Большой фрагмент ДНК-полимераза I E.coli (фрагмент Кленова) Фермент состоит из одной полипептидной цепи (мол.масса 76000), полученной
- 13. ДНК полимераза фага Т4 (из E.coli, инфицированной фагом Т4) Подобно фрагменту Кленова ДНК-полимеразы I из E.coli.
- 14. Полинуклеотидкиназа фага Т4 Фермент катализирует перенос γ-фосфата на 5’-ОН-конец ДНК или РНК Применение Включение метки в
- 15. РНК-зависимая ДНК полимераза (обратная транскриптаза) Фермент состоит из двух полипептидов цепей, один из которых обладает и
- 16. Щелочная фосфатаза (из бактерий (BAP), из кишечника теленка (CIP)) Фермент катализирует отщепление 5’-фосфатных остатков ДНК, РНК,
- 17. Poly(A)-полимераза (E.coli) Фермент катализирует присоедиение АМР (полученных из АТР) к свободному 3’-ОН-концу РНК Применение Подготовка poly(A)-РНК
- 18. ДНК-лигаза фага Т4 Фермент состоит из одной полипептидной цепи (мол.масса 68000), катализирует образование фосфодиэфирной связи между
- 19. РНК-лигаза фага Т4 Фермент катализирует ковалентное соединение фосфорилированных по 5’-концу одноцепочечных ДНК или РНК с одноцепочечными
- 20. Терминальная дезоксинуклеотидилтрансфераза (из тимуса теленка) Фермент катализирует присоедиение дезоксинуклеотидов к 3’-ОН-концу молекулы ДНК. Применеиние Присоединение комплементарных
- 22. Скачать презентацию


















 Наземные радиостанции авиации
Наземные радиостанции авиации  Гимнастика и ОФП. 1 класс
Гимнастика и ОФП. 1 класс МЕЖДУНАРОДНАЯ АССОЦИАЦИЯ«РАЗВИВАЮЩЕЕ ОБУЧЕНИЕ»ОТКРЫТЫЙ ИНСТИТУТ«РАЗВИВАЮЩЕЕ ОБРАЗОВАНИЕ»Центр образовательного консалти
МЕЖДУНАРОДНАЯ АССОЦИАЦИЯ«РАЗВИВАЮЩЕЕ ОБУЧЕНИЕ»ОТКРЫТЫЙ ИНСТИТУТ«РАЗВИВАЮЩЕЕ ОБРАЗОВАНИЕ»Центр образовательного консалти Развитие продуктивного, критического мышления за счет расширения раздела логики в школьном курсе информатики
Развитие продуктивного, критического мышления за счет расширения раздела логики в школьном курсе информатики Внимание. Урок 27-28
Внимание. Урок 27-28 Чему я научился в аэроквантуме
Чему я научился в аэроквантуме Презентация на тему Soviet School (Советская школа)
Презентация на тему Soviet School (Советская школа) Презентация на тему Музей вычислительной техники
Презентация на тему Музей вычислительной техники Механизмы поддержания популяций редких видов растений на территории Неруссо-Деснянского Полесья (на примере Dactylorhiza longifolia) Нерусс
Механизмы поддержания популяций редких видов растений на территории Неруссо-Деснянского Полесья (на примере Dactylorhiza longifolia) Нерусс Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха
Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха Живопись в России в первой половине XIX века
Живопись в России в первой половине XIX века Презентация совещание-семинар с метрологами Саратовского отделения Коблов 16.06.2021 год
Презентация совещание-семинар с метрологами Саратовского отделения Коблов 16.06.2021 год Модернизация солнечных панелей за последние 20 лет
Модернизация солнечных панелей за последние 20 лет Определение элементов градусной сетки на глобусе и карте; географических координат по карте полушарий и физической карте России;
Определение элементов градусной сетки на глобусе и карте; географических координат по карте полушарий и физической карте России;  Введение в предпринимательское право
Введение в предпринимательское право Корень. Внешнее и внутреннее строение корня
Корень. Внешнее и внутреннее строение корня Теория организации А.А. Богданова
Теория организации А.А. Богданова Тепломассообмен 13
Тепломассообмен 13 Это были тридцатые - время "Великой депрессии"! Америка, гангстеры, постоянные перестрелки на улицах, сухой закон и казино! Джентльм
Это были тридцатые - время "Великой депрессии"! Америка, гангстеры, постоянные перестрелки на улицах, сухой закон и казино! Джентльм МОСКОВСКАЯ СИСТЕМА ДОБРОВОЛЬНОЙ СЕРТИФИКАЦИИ «ЭКОЛОГИЧНЫЕ ПРОДУКТЫ» ОРГАН ПО СЕРТИФИКАЦИИ НП «МОСКОВСКИЕ ЭКОЛОГИЧНЫЕ ПРОДУКТЫ»
МОСКОВСКАЯ СИСТЕМА ДОБРОВОЛЬНОЙ СЕРТИФИКАЦИИ «ЭКОЛОГИЧНЫЕ ПРОДУКТЫ» ОРГАН ПО СЕРТИФИКАЦИИ НП «МОСКОВСКИЕ ЭКОЛОГИЧНЫЕ ПРОДУКТЫ» Роль гидросферы в жизни Земли
Роль гидросферы в жизни Земли Права и свободы человека и гражданина
Права и свободы человека и гражданина Диофантовы уравнения
Диофантовы уравнения Конкурсные причёски,стрижки (3 курс)
Конкурсные причёски,стрижки (3 курс) Презентация на тему топливно-энергетические ресурсы мира
Презентация на тему топливно-энергетические ресурсы мира Презентация на тему Структура ВС РФ
Презентация на тему Структура ВС РФ  Традиции - ключ к патриотическому самосознанию
Традиции - ключ к патриотическому самосознанию Деловой этикет
Деловой этикет