Содержание
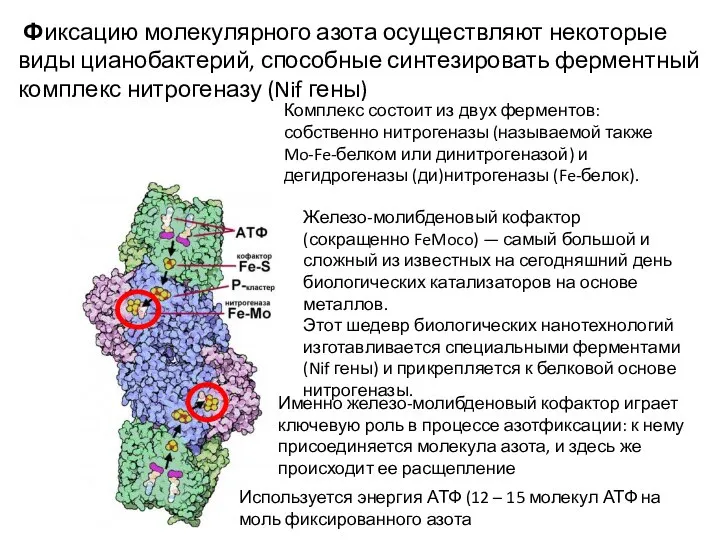
- 2. Комплекс состоит из двух ферментов: собственно нитрогеназы (называемой также Mo-Fe-белком или динитрогеназой) и дегидрогеназы (ди)нитрогеназы (Fe-белок).
- 3. Новые данные (на основе молекулярно-генетических методов): Процесс азотфиксации «стартовал» по крайней мере 3–3,5 млрд лет назад,
- 4. Гетероцисты – результат клеточной дифференциации. Дезактивация ФС2: хл-белковые комплексы и компоненты ФС2 разрушаются (активность ФС1 сохраняется);
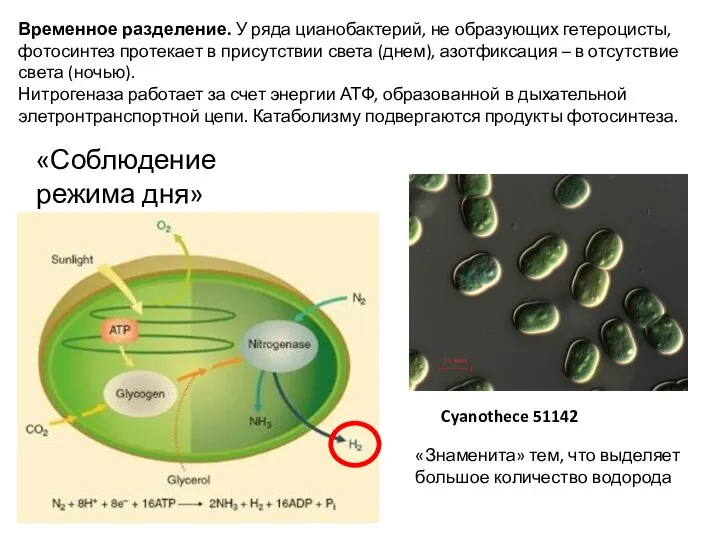
- 5. Cyanothece 51142 Временное разделение. У ряда цианобактерий, не образующих гетероцисты, фотосинтез протекает в присутствии света (днем),
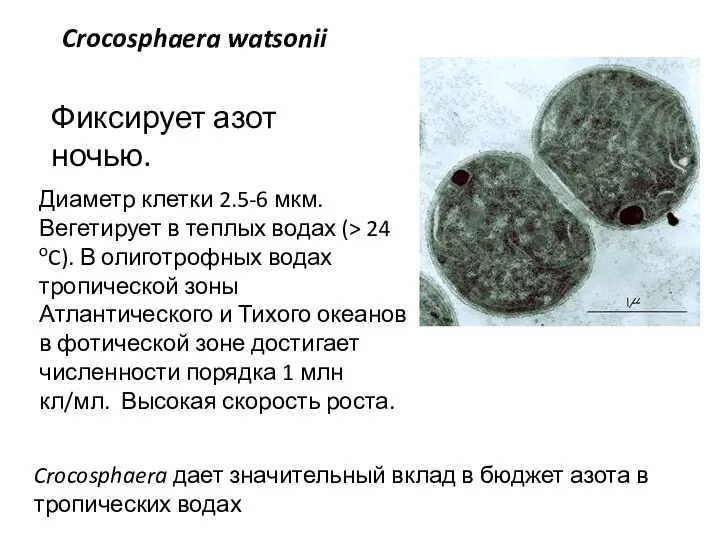
- 6. Диаметр клетки 2.5-6 мкм. Вегетирует в теплых водах (> 24 оC). В олиготрофных водах тропической зоны
- 7. Trichodesmium spp. Цианобактерии Trichodesmium фиксируют азот ТОЛЬКО на свету и при этом у них НЕТ гетероцист
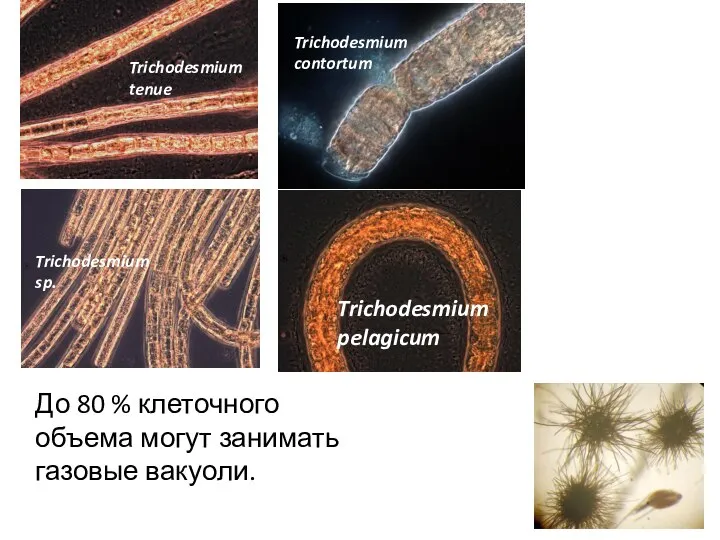
- 8. Trichodesmium tenue Trichodesmium sp. Trichodesmium contortum Trichodesmium pelagicum До 80 % клеточного объема могут занимать газовые
- 9. Как же осуществляется защита нитрогеназ от фотосинтетически выделяемого кислорода у Trichodesmium? Как экспрессия Nif генов, так
- 10. Разделение азотфиксации и фотосинтеза в пространстве у Trichodesmium Окраска специфическим красителем Nif белков Фиксация азота идет
- 11. Разделение азотфиксации и фотосинтеза во времени у Trichodesmium Суточный ритм регулирует транскрипцию nif генов, синтез de
- 12. Способность к фиксации СО2 также снижается в диазоцитах Trichodesmium во время полуденной депрессии, при этом возрастает
- 13. Механизмы предотвращения блокировки нитрогеназ фотосинтетически выделяемым кислородом, ПРЕДПОЛОЖИТЕЛЬНО, также включают: тетразол Формирование в диазоцитах восстановленных зон
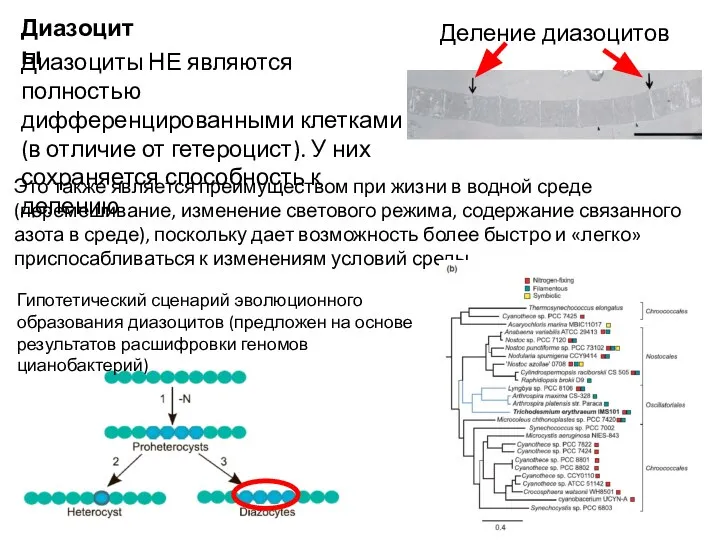
- 14. Гипотетический сценарий эволюционного образования диазоцитов (предложен на основе результатов расшифровки геномов цианобактерий) Диазоциты Диазоциты НЕ являются
- 15. Дальнейшая ассимиляция глутамата, образованного при азотфиксации, происходит в глутаминсинтетазо - глутамин оксоглутарат аминотрансферазном (ГС-ГОГАТ) метаболитном цикле
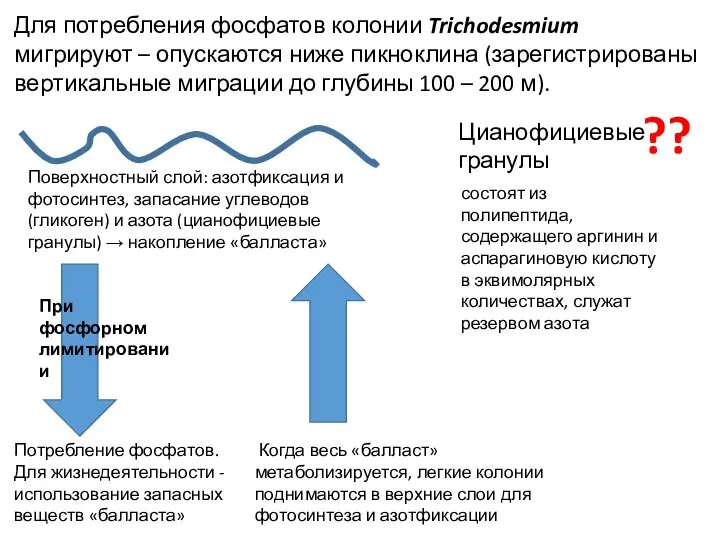
- 16. Для потребления фосфатов колонии Trichodesmium мигрируют – опускаются ниже пикноклина (зарегистрированы вертикальные миграции до глубины 100
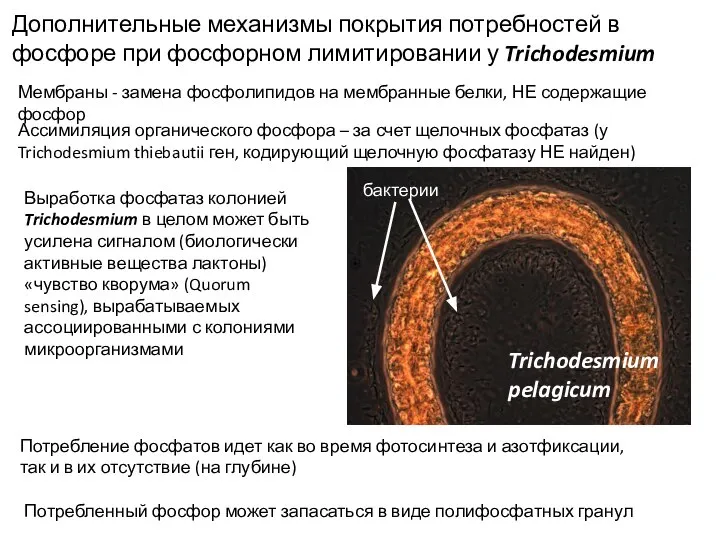
- 17. Дополнительные механизмы покрытия потребностей в фосфоре при фосфорном лимитировании у Trichodesmium Мембраны - замена фосфолипидов на
- 18. Обеспечение потребностей в железе у Trichodesmium В клетках Trichodesmium высокое содержание Fe. Учитывая, что массовое развитие
- 19. Лимитирование недостатком железа ведет к снижению числа диазоцитов и скорости азофиксации А вот фотосинтетическая активность продолжает
- 20. Экосистемная роль Trichodesmium Пределы температурной толерантности для роста и азотфиксации у Trichodesmium: 20 – 34 оС,
- 21. Цветение Trichodesmium. Большой барьерный риф побережья Австралии. Снимок NASA Цветение Trichodesmium. Красное море Снимок NASA Массовое
- 22. Для цветений Trichodesmium характерно как прижизненное выделение значительно количества органического вещества, так и при отмирании клеток
- 23. Это довольно НЕОЖИДАННЫЙ результат, поскольку Trichodesmium синтезирует токсины, вызывающие гибель копепод, таких как Acartia tonsa, а
- 24. Прогнозы динамики Trichodesmium при наблюдаемом климатическом тренде Есть все основания полагать, что повышение температуры и концентрации
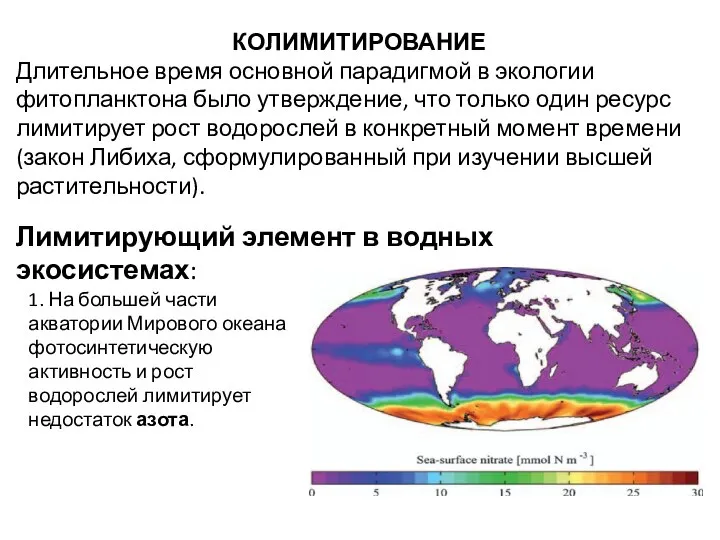
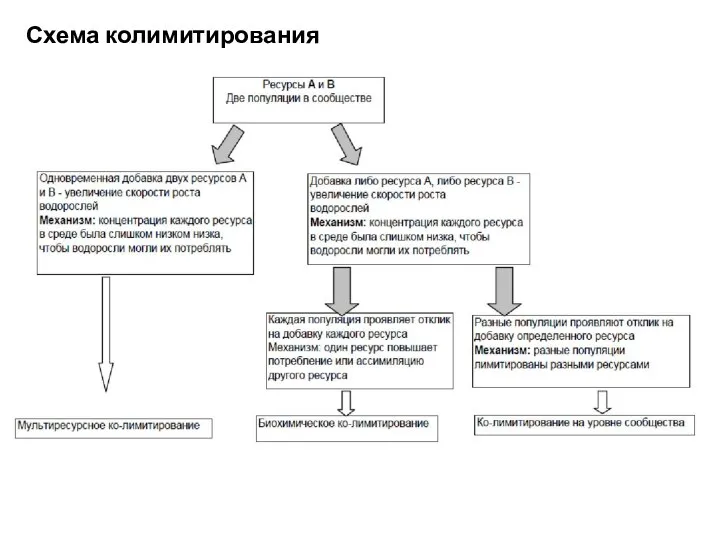
- 25. КОЛИМИТИРОВАНИЕ Длительное время основной парадигмой в экологии фитопланктона было утверждение, что только один ресурс лимитирует рост
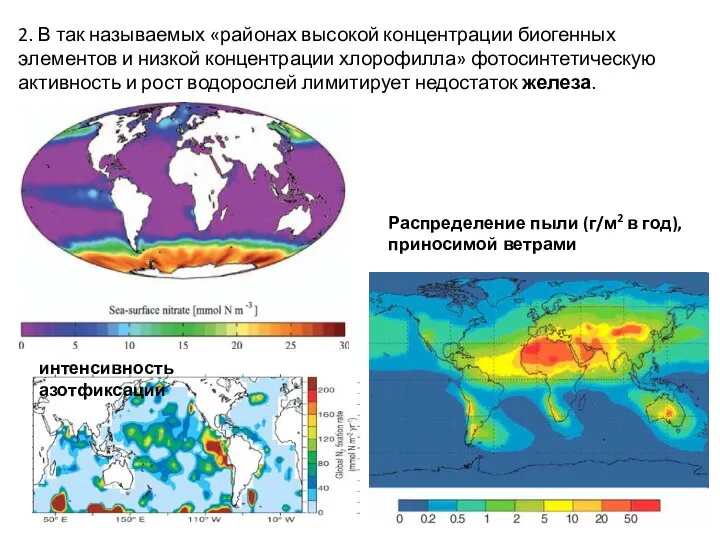
- 26. 2. В так называемых «районах высокой концентрации биогенных элементов и низкой концентрации хлорофилла» фотосинтетическую активность и
- 27. 3. В ряде районов Мирового океана (Северная Атлантика, Средиземное море, Бискайский залив, норвежские фиорды, Белое море)
- 28. Мультиресурсное ко-лимитирование. Два ресурса в такой низкой концентрации (ниже порогового уровня), что их потребление уже невозможно.
- 29. Колимитирование на уровне сообщества. Добавка ресурса А стимулирует рост одной популяции, добавка ресурса В стимулирует другую.
- 30. Схема колимитирования
- 31. На следующей лекции: Пространственно-временная изменчивость первичной продукции в Мировом океане Вопросы?
- 33. Скачать презентацию




















 Innovation measurement
Innovation measurement РАСТИТЕЛЬНЫЕ ТКАНИ
РАСТИТЕЛЬНЫЕ ТКАНИ Казачье Оренбуржье
Казачье Оренбуржье Ветхозаветная Троица Призвание Авраама
Ветхозаветная Троица Призвание Авраама Помогаем врачам соблюдать стандарты
Помогаем врачам соблюдать стандарты Проект на тему «Поэзия Василия Митты»
Проект на тему «Поэзия Василия Митты» Урок №63
Урок №63 Викторина по творчеству В. Г. Распутина
Викторина по творчеству В. Г. Распутина Экологическая тропа как средство формирования экологической культуры детей дошкольного возраста
Экологическая тропа как средство формирования экологической культуры детей дошкольного возраста «Тихая моя Родина…»
«Тихая моя Родина…» Формирование самооценки
Формирование самооценки Макрорекордер (MacroRecorder)
Макрорекордер (MacroRecorder) Метанол
Метанол Новое название СУИ
Новое название СУИ Резервы, условные обязательства и условные активы
Резервы, условные обязательства и условные активы Православие и культура
Православие и культура Здоровье - всё, но всё без здоровья - ничто
Здоровье - всё, но всё без здоровья - ничто Проект благоустройства Томилинского лесопарка
Проект благоустройства Томилинского лесопарка Поняття про програму. Запуск програми на виконання
Поняття про програму. Запуск програми на виконання 3 класс Шеварихина Н.В. МОУ лицей №3 имени академика В.М.Глушкова
3 класс Шеварихина Н.В. МОУ лицей №3 имени академика В.М.Глушкова Система права
Система права Фотоальбом. НОУ Мастерская образования
Фотоальбом. НОУ Мастерская образования Первобытное искусство. На заре человечества
Первобытное искусство. На заре человечества Презентация на тему Облака
Презентация на тему Облака  Презентация на тему Информация и её свойства
Презентация на тему Информация и её свойства Презентация на тему Животные луга
Презентация на тему Животные луга  Бермудский треугольник
Бермудский треугольник ??????????
??????????