Содержание
- 2. Основные разделы курса Химическая термодинамика Фазовое равновесие Растворы Электрохимия Кинетика химических реакций Катализ
- 3. Электростатическая теория Позволила теоретически вычислить: Средний коэффициент активности сильных электролитов γ±. Эквивалентную электрическую проводимость сильных электролитов
- 4. Правила записи реакций на электродах при электролизе Записать все теоретически возможные реакции. По величине электродного потенциала
- 5. Правила записи реакций на электродах при электролизе Щелочные и щелочно-земельные металлы (Li, Na, K, Rb, Cs,
- 6. Правила записи реакций на электродах при электролизе Все кислородсодержащие анионы (SO42-, NO3- и др.) на аноде
- 7. Правила записи реакций на электродах при электролизе Аноды из растворимых металлов (Cu, Ag, Pb, Cd, Zn,
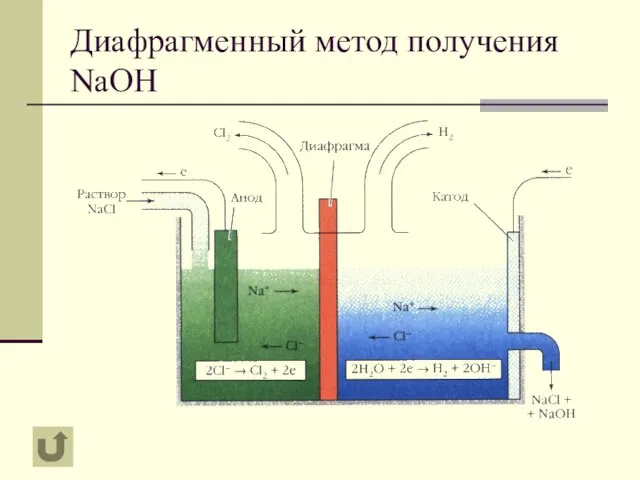
- 8. Диафрагменный метод получения NaOH
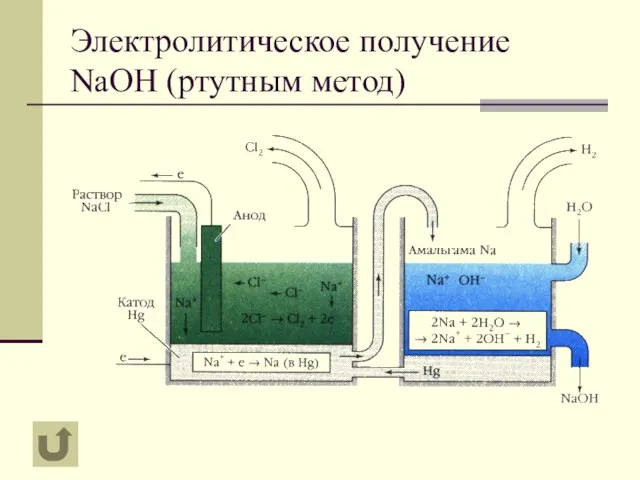
- 9. Электролитическое получение NaOH (ртутным метод)
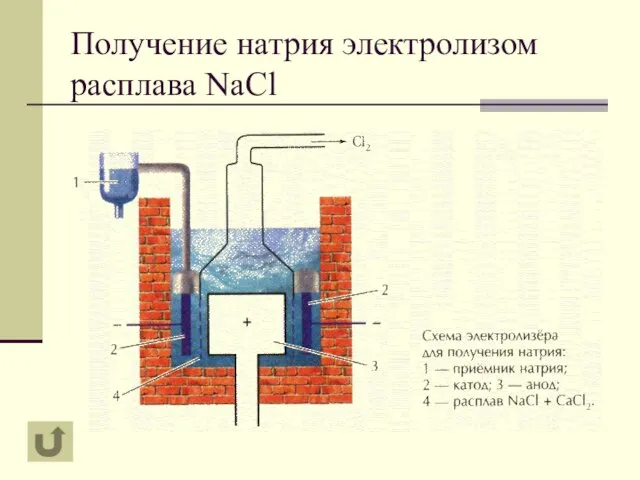
- 10. Получение натрия электролизом расплава NaCl
- 11. Типы электродов Первого рода Второго рода Газовые Амальгамные Окислительно-восстановительные
- 12. Электроды первого рода (неметаллические) Se2- | Se Se + 2е = Se2-
- 14. Скачать презентацию








 Профессия - Артист цирка. Поговорим о дрессировщиках
Профессия - Артист цирка. Поговорим о дрессировщиках Тест по творчеству Л.Н.ТолстогоЛитература 10 класс
Тест по творчеству Л.Н.ТолстогоЛитература 10 класс Великая Отечественная война в стихотворениях
Великая Отечественная война в стихотворениях Психология манипуляции
Психология манипуляции Логистический планировщик
Логистический планировщик Русские национальные виды спорта и игры
Русские национальные виды спорта и игры Проблема закона об оружии
Проблема закона об оружии Il cigno
Il cigno Австралия. Знакомство с материком 7 класс
Австралия. Знакомство с материком 7 класс The geography of the USA
The geography of the USA  Буддизм
Буддизм Грибы в Чёнках
Грибы в Чёнках Отдел по эксплуатации электросетей Ишимбая и Салавата
Отдел по эксплуатации электросетей Ишимбая и Салавата Комплексный подход кавтоматизацииЖКХ
Комплексный подход кавтоматизацииЖКХ Расчет элементов тепловой схемы ТЭС
Расчет элементов тепловой схемы ТЭС Экономическое управление бизнес-процессом диагностики состояния инфраструктуры. Выпускная аттестационная работа
Экономическое управление бизнес-процессом диагностики состояния инфраструктуры. Выпускная аттестационная работа Соловецкий монастырь
Соловецкий монастырь Заседание секции городского методического объединения учителей истории и обществознания28 марта 2006 года
Заседание секции городского методического объединения учителей истории и обществознания28 марта 2006 года SLA-ON Сервер Больше чем просто мониторинг. SLA-ON Сервер.
SLA-ON Сервер Больше чем просто мониторинг. SLA-ON Сервер. - пре- - при -
- пре- - при - Оценка рисков, связанных с реструктуризацией фирмы
Оценка рисков, связанных с реструктуризацией фирмы Коста-Рика
Коста-Рика «Проектный метод как средство социально-личностного развития дошкольника»
«Проектный метод как средство социально-личностного развития дошкольника» Классификация персональных компьютеров. Сизонов Вадим
Классификация персональных компьютеров. Сизонов Вадим 2.2. ОПРЕДЕЛЕНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ИНФОРМАЦИОННОГО ОБЩЕСТВА
2.2. ОПРЕДЕЛЕНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ИНФОРМАЦИОННОГО ОБЩЕСТВА Жизнь и деятельность Д.И.Менделеева
Жизнь и деятельность Д.И.Менделеева Управление стоимостью проекта (на основе стандарта PMI PMBOK Guide 4th Edition)
Управление стоимостью проекта (на основе стандарта PMI PMBOK Guide 4th Edition) Творчество А.С. Пушкина
Творчество А.С. Пушкина