Содержание
- 2. Международная конвенция об ЭДС и электродных потенциалах 1953 г. – Международный союз по чистой и прикладной
- 3. Возникновение напряжения в электрохимической цепи Индексы обозначают: в – вакуум, М – металл, Р – раствор.
- 4. ЭДС правильно разомкнутой электрохимической цепи не зависит от количества проводников первого рода в цепи: Е =
- 5. Механизм установления равновесного потенциала на границе раздела фаз На примере электрода первого рода: M – ze
- 6. КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
- 7. Обратимые электроды по характеру идущих на них реакций и зависимости потенциала электрода от состава раствора делятся
- 8. (MLn)z-n + ze ⇔ M + nL- (MLn)z-n = Mz+ + n L- E = E0k
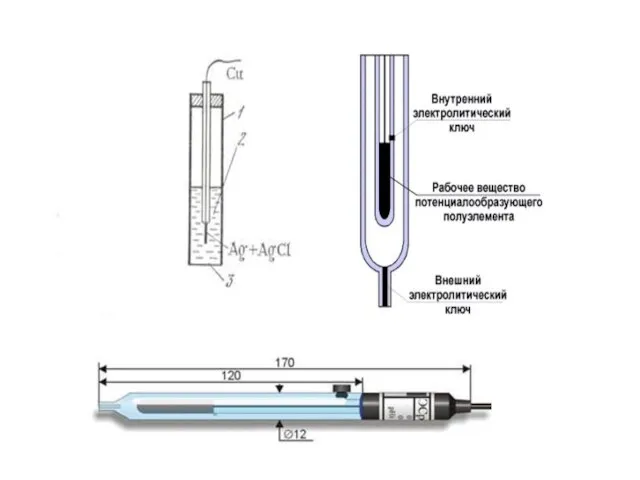
- 9. Электрод ІІ рода представляет собой металл, покрытый его труднорастворимым соединением (соль, оксид, гидроксид) и находящийся в
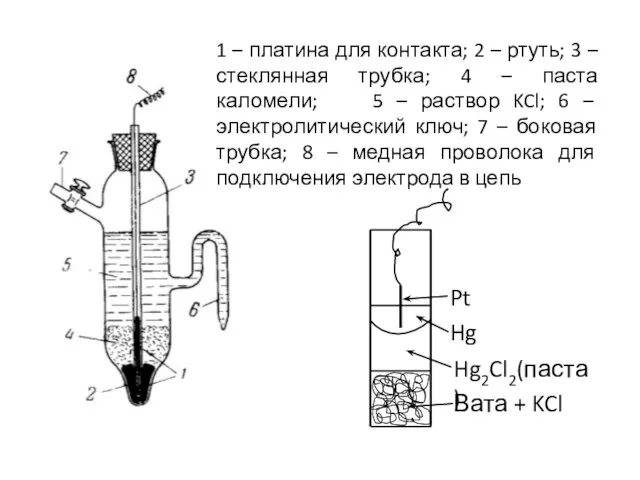
- 10. 1 – платина для контакта; 2 – ртуть; 3 – стеклянная трубка; 4 – паста каломели;
- 12. Сурьмяный электрод используется для измерения рН. Сурьмяный электрод относится к группе металлоксидных электродов, изготовлен из литой
- 13. Состояние сурьмы – плавленая, электролитически осажденая, полированная и состав оксида сурьмы оказывают влияние на поведение электрода
- 14. Электрод III рода – представляет собой металл, покрытый двумя трудно растворимыми солями, из которых первая имеет
- 16. Скачать презентацию











 7.1В_ Негативное влияние деятельности человека на экосистему_презентация
7.1В_ Негативное влияние деятельности человека на экосистему_презентация Древнейшие цивилизации
Древнейшие цивилизации Конструкция и декор предметов народного быта
Конструкция и декор предметов народного быта Почему так названы животные
Почему так названы животные «МОЯ РОДОСЛОВНАЯ»
«МОЯ РОДОСЛОВНАЯ» Порядок изменения цены контракта, корректировки
Порядок изменения цены контракта, корректировки Тема: Техногенные ЧС, возможные на территории Санкт – Петербурга. Потенциально опасные объекты, расположенные на территории субъ
Тема: Техногенные ЧС, возможные на территории Санкт – Петербурга. Потенциально опасные объекты, расположенные на территории субъ Участие прокурора в гражданском процессе по делам о защите прав и законных интересов неопределенного круга лиц
Участие прокурора в гражданском процессе по делам о защите прав и законных интересов неопределенного круга лиц The System Of State Bodies Of India
The System Of State Bodies Of India Урок 1. Где и когда ты живешь
Урок 1. Где и когда ты живешь Создание мультимедийной интерактивной презентации
Создание мультимедийной интерактивной презентации Закон на страже природы
Закон на страже природы Как открыть туристский клуб
Как открыть туристский клуб Презентация на тему Налоговые ставки: определение, виды
Презентация на тему Налоговые ставки: определение, виды  ПАМЯТНИКИ АНГЛИИ
ПАМЯТНИКИ АНГЛИИ Advanced SCP-RP
Advanced SCP-RP Флористика
Флористика Транспортные проблемы района Бирюлево-Западноеи меры по их улучшению.
Транспортные проблемы района Бирюлево-Западноеи меры по их улучшению. MarketLab’12 MarketLab’12 Интернет-маркетинг. Суть. Данность. Тренды. (куда мы движемся) киев 10 утра!
MarketLab’12 MarketLab’12 Интернет-маркетинг. Суть. Данность. Тренды. (куда мы движемся) киев 10 утра! Три клада у Природы есть:вода,Земля и воздух – три ее основы.Какая бы ни грянула беда,Целы они – все возродится снова.
Три клада у Природы есть:вода,Земля и воздух – три ее основы.Какая бы ни грянула беда,Целы они – все возродится снова. экономика батецкий
экономика батецкий ТВОРЧЕСКИЙ ОТЧЕТ
ТВОРЧЕСКИЙ ОТЧЕТ Презентация на тему Complex Object (Сложное дополнение)
Презентация на тему Complex Object (Сложное дополнение)  Рисунки Кучеровой Ксении, 13 лет
Рисунки Кучеровой Ксении, 13 лет Жидкостные предпусковые подогреватели «Теплостар»
Жидкостные предпусковые подогреватели «Теплостар» ЛОГИЧЕСКИЕ ОСНОВЫ ПК
ЛОГИЧЕСКИЕ ОСНОВЫ ПК Поступление в магистратуру
Поступление в магистратуру Занимательная информатика
Занимательная информатика