Слайд 2
Формы проявления иммунного ответа:
1) антителообразование,
2) иммунный фагоцитоз,
3) опосредованный клетками киллинг,

4) реакции гиперчувствительности,
5) формированиe иммунологической памяти,
6) формирование иммунологической толерантности.
Слайд 3 Все элементы иммунной системы реагируют на изменение гомеостаза, в зависимости от характера

антигенного воздействия одни формы становятся ведущими, а другие могут практически не проявляться. Например, при токсической инфекции в основном активируется продукция антител (антитоксины). При туберкулезной инфекции, основную роль выполняют факторы клеточного иммунитета (Т-киллеры, естественные киллеры, фагоциты) и т. д..
Слайд 4 Антитела — белки, специфически реагирующие с антигенами.
Антитела и фагоцитоз - одна

из наиболее филогенетически древних форм иммунной защиты.
Антитела (иммуноглобулины - Ig). относятся к γ-глобулиновой фракции белков сыворотки крови (15-25 % белков сыворотки крови).
Слайд 5 Антитела — это γ-глобулины, вырабатываемые в ответ на введение антигена, способные специфически

связываться с антигеном , синтезируются В-лимфоцитами и плазматическими клетками.
Циркулирующие антитела подразделяются на сывороточные и секреторные. К антителам отнесеносятся и белки Бенс-Джонса, которые являются легкими цепями молекул Ig и синтезируются при миеломной болезни.
Слайд 6 Антитела используют для:
1. диагностики
2.профилактики
3.лечения различных заболеваний,
4.выделения

и очистки биологически активных веществ.
Для этого на основе специфических иммуноглобулинов созданы соответствующие иммунобиологические препараты (лечебные и диагностические сыворотки, диагностикумы и пр.).
Слайд 7Иммуноглобулины - это гликопротеиды. Они состоят из полипептидных цепей, стабилизированных сахаридными остатками.

При нагревании выше 60 °С молекула Ig денатурируется. Иммуноглобулины различаются по структуре, атигенному составу, по выполняемым функциям.
Если молекулу Ig обработать 2-меркаптоэтанолом, то она распадется на 2 пары полипептидных цепей: две тяжёлых - Н (от англ. heavy — тяжелый) (550-660 аминокислотных остатков) и две легких - L (от англ. light — легкий) цепи(220 аминокислотных остатков). Эти цепи связаны между собой дисульфидными связями (-S-S-).
Слайд 8Строение иммуноглобулина класса G
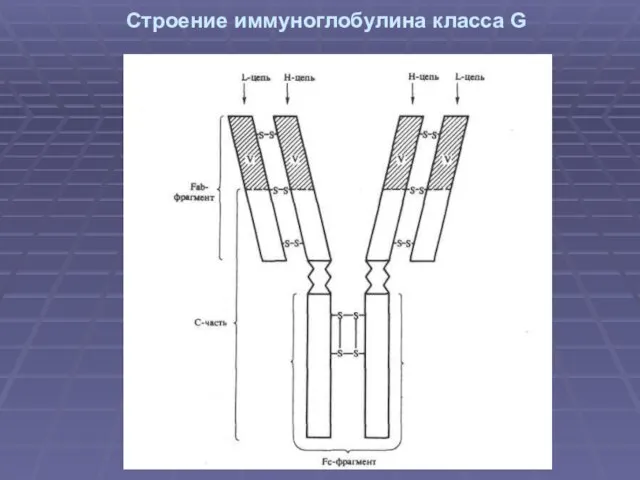
Слайд 9Между тяжелыми цепями также есть дисульфидная связь . Такой тип межпептидного соединения

позволяет менять конформацию в зависимости от окружающих условий . Шарнирный участок отвечает за взаимодействие с компонентом комплемента - С1 и его активацию .
Легкие и тяжелые цепи молекулы Ig делятся на типы, которые определяются последовательностью аминокислот. У легких цепей - κ и λ, у тяжелых цепей α, γ, μ, ε и дельта, которые имеют также и внутреннее подразделение.
Слайд 10 Отдельные участки цепи молекулы Ig свернуты в глобулы (домены). Домены стабилизированы

дисульфидной связью. В составе тяжелой цепи Ig - 4-5 доменов, а в легкой — 2. Каждый домен состоит из 110 аминокислотных остатков.
Домены различаются по постоянству аминокислотного состава. Выделяют С-домены (от англ. constant — постоянный), с постоянной структурой полипептидной цепи, и V-домены (от англ. variable— изменчивый), с переменной структурой. В составе легкой цепи есть по одному V- и С-домену, а в тяжелой — один V- и 3—4 С-домена. Изменчивость характерна только для 25 % вариабельного домена (гипервариабеная область)
Слайд 11 Вариабельные домены легкой и тяжелой цепи образуют участок, который специфически связывается с

антигеном. Это антигенсвязывающий центр молекулы Ig (паратоп).
Гипервариабельные области тяжелой и легкой цепи определяют специфичность антигенсвязываюшего центра.
Слайд 12 Обработка ферментами молекулы Ig приводит к ее гидролизу.
Папаин разрывает молекулу на

три фрагмента. Два из них способны специфически связываться с антигеном. Они состоят из цельной легкой цепи и участка тяжелой (V- и С-домен), и в их структуру входят антигенсвязываюшие участки. Это Fab фрагменты (от англ. «фрагмент, связывающийся с антигеном»).
Третий фрагмент, способный образовывать кристаллы, получил название Fc (от англ. «фрагмент кристаллизующийся»). Он ответствен за связывание с рецепторами на мембране клеток макроорганизма (Fc-рецепторы) и некоторыми микробными суперантигенами (например, белком А стафилококка). Пепсин расщепляет молекулу Ig ниже шарнирного участка и ведет к образованию 2 фрагментов: Fc и двух сочлененных Fab. или F(ab)2.
Слайд 13В зависимости от особенностей молекулярного строения тяжелой цепи различают 5 классов, или

изотипов Ig . Молекулы, содержащие тяжелую цепь α-типа, относят к изотипу А ( IgA); IgD обладает δ-пепью, IgE— ε-цепью, IgG— γ-цепью и IgM — μ-цепью. Соответственно особенностям строения подтипов тяжелых цепей различают и подклассы Ig.
Слайд 14Иммуноглобулин класса G. Изотип G составляет основную массу Ig сыворотки крови
(

70—80 %), при этом 50 % содержится в тканевой жидкости. Среднее содержание IgG в сыворотке крови взрослого человека 12 г/л. Этот уровень достигается к 7—10-летнему возрасту. Период полураспада IgG — 21 день.
IgG — мономер, имеет 2 антигенсвязывающих центра (его валентность равна 2), молекулярную массу около 160 кДа и константу седиментации 7S. Различают подтипы Gl. G2, G3 и G4. Синтезируется зрелыми В-лимфоцитами и плазматическими клетками. Максимальная концентрация в сыворотке крови на пике первичного и при вторичном иммунном ответе.
Слайд 15 IgGl и IgG3 связывают комплемент. IgG4, обладает цитофильностью (тропностью к тучным

клеткам и базофилам) и участвует в развитии аллергической реакции I типа . IgG может проявлять себя как неполное антитело.
Проникает через плацентарный барьер и обеспечивает гуморальный иммунитет новорожденного в первые 3—4 месяца жизни. Способен выделяться в секрет слизистых (молоко) путем диффузии.
IgG обеспечивает нейтрализацию, опсонизацию и маркирование антигена, осуществляет запуск комплемент-опосредованного цитолиза и антителозависимой клеточно-опосредованной цитотоксичности.
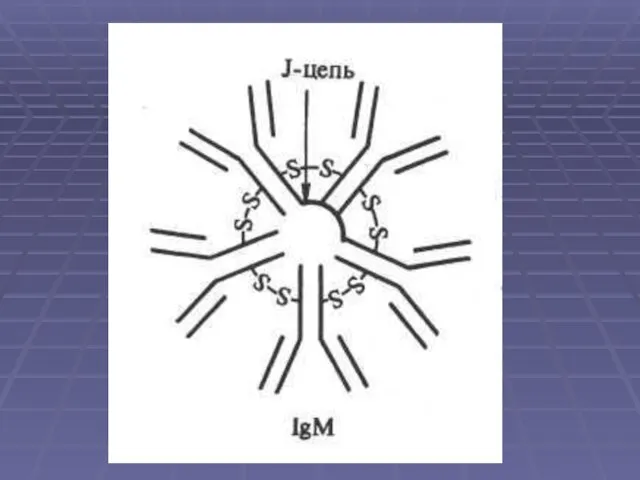
Слайд 16Иммуноглобулин класса М. Самая крупная молекула из всех Ig. Это пентамер, который

имеет 10 антигенсвязывающих центров (его валентность равна 10). Молекулярная масса - около 900 кДа. константа седиментации 19S. Различают подтипы Ml и М2. Тяжелые цепи молекулы IgM построены из 5 доменов. Период полураспада IgM — 5 дней.
Составляет около 5—10 % всех сывороточных Ig. Среднее содержание IgM в сыворотке крови взрослого человека составляет около 1 г/л. Этот уровень у человека достигается уже к 2—4-летнему возрасту.
Слайд 18IgM филогенетически наиболее древний иммуноглобулин. Синтезируется предшественниками и зрелыми В-лимфоцитами . Образуется

в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного — определяется уже на 20-й неделе внутриутробного развития.
Эффективный активатор комплемента по классическому пути. Участвует в формировании сывороточного и секреторного гуморального иммунитета. Может образовывать секреторную форму и выделяться в секрет слизистых, в том числе в молоко. Большая часть нормальных антител и изоагглютининов относится к IgM.
Слайд 19Не проходит через плаценту. Обнаружение специфических антител изотипа М в сыворотке крови

новорожденного указывает на бывшую внутриутробную инфекцию или дефект плаценты.
IgM обеспечивает нейтрализацию, опсонизацию и маркирование антигена, осуществляет запуск комплемент-опосредованного цитолиза и антителозависимой клеточно-опосредованной цитотоксичности.
Слайд 20Иммуноглобулин класса А. Существует в сывороточной и секреторной формах. Около 60 %

всех IgA содержится в секретах слизистых.
Сывороточный IgA: составляет около 10—15 % всех сывороточных Ig. В сыворотке крови здорового взрослого человека содержится около 2.5 г/л IgA, максимум достигается к 10-летнему возрасту. Период полураспада IgA — 6 дней.
IgA — мономер, имеет 2 антигенсвязываюших центра ( 2-валентный), молекулярную массу около 170 кДа и константу седиментации 7S. Различают подтипы А1 и А2. Синтезируется зрелыми В-лимфоцитами и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
Слайд 22 Может быть неполным антителом. Не связывает комплемент. Не проходит через плацентарный

барьер.
IgA обеспечивает нейтрализацию, опсонизацию и маркирование антигена, осуществляет запуск антителозависимой клеточно-опосредованной цитотоксичности.
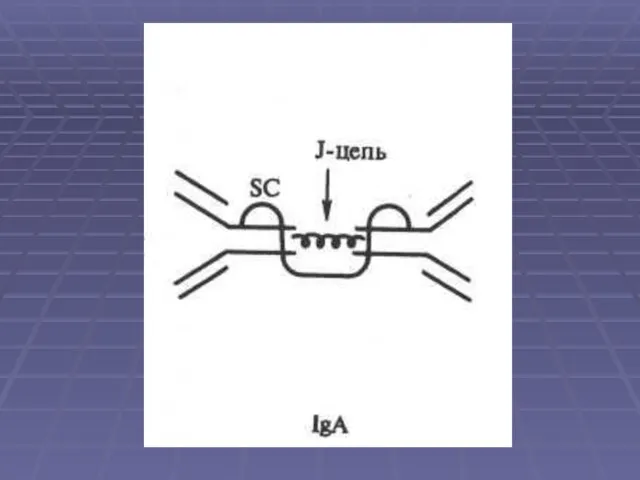
Секреторный IgA: В отличие от сывороточного, секреторный IgA (sIgA) существует в полимерной форме в виде ди- или тримера (4- или 6-валентный) и содержит J- и S-пептиды.
Слайд 23 Молекулярная масса 350 кДа и выше, константа седиментации 13S и выше.
Синтезируется В-лимфоцитами

и плазматическими клетками в пределах слизистых и выделяется в их секреты(до 5 г в сутки). Пул slgA самый многочисленный в организме — его количество превышает суммарное содержание IgM и IgG. В сыворотке крови sIgA не обнаруживается.
Слайд 24
Секреторная форма IgA — основной фактор специфического гуморального местного иммунитета слизистых оболочек

желудочно-кишечного тракта, мочеполовой системы и респираторного тракта. Устойчив к действию протеаз, не активирует комплемент, но нейтрализует антигены. Он препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых.
Слайд 25 Иммуноглобулин класса Е ( реагин). Содержание в сыворотке крови — 0,00025 г/л.

Молекулярная масса — около 190 кДа, константа седиментации — примерно 8S, мономер. Составляет около 0,002 % всех циркулирующих Ig. Этот уровень достигается к 10—15 годам жизни.
Синтезируется зрелыми В-лимфоцитами и плазматическими клетками преимущественно в лимфоидной ткани бронхов, легих и ЖКТ.
Не связывает комплемент. Не проходит через плацентарный барьер. Обладает цитофильностью Участвует в развитии гиперчувствительности немедленного типа — реакция I типа .
Слайд 26Иммуноглобулин класса D. Концентрация в сыворотке крови - 0,03 г/л (около 0,2

% от общего числа циркулирующих Ig). IgD имеет молекулярную массу 160 кДа и константу седиментации 7S, мономер.
Не связывает комплемент. Не проходит через плацентарный барьер. Является рецептором предшественников В-лимфоиитов.
Слайд 27 Рецепторные иммуноглобулины. Рецепторные, или мембраные Ig, локализуются на цитоплазматической мембране В-лимфоцитов. Выполняют

функции антигенспецифических рецепторов. Рецепторные Ig имеют те же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Структурное отличие от секретируемых антител заключается в дополнительном М-пептиде, благодаря которому молекула рецепторного Ig фиксируется в цитоплазматической мембране иммунокомпетентной клетки.
Слайд 28 Нормальные антитела. В сыворотке крови человека всегда определяется базальный уровень иммуноглобулинов, которые

получили название нормальных (естественных) антител. Это изогемагглютинины — антитела различной и специфичности направленные против эритроцитарных антигенов групп крови (система АВО), а также против бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без антигенной стимуляции. Они поддерживают готовность макроорганизма к иммунному реагированию, а могут свидетельствовать об отдаленном контакте с антигеном.
Слайд 29 Моноклональные антитела. Каждый В-лимфоцит и его потомки, образовавшиеся в результате пролиферации (т.

е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных. В природных условиях макроорганизма получить моноклональные антитела практически невозможно, т.к. на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов. Поэтому в результате иммунизации мы получаем поликлональные антитела.
Слайд 30 Получение моноклональных антител возможно, если провести селекцию антителопродуцирующих клеток и их клонирование

(т. е. выделение отдельных клонов в чистые культуры). Однако В-лимфоциты, как и другие эукариоты, имеют ограниченную продолжительность жизни и число возможных митотических делений.
Слайд 31Впервые моноклональные антитела были получены Д. Келлером и Ц. Мильштейном (1975). Они

получили гибридные клетки путем слияния иммунных В-лимфоцитов с миеломной (опухолевой) клеткой. Полученные гибриды обладали специфическими свойствами антителопродуцента и «бессмертием» раковой клетки. Эти клетки получили название гибридом. Гибридома размножается в искусственных питательных средах и в организме животных и в неограниченном количестве вырабатывает антитела. Гибридомные моноклональные антитела применяются для создания диагностических и лечебных иммунобиологических препаратов.
Слайд 32 Полные и неполные антитела.
По способности образовывать в реакции агглютинации или преципитации

(in vitro) макромолекулярную структуру иммунного комплекса Ig раделяются на полные и неполные антитела. Крупный ИК образуют полные антитела. К ним относятся полимерные молекулы Ig (изотип М), а также некоторые IgA и IgG.
Слайд 33 Неполные (непреципитирующие) антитела лишены такой способности, несмотря на то что они специфически

связываются с антигеном. Причиной этого явления может быть экранирование одного из антигенсвязывающих центров мономерной молекулы Ig и недостаточное число или малая доступность антигенных детерминант . Выявить неполные антитела можно при помоши реакции Кумбса — путем использования «вторых», антииммуноглобулиновых антител.
Слайд 34Другие виды антител. Различают тепловые и холодовые антитела. Первые взаимодействуют с антигеном

при температуре +37 °С. Для вторых наибольшая эффективность связывания проявляется в диапазоне +4... —10 °С. Понижение температуры иногда позволяет ограничить низкоаффинные взаимодействия и повысить специфичность реакции.
Слайд 35По способности активировать комплемент антитела подразделяются на комплементсвязывающие (IgM, IgGl и IgG3)

и комплементнесвязывающие.
Некоторые антитела выполняют функции катализаторов биохимических процессов . Это реликтовые свойства антител. Такие антитела называются абзимы.
Слайд 36Получены белки со свойствами антител — это одноцепочечные антитела, бифункциональные антитела и

иммунотоксины. Они синтезируются живыми биологическими системами. Одноцепочечные антитела являются фрагментом вариабельного домена Ig, обладающим специфичностью и аффинностью и способному к блокирующему действию. Размер такой молекулы очень мал и практически не обладает иммуногенностью. Бифункциональные антитела имеют антигенсвязываюшие центры разной специфичности, т. е. направлены к различным антигенным детерминантам.
Слайд 37 Иммунотоксины это гибриды иммуноглобулина и токсина. Они способны направленно доставить молекулу токсина

к клетке-мишени.
Иммунотоксины и бифункциональные антитела в перспективе будут использовать для иммунодиагностики, профилактики и лечения инфекционных, онкологических, аллергических и других заболеваний.
Слайд 38 Иммуноглобулин обладает антигеностью и выраженной иммуногенностью. В молекуле Ig различают 4 типа

атигенных детерминант:
Видовые антигенные детерминанты характерны для Ig всех особей данного вида . Они определяются строением легкой и тяжелой цепи. По этим детерминантам можно идентифицировать видовую принадлежность антител.
Изотипические антигенные детерминанты являются групповыми. Они локализуются в тяжелой цепи и служат для дифференцировки семейства Ig на 5 классов и множество подклассов .
Слайд 39Атотипические антигенные детерминанты индивидуальны. Они располагаются в легкой и тяжелой полипептидных цепях.

На основании строения аллотипических детерминант можно различать особи внутри одного вида.
Идиотипические антигеннные детерминанты отражают особенности строения антигенсвязываюшего центра самой молекулы Ig. Они образованы V-доменами легкой и тяжелой цепи молекулы Ig.
Слайд 40В процессе взаимодействия с антигеном принимает участие ограниченный участок Ig — антигенсвязывающии

центр, или паратоп.
Для антител характерна специфичность взаимодействия, т. е. способность связываться со строго определенной антигенной детерминантой.
Слайд 41 Связь антигена с антителом осуществляется за счет слабых взаимодействий (ван-дер-ваальсовы силы, водородные

связи, электростатические взаимодействия) . Образовавшийся иммунный комплекс (ИК) может диссоциировать на составляющие его компоненты.
Слайд 42
Особенности антитела - аффинность и авидность.
Аффинность — сила специфического взаимодействия антитела с

антигеном . Зависит от степени комплементарности структуры антигенсвязывающего центра и антигенной детерминанты. Чем выше их комплементарность тем выше будет устойчивость и продолжительность жизни иммунного комплекса.
Слайд 43Авидность - это прочность связывания антитела и антигена. Эта характеристика определяется аффинностью

Ig и числом антигенсвязывающих центров. При равной степени аффинности наибольшей авидностью обладают антитела класса М, так как они имеют 10 антигенсвязывающих центров.
Особенности антигена также влияют на эффективность его взаимодействия с антителом. Важное значение имеют пространственная доступность антигенной детерминанты для антигенсвязывающего центра молекулы Ig и число эпитопов в составе молекулы антигена.








































 Розы на день матери
Розы на день матери Тот, кто не знает своего прошлого, не может понять настоящее и предвидеть будущее. Н.М Карамзин
Тот, кто не знает своего прошлого, не может понять настоящее и предвидеть будущее. Н.М Карамзин Дефектология
Дефектология 10 аргументов в пользу выбора профессии в сфере туристического бизнеса и гостеприимства
10 аргументов в пользу выбора профессии в сфере туристического бизнеса и гостеприимства Многообразие птиц
Многообразие птиц Солнце – вечный огонь Вселенной. Солнечная система
Солнце – вечный огонь Вселенной. Солнечная система Эскиз сюжетной росписи кухонной доски
Эскиз сюжетной росписи кухонной доски Переход одних частей речи в другие.
Переход одних частей речи в другие. Автор: Дмитриев Александр; Карымов Савва.
Автор: Дмитриев Александр; Карымов Савва. Развитие мыслительной деятельности на уроке
Развитие мыслительной деятельности на уроке История компьютерных сетей
История компьютерных сетей Технологическая карта современного урока
Технологическая карта современного урока Роль всех литературно-художественных направлений всех эпох в развитии литературы
Роль всех литературно-художественных направлений всех эпох в развитии литературы ЖОСТОВО
ЖОСТОВО ООО Формула фасада Стиль в архитектуре
ООО Формула фасада Стиль в архитектуре Состав и польза шоколада
Состав и польза шоколада Презентация на тему Деление многозначных чисел
Презентация на тему Деление многозначных чисел Methods of Study of Nanosized Systems
Methods of Study of Nanosized Systems Цветовой круг. Цветоведение
Цветовой круг. Цветоведение Презентация в состоянии подготовки (ее надо выложить)
Презентация в состоянии подготовки (ее надо выложить) Разряды прилагательных по значеню
Разряды прилагательных по значеню МУНИЦИПАЛЬНОЕ ОБРАЗОВАНИЕ "ИКРЯНИНСКИЙ РАЙОН"
МУНИЦИПАЛЬНОЕ ОБРАЗОВАНИЕ "ИКРЯНИНСКИЙ РАЙОН" Теоретические и практические вопросы подготовки к ЕГЭ по математике
Теоретические и практические вопросы подготовки к ЕГЭ по математике Перфоративная язва
Перфоративная язва Oracle. Средства хранения данных и автоматизации деятельности предприятий.
Oracle. Средства хранения данных и автоматизации деятельности предприятий. Культура и религия
Культура и религия Методы и средства обеспечения информационной безопасности в системе 1С:Предприятие 8.1
Методы и средства обеспечения информационной безопасности в системе 1С:Предприятие 8.1 B3: Анализ программы
B3: Анализ программы