Содержание
- 2. Цель урока: Рассмотреть строение атомов галогенов их физические свойства. Изучить химические свойства галогенов.
- 3. Задачи: Образовательная: рассмотреть строение атомов галогенов. Физические свойства простых веществ. Изучить химические свойства галогенов. Развивающая: продолжить
- 4. Аннотация Из 109 химических элементов 22 являются неметаллами. Неметаллы – простые вещества при обычных условиях могут
- 5. Проблема: Блок «История» Знак химического элемента Этимология названия Год открытия, автор Блок «Физика» Знак химического элемента
- 6. Блок «Биология» Блок «Геология» Блок «Химия» Знаки химических элементов Содержание галогенов в живых организмах Значение галогенов
- 7. Этапы и сроки выполнения проекта «Мозговой штурм» (формулирование тем исследований учеников) – 1 урок, 10 минут.
- 8. Элементы главной подгруппы Yll группы ПСХЭ Название Схема атома r атома ЭО Фтор-F… +9 )2 )7
- 9. FF Cl BrBr I
- 10. Молекулы всех галогенов состоят из двух атомов F2 Cl2 Br2 J2. Связь в молекулах ковалентная неполярная
- 11. Галогены сильнейшие окислители!!! Окислительные способности усиливаются в ряду: J Br CI F Фтор самый сильный окислитель
- 12. Нахождение в природе: Фтор-F2 Флюорит -CaF2 Хлор-Cl2 каменная соль- NaCl NaCl*KCl - сильвинит Иод-J2 морская вода
- 14. Скачать презентацию











 Научно-Инновационное предприятие СКГМИ (ГТУ) "Стройкомплект-Инновации"
Научно-Инновационное предприятие СКГМИ (ГТУ) "Стройкомплект-Инновации" Скандинавский стиль
Скандинавский стиль WEB- браузеры
WEB- браузеры Биологическая безопасность и современные подходы к обеззараживанию воздуха в помещениях ЛПУ
Биологическая безопасность и современные подходы к обеззараживанию воздуха в помещениях ЛПУ Эволюционно-генетические аспекты иммунологии репродукции
Эволюционно-генетические аспекты иммунологии репродукции Подготовка к ЕГЭ Задания В1-В3 Вариант 3
Подготовка к ЕГЭ Задания В1-В3 Вариант 3 Строение тела человека
Строение тела человека Парейдолии в еде
Парейдолии в еде 1 Об итогах социально- экономического развития Сивинского муниципального района в сфере РЧП ФЦБ «РАЗВИТИЕ ЧЕЛОВЕЧЕСКОГО ПОТЕНЦИА
1 Об итогах социально- экономического развития Сивинского муниципального района в сфере РЧП ФЦБ «РАЗВИТИЕ ЧЕЛОВЕЧЕСКОГО ПОТЕНЦИА Презентация на тему Чехов "Злоумышленник" 7 класс
Презентация на тему Чехов "Злоумышленник" 7 класс Гибкие печатные платы
Гибкие печатные платы Экологические проблемы водоёмов
Экологические проблемы водоёмов Филиал ООО компания Тензор. Сфера торгов
Филиал ООО компания Тензор. Сфера торгов Сравнительная характеристика кредитных расчетов банков города Красноярска
Сравнительная характеристика кредитных расчетов банков города Красноярска ХИРУРГИЧЕСКАЯ АНАТОМИЯ КРУПНЫХ СУСТАВОВ КОНЕЧНОСТЕЙ
ХИРУРГИЧЕСКАЯ АНАТОМИЯ КРУПНЫХ СУСТАВОВ КОНЕЧНОСТЕЙ Питер Брейгель. Фламандские пословицы
Питер Брейгель. Фламандские пословицы Федеральный государственный образовательный стандарт дошкольного образования
Федеральный государственный образовательный стандарт дошкольного образования Презентация на тему Бангладеш
Презентация на тему Бангладеш  ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ
ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ Презентация на тему Здоров будешь - все добудешь
Презентация на тему Здоров будешь - все добудешь Фракталы вокруг нас
Фракталы вокруг нас Презентация на тему Ораторская речь,её особенности
Презентация на тему Ораторская речь,её особенности school
school Семейка самоцветов
Семейка самоцветов Йомаклы әлифба
Йомаклы әлифба Инвестиционные проекты, Казахстан
Инвестиционные проекты, Казахстан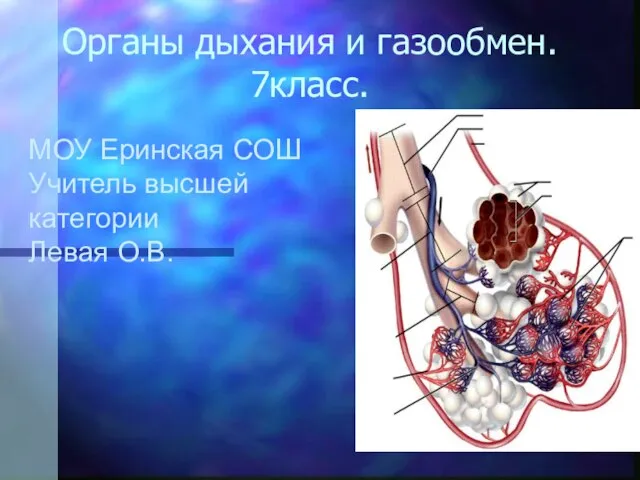 Органы дыхания и газообмен 7 класс
Органы дыхания и газообмен 7 класс Презентация на тему Новогодний сувенир в технике кистевой росписи
Презентация на тему Новогодний сувенир в технике кистевой росписи