Содержание
- 2. Что же такое ГМО? Генети́чески модифици́рованный органи́зм (ГМО) — живой организм, генотип которого был искусственно изменён
- 3. Глоссарий Генетическая инжене́рия (генная инженерия) — совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК,
- 4. Общая оценка состояния генной инженерии Научно-технический прогресс в жизни современного общества ознаменовался появлением новых научных и
- 5. Бурное развитие технологий и быстрое внедрение в практику научных достижений зачастую не подкреплено достаточно обоснованными оценками
- 6. Использование ГМО в медицинских целях Генно-инженерные организмы используются в прикладной медицине с 1982 года, когда был
- 7. Использование ГМО в сельском хозяйстве Генная инженерия используется для создания новых сортов растений, устойчивых к неблагоприятным
- 14. Другие направления использования ГМО Разрабатываются генно-инженерные бактерии, способные производить экологически чистое топливо. В 2003 году на
- 15. Где чаще всего встречаются генетически модифицированные организмы?
- 16. Проведем научный анализ рисков, связанных с широким использованием генетически модифицированных (трансгенных) организмов (ГМО) и продуктов их
- 17. Биотехнология и генная инженерия Основой современной биотехнологии является генная, или генетическая инженерия – совокупность приемов, методов
- 18. Биотехнология и генная инженерия Технология рекомбинантных ДНК использует следующие методы: специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее
- 19. Биотехнология и генная инженерия Методом генной инженерии уже получен ряд препаратов медицинского назначения, в том числе
- 20. Биотехнология и генная инженерия Начиная с 1982 г. фирмы США, Японии, Великобритании и других стран производят
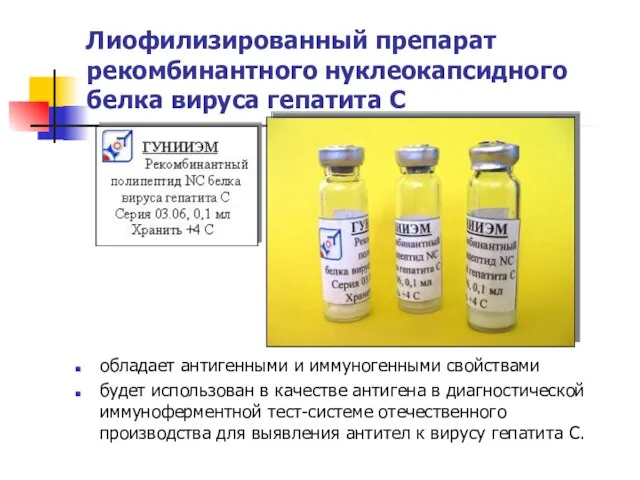
- 21. Лиофилизированный препарат рекомбинантного нуклеокапсидного белка вируса гепатита С обладает антигенными и иммуногенными свойствами будет использован в
- 22. Биотехнология и генная инженерия Технология рекомбинантных ДНК сделала возможным нетрадиционный подход "белок-ген", получивший название "обратная генетика".
- 23. Биотехнология и генная инженерия Если гибридную ДНК ввести в оплодотворенное яйцеклетку, могут быть получены трансгенные организмы,
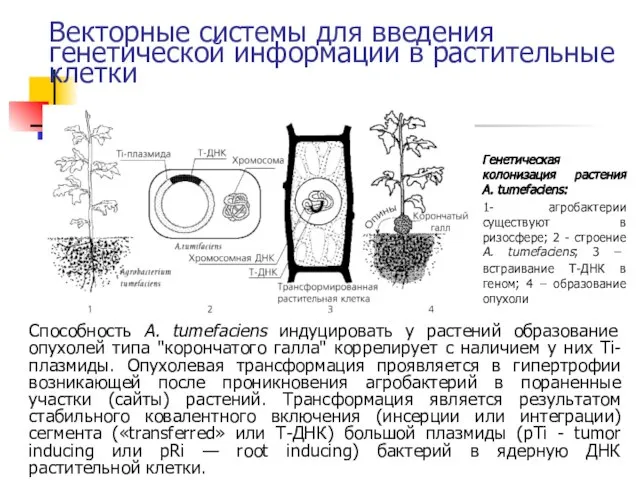
- 24. Векторные системы для введения генетической информации в растительные клетки Подробнее о введении ДНК в клетки растений
- 25. Векторные системы для введения генетической информации в растительные клетки Генетическая колонизация растения A. tumefaciens: 1- агробактерии
- 26. Векторные системы для введения генетической информации в растительные клетки Ткани корончатых галлов содержат более высокие уровни
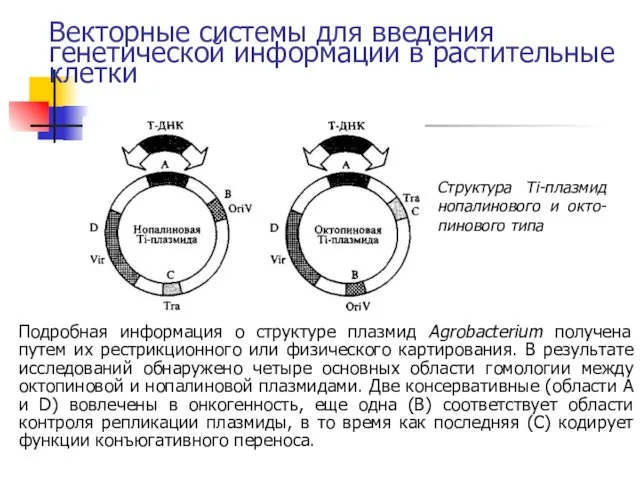
- 27. Векторные системы для введения генетической информации в растительные клетки Структура Тi-плазмид нопалинового и окто-пинового типа Подробная
- 28. Векторные системы для введения генетической информации в растительные клетки Кроме Т-ДНК в плазмидах имеются область, кодирующая
- 29. Векторные системы для введения генетической информации в растительные клетки Agrobacterium имеет очень широкий круг растений-хозяев и
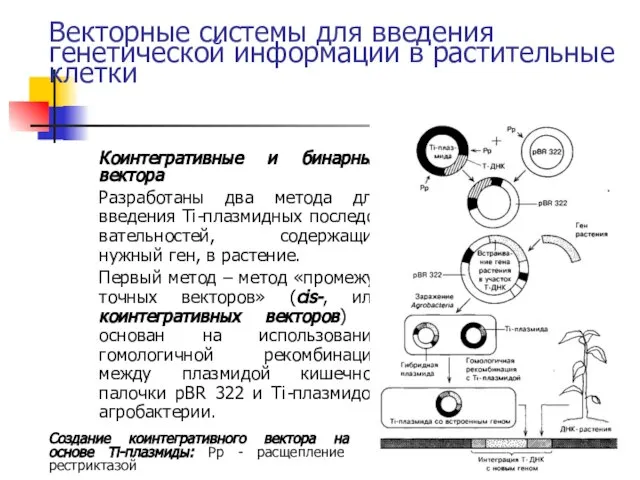
- 30. Векторные системы для введения генетической информации в растительные клетки Коинтегративные и бинарные вектора Разработаны два метода
- 31. Векторные системы для введения генетической информации в растительные клетки Т-ДНК вырезают из Ti-плазмиды с помощью рестриктаз
- 32. Векторные системы для введения генетической информации в растительные клетки Второй метод основан на создании системы trans-,
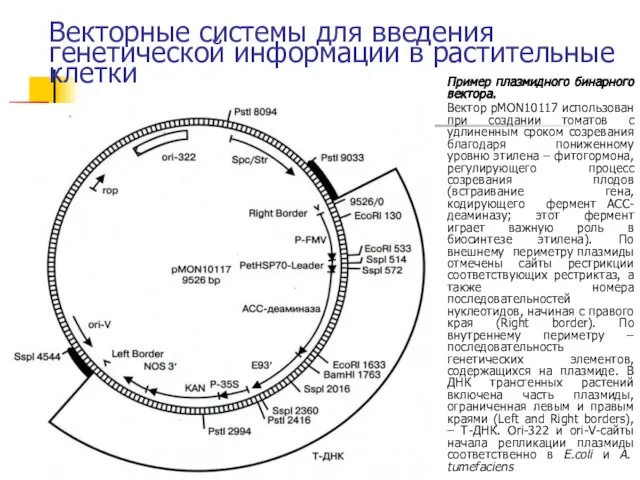
- 33. Векторные системы для введения генетической информации в растительные клетки Пример плазмидного бинарного вектора. Вектор pMON10117 использован
- 34. Векторные системы для введения генетической информации в растительные клетки После клонирования, изучения и отбора нужных нам
- 35. Векторные системы для введения генетической информации в растительные клетки При разработке бинарных векторных систем использована такая
- 36. Современные направления в создании генетически модифицированных растений Первые трансгенные растения были получены с помощью технологии рекомбинантной
- 37. Современные направления в создании генетически модифицированных растений Генетическая конструкция, вводимая в растительную клетку обычно включает: белоккодирующую
- 38. Современные направления в создании генетически модифицированных растений Минимальный промотор, связывающий РНК-полимеразу, как правило, недостаточен для обеспечения
- 39. Современные направления в создании генетически модифицированных растений Помимо конститутивных, известно большое число специфических промоторов, которые активны
- 40. Современные направления в создании генетически модифицированных растений Ввести чужеродную ДНК в растения можно различными способами. Для
- 41. Современные направления в создании генетически модифицированных растений На первом этапе осуществляется выделение трансгена из геномной ДНК
- 42. Современные направления в создании генетически модифицированных растений Агробактериальная трансформация — наиболее эффективная технология введения трансгенов в
- 43. Современные направления в создании генетически модифицированных растений Для трансформации устойчивых ("рекальцитрантных") к агробактериям растений разработаны приемы
- 44. Современные направления в создании генетически модифицированных растений Баллистическая трансфекция основана на обстреле органов и тканей микрочастицами
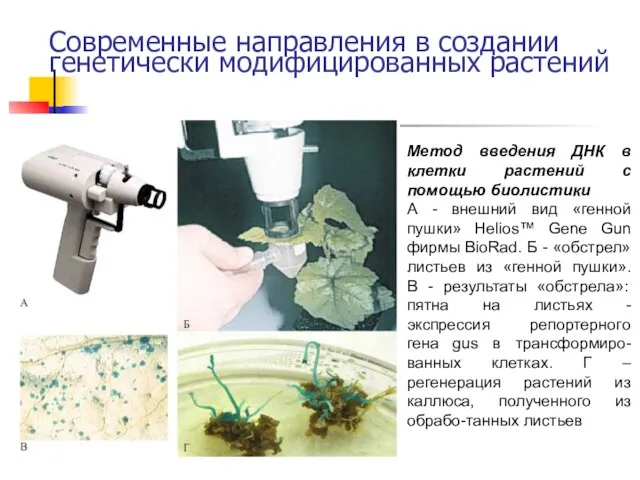
- 45. Современные направления в создании генетически модифицированных растений Метод введения ДНК в клетки растений с помощью биолистики
- 46. Современные направления в создании генетически модифицированных растений В последнее время был разработан и успешно применен также
- 47. Современные направления в создании генетически модифицированных растений Возможности генной инженерии растений: Улучшение качества запасных белков, в
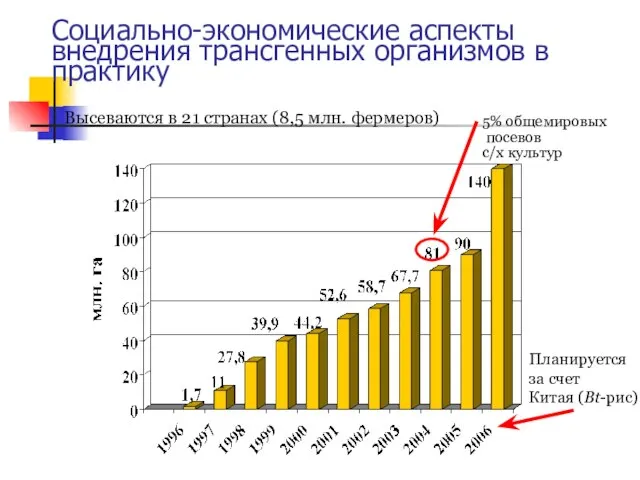
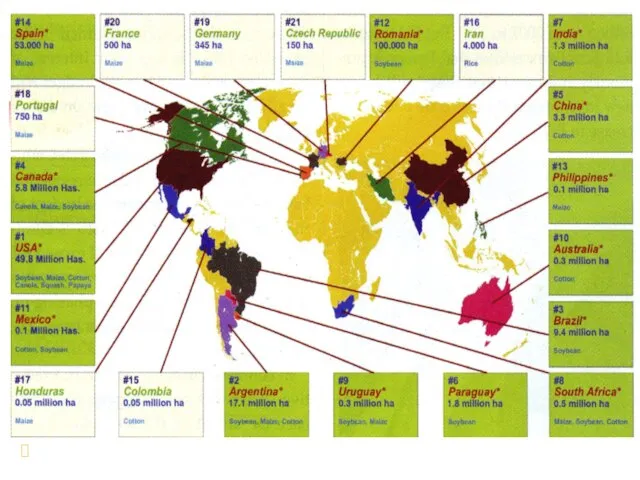
- 48. Социально-экономические аспекты внедрения трансгенных организмов в практику
- 49. Социально-экономические аспекты внедрения трансгенных организмов в практику
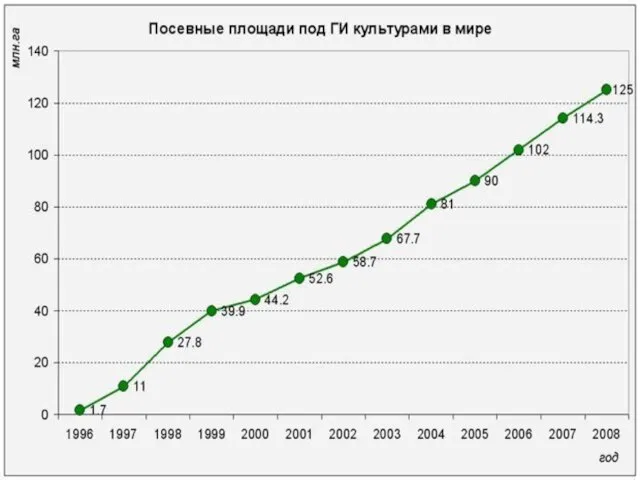
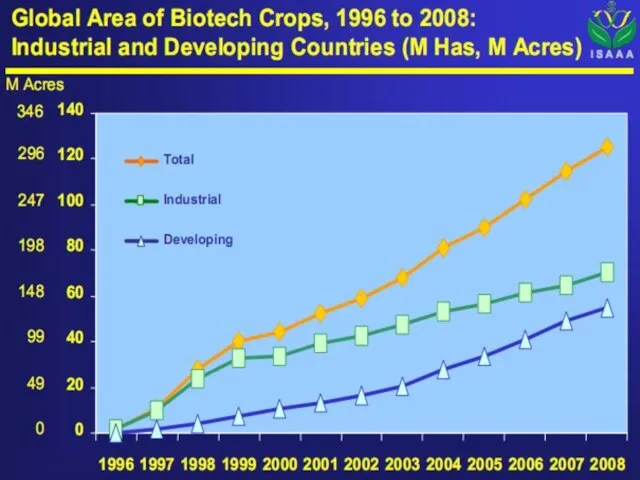
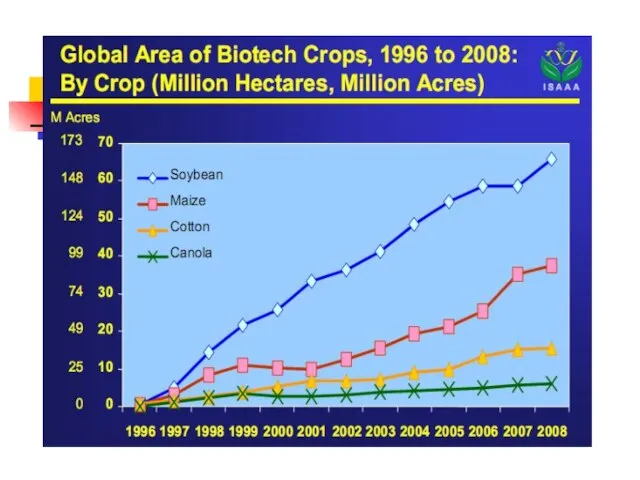
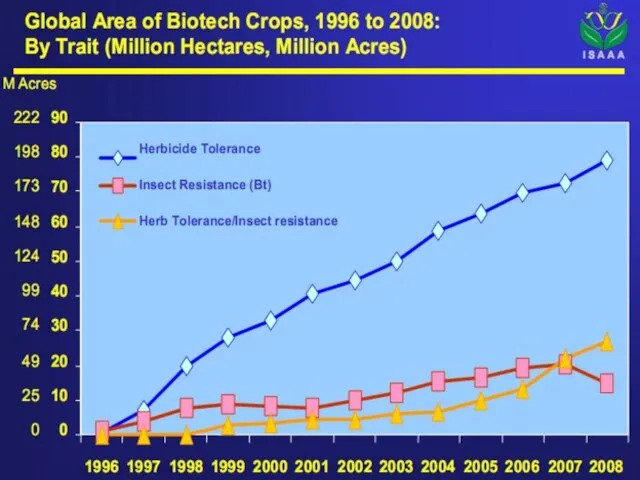
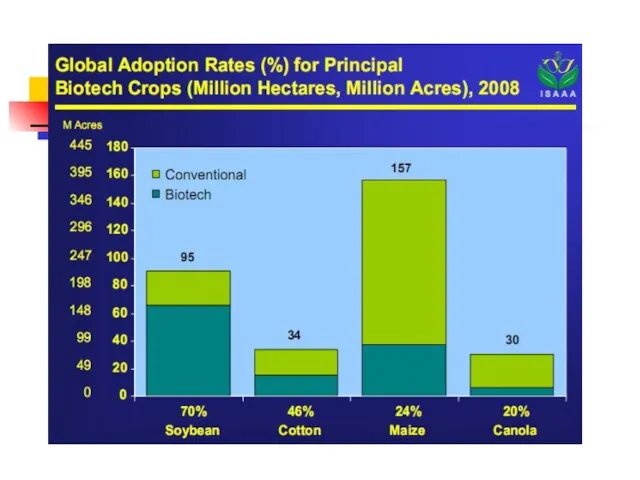
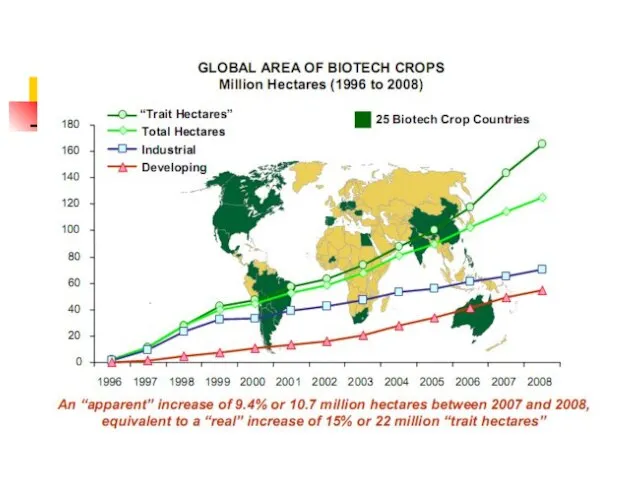
- 50. Доля сои в посевах – 55%, хлопка – 21%, рапса – 16%, кукурузы – 11%
- 51. Тенденции по использованию ГМ растений в Европе Небольшие посевные площади. Еврокомиссия одобрила посевы 17 сортов кукурузы,
- 52. Трансгенный картофель, несущий ген хитиназы Ингибирование роста патогена Fusarium oxysporum экстрактом трансгенного картофеля (В). А –
- 53. Трансгенные растения табака с введенным геном цитохрома Р450scc (CYP11A1) 1 – дикий тип, 2 – контрольное
- 54. Внешний вид контрольных и трансформированных растений Nicotiana plumbaginifolia с химерным геном апоэкворина К T0 T0 T0
- 55. Критерии и методы оценки безопасности генетически модифицированных организмов Исследование безопасности ГМО (правильнее говорить именно генно-инженерные организмы!)
- 56. Критерии и методы оценки безопасности генетически модифицированных организмов
- 57. Критерии и методы оценки безопасности генетически модифицированных организмов Риск и оценка риска. По наиболее общему определению,
- 58. Критерии и методы оценки безопасности генетически модифицированных организмов Риск генно-инженерной деятельности. Для получения экономической выгоды от
- 59. Критерии и методы оценки безопасности генетически модифицированных организмов В конечном итоге процедура оценки риска должна дать
- 60. Критерии и методы оценки безопасности генетически модифицированных организмов Принцип принятия мер предосторожности Источники появления и применения
- 61. Критерии и методы оценки безопасности генетически модифицированных организмов Принцип принятия мер предосторожности является по существу политической
- 62. Критерии и методы оценки безопасности генетически модифицированных организмов С целью прояснить порядок применения данного принципа в
- 63. Критерии и методы оценки безопасности генетически модифицированных организмов Пропорциональность соответствия. Меры по управлению риском ГИД в
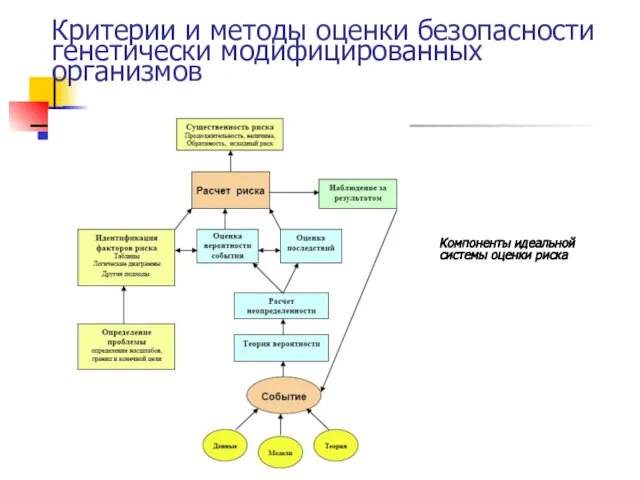
- 64. Критерии и методы оценки безопасности генетически модифицированных организмов Компоненты идеальной системы оценки риска
- 65. Критерии и методы оценки безопасности генетически модифицированных организмов Применяемая в разных странах методика оценки риска ГИД
- 66. Критерии и методы оценки безопасности генетически модифицированных организмов • Оценка возможных последствий каждого неблагоприятного воздействия ГИД,
- 67. Международная и государственная регламентация биобезопасности Если экономическая выгода от использования ГИО в целом очевидна, то их
- 68. Международная и государственная регламентация биобезопасности Во избежание негативных последствий от бесконтрольного применения генетически модифицированных организмов, 29
- 69. Международная и государственная регламентация биобезопасности Наибольшее беспокойство вызывает вероятность переноса генетического материала трансгенного растения в геномы
- 70. Международная и государственная регламентация биобезопасности Так, в 2003 г. немецкие исследователи из Кельна и Эрлангена опубликовали
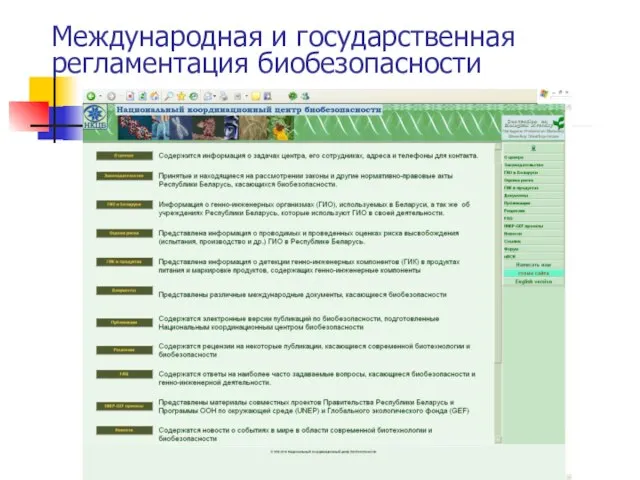
- 71. Международная и государственная регламентация биобезопасности Международная структура биобезопасности и структура биобезопасности отдельных государств включают в себя
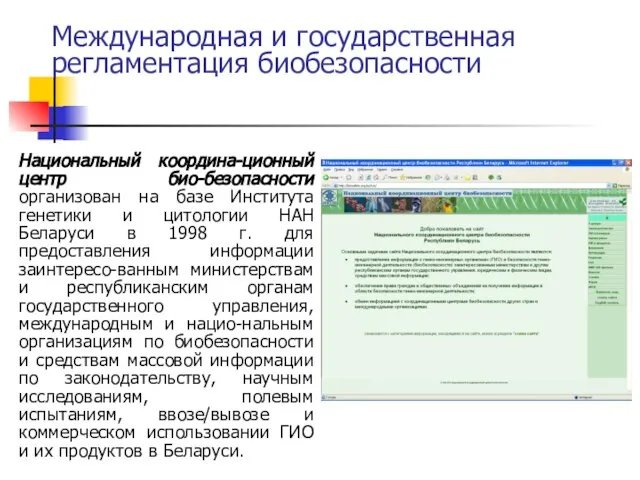
- 72. Международная и государственная регламентация биобезопасности Национальный координа-ционный центр био-безопасности организован на базе Института генетики и цитологии
- 73. Международная и государственная регламентация биобезопасности
- 74. Международная и государственная регламентация биобезопасности Среди прочих информационных материалов на сайте центра представлены различные национальные и
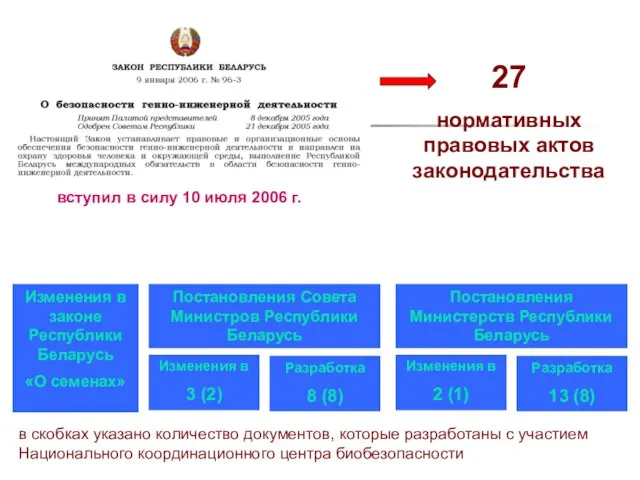
- 75. вступил в силу 10 июля 2006 г. 27 нормативных правовых актов законодательства Изменения в законе Республики
- 77. Скачать презентацию
























































 Marketing & Sales ALIGNMENT
Marketing & Sales ALIGNMENT Гистограмма изображения
Гистограмма изображения Программа создания национального домена .РФ на основе кириллицы Андрей Романов АНО «Координационный центр национального домена
Программа создания национального домена .РФ на основе кириллицы Андрей Романов АНО «Координационный центр национального домена  Великие географические открытия
Великие географические открытия Влияние алкоголя на организм человека
Влияние алкоголя на организм человека Презентация на тему Красная книга 2 класс
Презентация на тему Красная книга 2 класс  Лекция 1 (2)
Лекция 1 (2) Принцип федерализма
Принцип федерализма Гражданская война 1861-1865 года
Гражданская война 1861-1865 года The king to be
The king to be Своя игра
Своя игра 2011 год
2011 год ожоги и обморожения 6 класс
ожоги и обморожения 6 класс Презентация на тему Проводники и диэлектрики Физика твердого тела
Презентация на тему Проводники и диэлектрики Физика твердого тела Символика Самарского Края
Символика Самарского Края Vozmozhnosti_portativnykh_i_perenosimykh_TSR
Vozmozhnosti_portativnykh_i_perenosimykh_TSR Аттестация профессиональной деятельности на основе модели компетенций преподавателя вуза
Аттестация профессиональной деятельности на основе модели компетенций преподавателя вуза Государственное Бюджетное Дошкольное Образовательное Учреждение детский сад №46 комбинированного вида Колпинского района Санк
Государственное Бюджетное Дошкольное Образовательное Учреждение детский сад №46 комбинированного вида Колпинского района Санк Презентацияпо теме: «Механические колебания и волны»
Презентацияпо теме: «Механические колебания и волны» Перозис у птиц
Перозис у птиц Система классных часов и собраний
Система классных часов и собраний Supporting your decisions Построение системы эффективного управления промышленным предприятием на базе современных информационно-аналитиче
Supporting your decisions Построение системы эффективного управления промышленным предприятием на базе современных информационно-аналитиче Гимнастика и элементы акробатики. 5 класс
Гимнастика и элементы акробатики. 5 класс Гармонические колебания (11 класс)
Гармонические колебания (11 класс) Местоимение
Местоимение лекция 1
лекция 1 Правописание Н и НН в прилагательных и причастиях
Правописание Н и НН в прилагательных и причастиях Презентация на тему Сложные предложения 9 класс
Презентация на тему Сложные предложения 9 класс