Слайд 2Гетероциклические соединения

Слайд 3Гетероциклические соединения
Содержат циклы, в которых, кроме атомов углерода, имеются один или несколько

атомов других элементов (азота, кислорода, серы)
Слайд 4Группа гетероциклов, имеющих сопряженные системы кратных связей

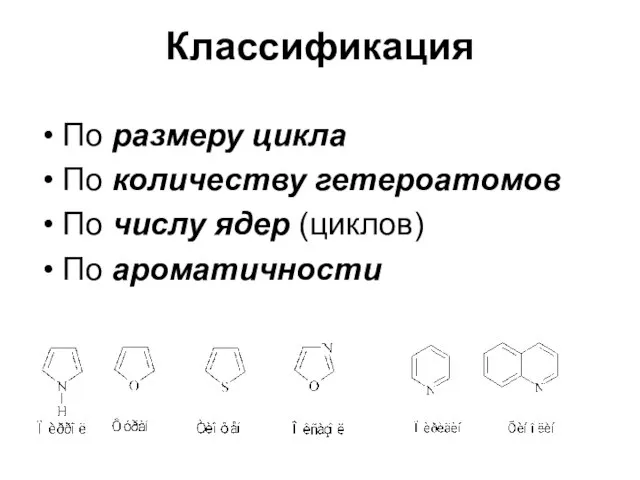
Слайд 5Классификация
По размеру цикла
По количеству гетероатомов
По числу ядер (циклов)
По ароматичности
Слайд 6Номенклатура
Система Ганча-Видемана
По этой системе название гетероцикла строится путем объединения стандартного префикса

или префиксов, обозначающих гетероатомы и стандартной основы, указывающей на размер цикла и на то, насыщенный он или нет
Слайд 7Происхождение корня
в системе Ганча-Видемана

Слайд 8Система Ганча-Видемана: префиксы в порядке падающего старшинства

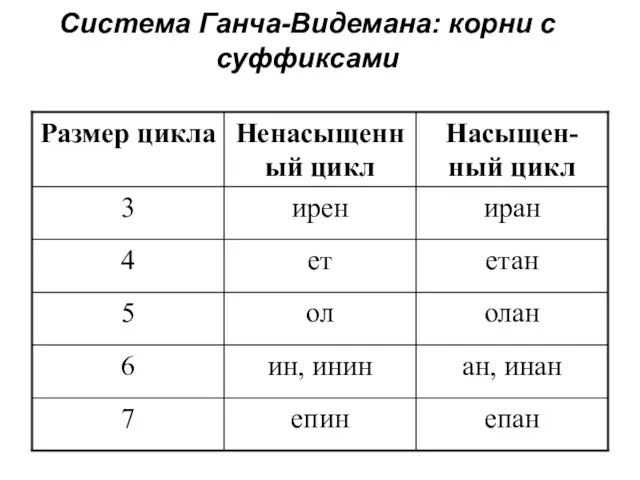
Слайд 9Система Ганча-Видемана: корни с суффиксами
Слайд 10Номенклатура
Положение единственного гетероатома определяет нумерацию моноциклического соединения, начинающуюся с этого гетероатома
Два или

более одинаковых гетероатома обозначаются приставками «ди», «три» и т.д.
Слайд 11Номенклатура
Цифровые указатели положения гетероатомов в кольце ставятся перед названием (для различных гетероатомов

префиксы перечисляются в том порядке, в каком они приведены в таблице)
Нумерация начинается со старшего гетероатома, он должен получить наименьший из возможных номеров
Слайд 13Данные спектров ЯМР 1Н и 13С (смещение сигналов протонов и ядер 13С

в сильное поле по сравнению с бензолом, для которого эти величины составляют 7.27 и 129 м.д. соответственно) и сравнение дипольных моментов насыщенных и ароматических пятичленных гетероциклов свидетельствуют о смещении электронов от гетероатома в ароматическое кольцо
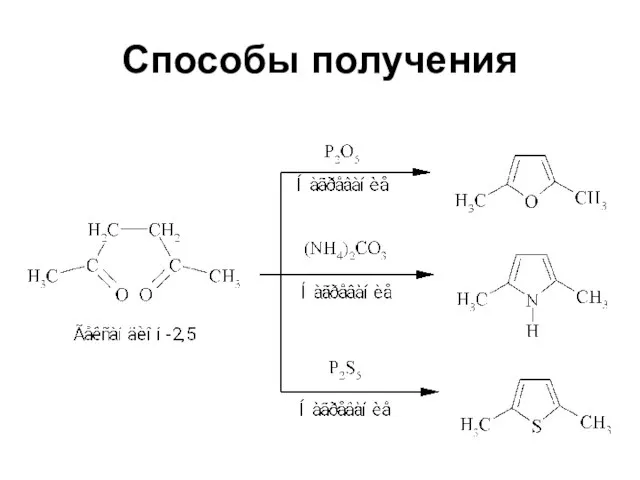
Слайд 19ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
400-500 оС в присутствии Al2O3
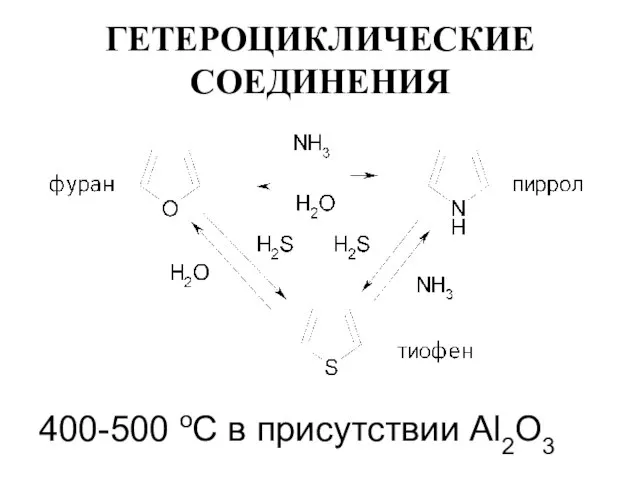
Слайд 20ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Свойства:
амина R-NH-R
простого эфира R-O-R
тиоэфира (сульфида) R-S-R
Реакции электрофильного

замещения
Слайд 21Ароматичность
Теплоты сгорания указывают на наличие значительной энергии резонансной стабилизации
67-117 кДж/моль
Энергия резонанса

бензола 150,72 кДж/моль
Энергия резонанса сопряженных диенов 12,56 кДж/моль
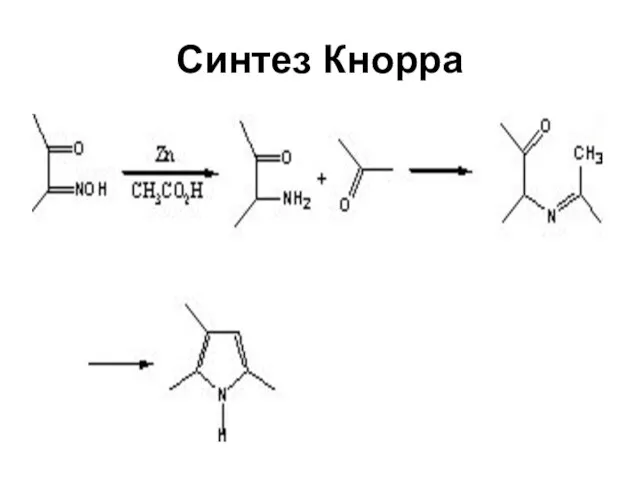
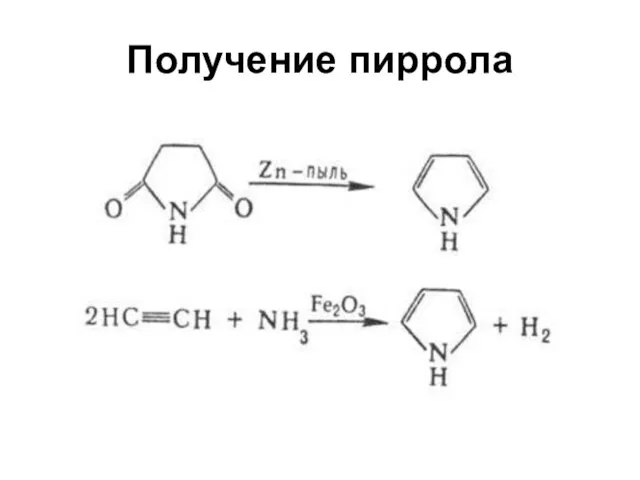
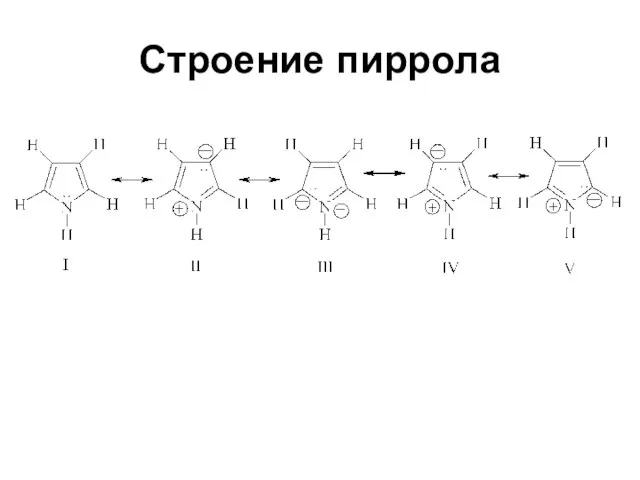
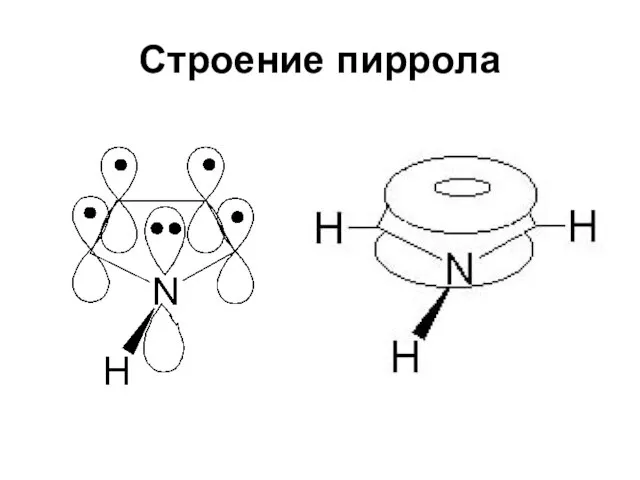
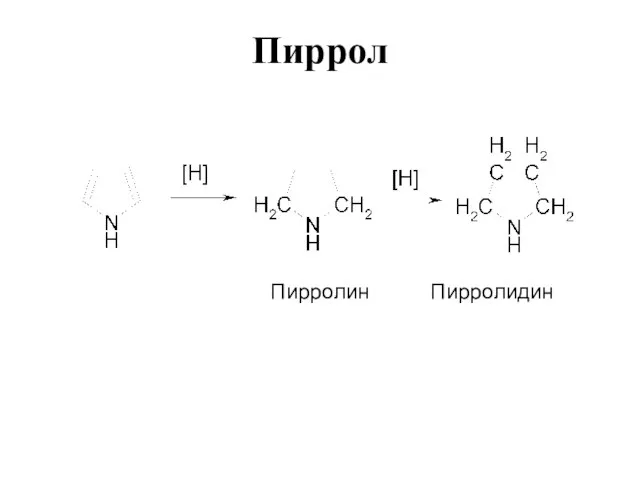
Слайд 22Строение пиррола
Данные, полученные при измерении длин связей в молекуле пиррола, дипольных моментов,

УФ-спектров, теплот сгорания, подтверждают наличие делокализованной π-электронной системы
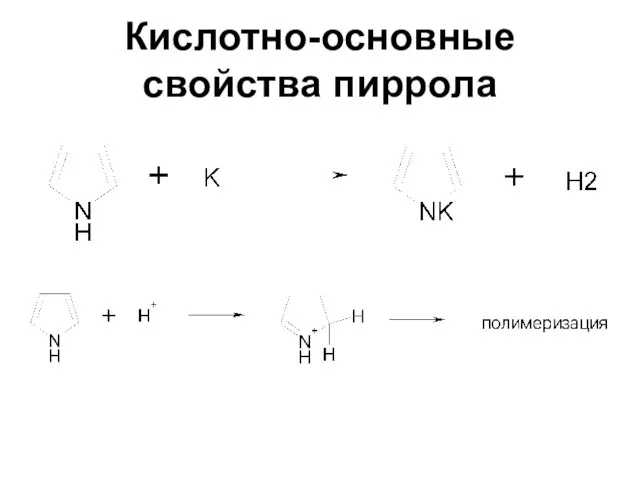
Слайд 25Кислотно-основные свойства пиррола
Пиррол - очень слабое основание
Он ацидофобен
Слабые кислотные свойства

Слайд 26Кислотно-основные свойства пиррола
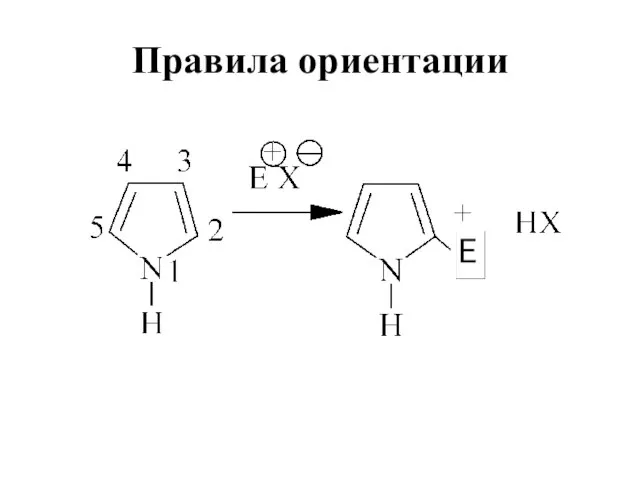
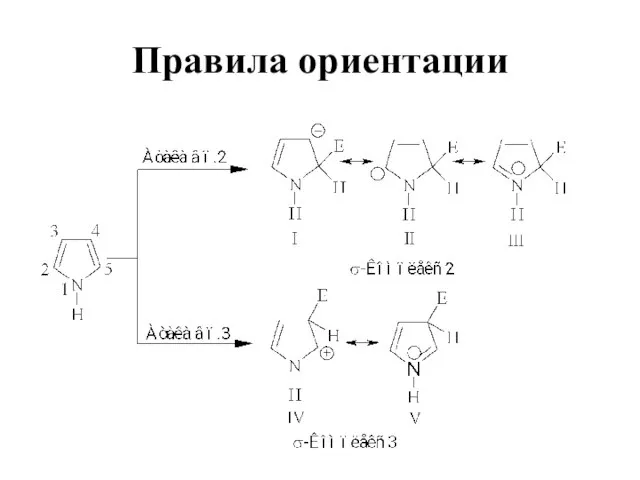
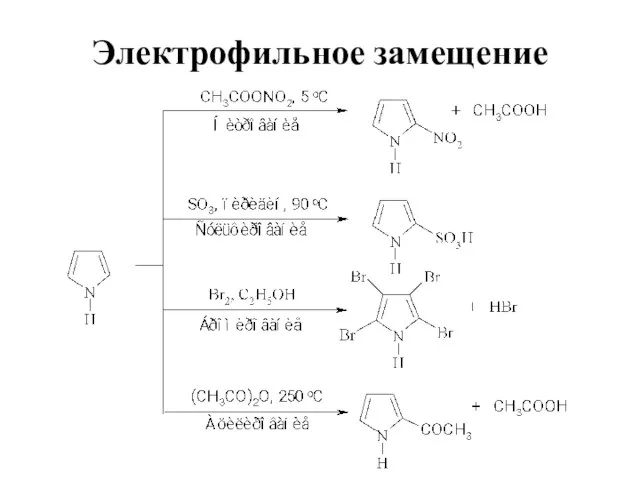
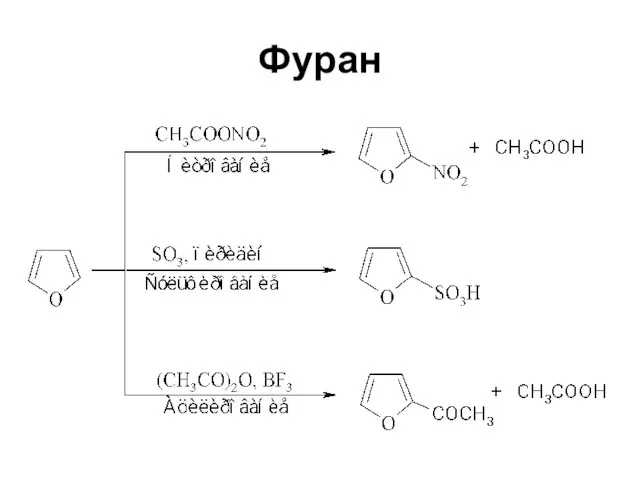
Слайд 27Электрофильное замещение
Высокая электронная плотность в кольце
Высокая реакционная способность

Слайд 32Реакции азосочетания
В нейтральной или слабокислой среде - образование 2-азопроизводного
В щелочных
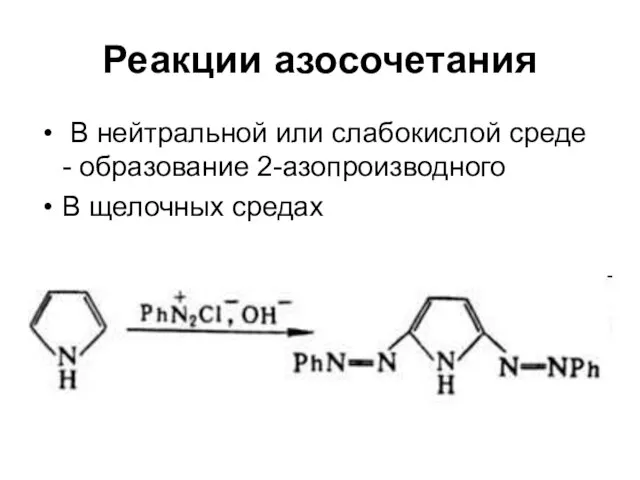
средах
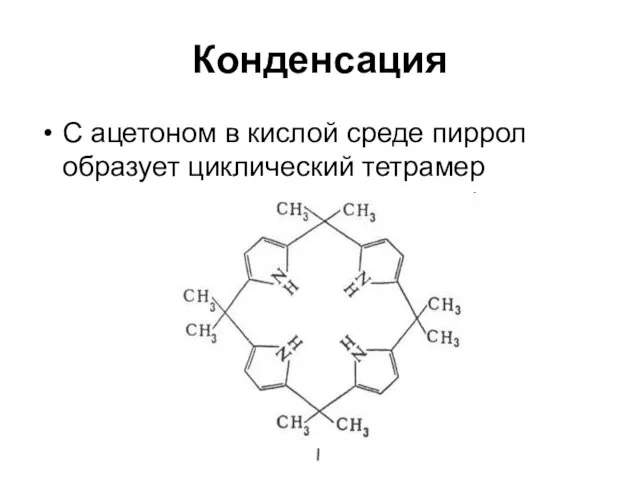
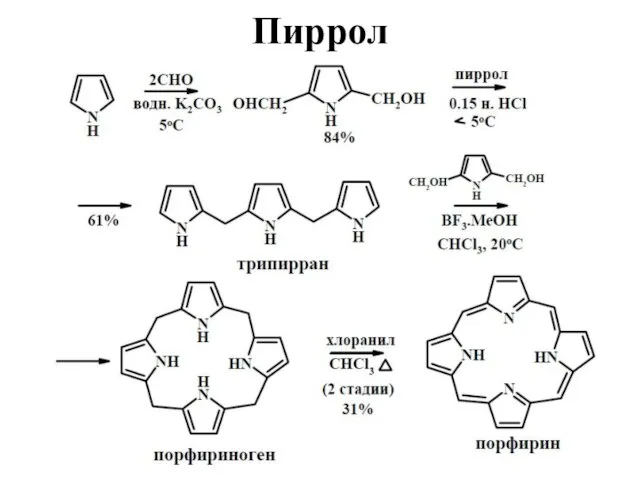
Слайд 33Конденсация
С ацетоном в кислой среде пиррол образует циклический тетрамер
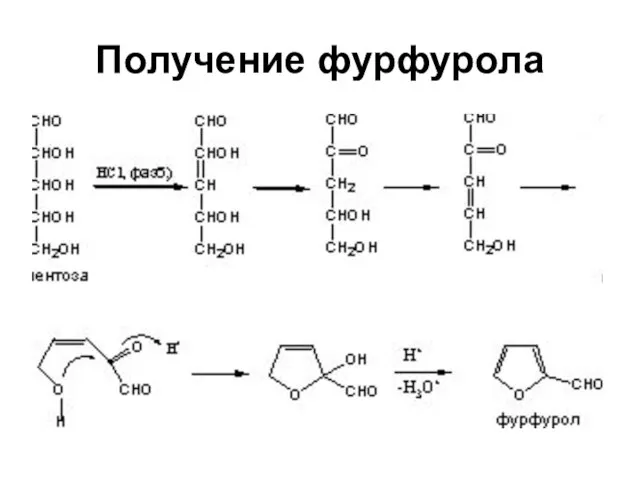
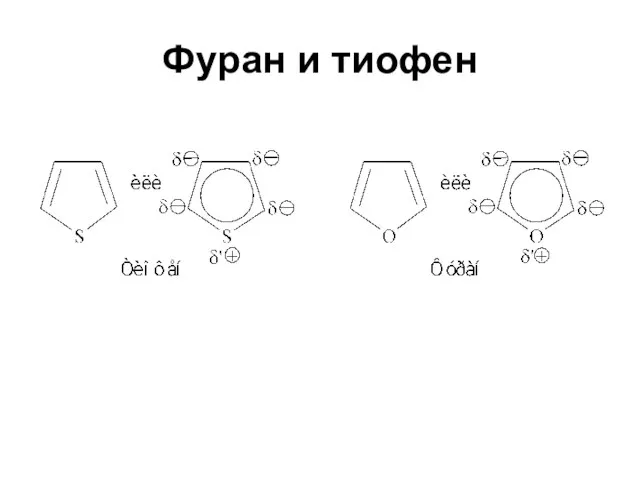
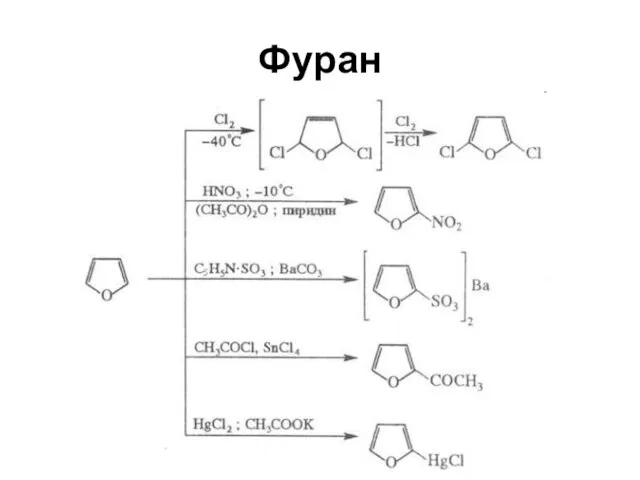
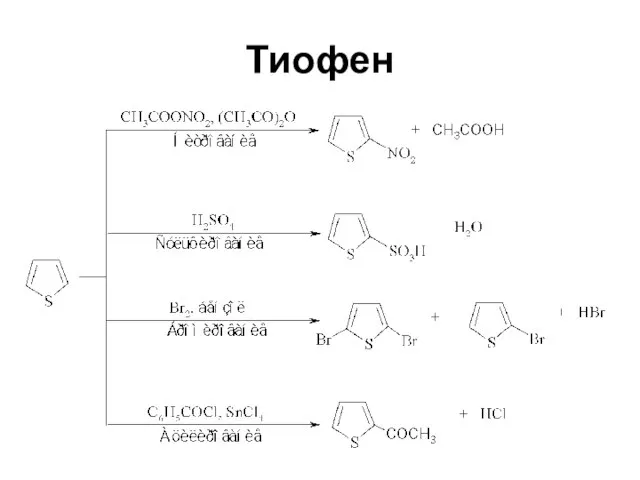
Слайд 38Ароматический характер
Усиливается от фурана к пирролу и далее к тиофену
Энергия резонанса соответственно

66.99; 87.92; 117 кДж/моль
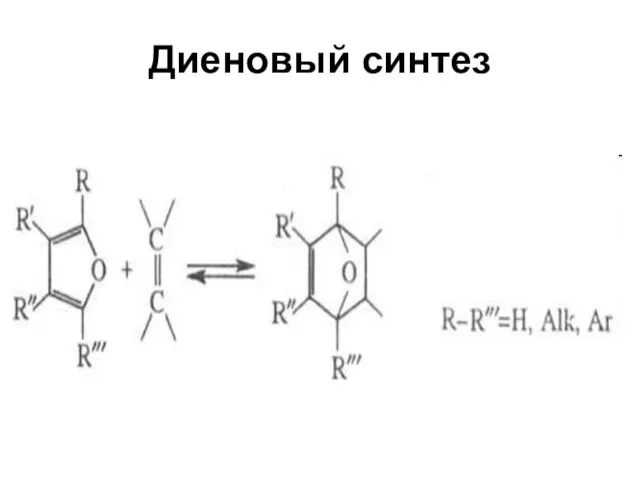
Фуран, наименее ароматичный из этих трех соединений, вступает в реакции диенового синтеза в качестве диена
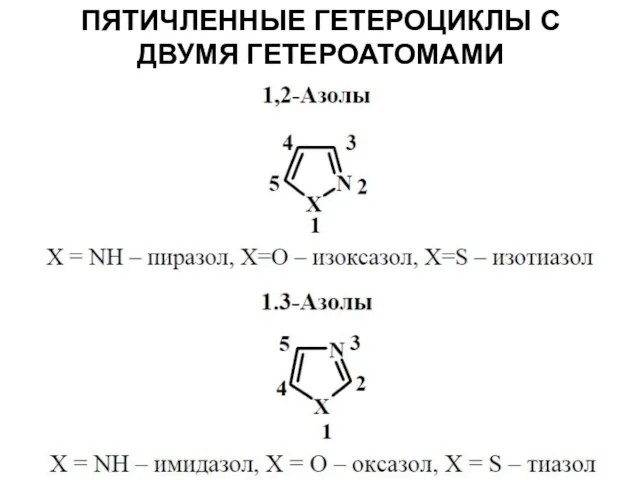
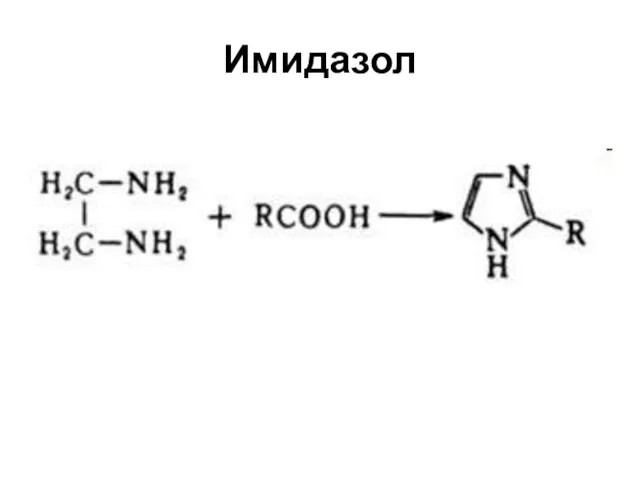
Слайд 43ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ДВУМЯ ГЕТЕРОАТОМАМИ
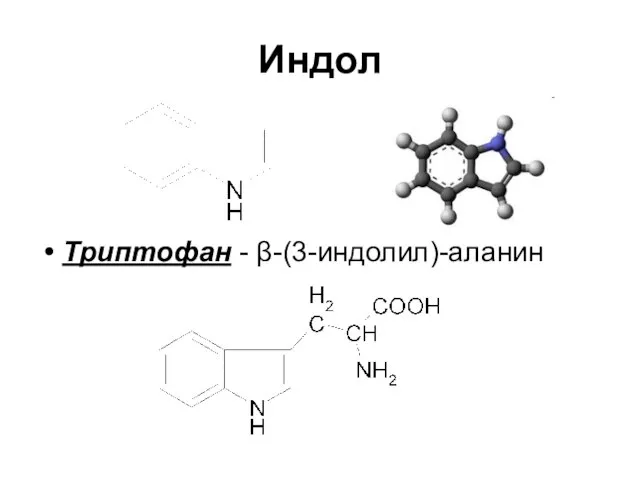
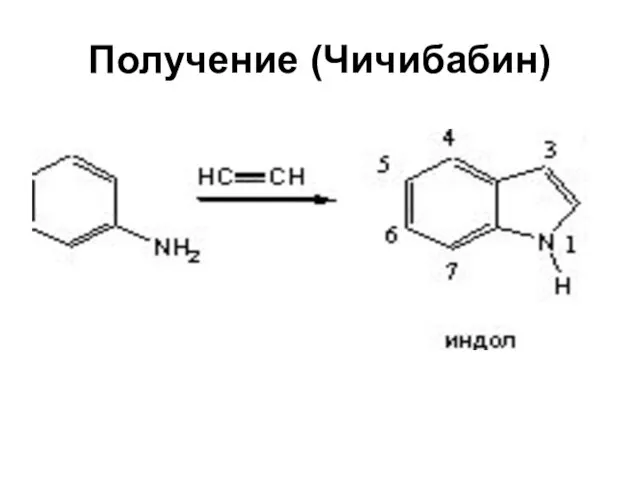
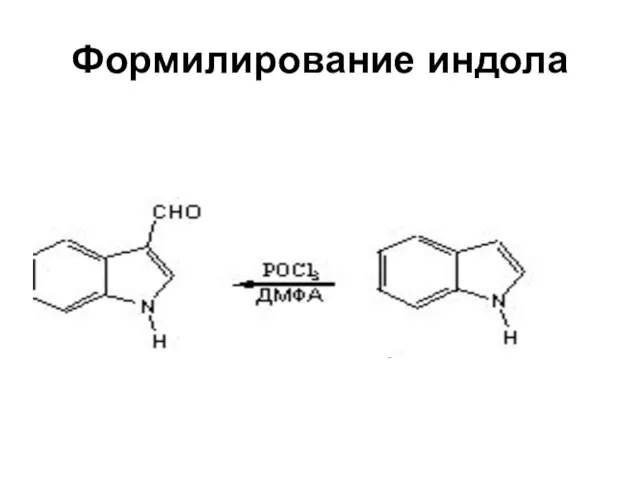
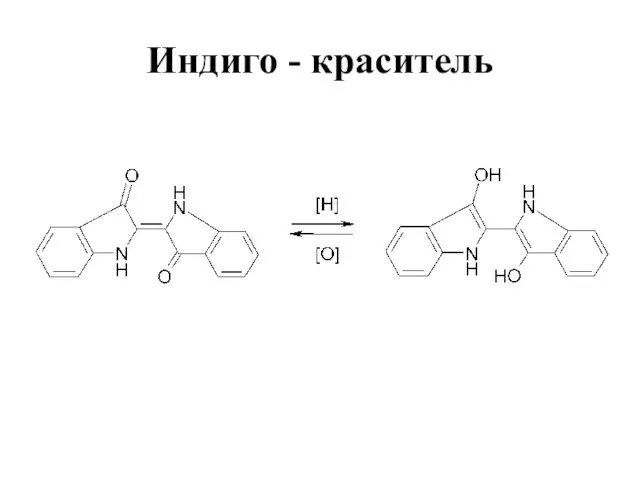
Слайд 46Индол
Триптофан - β-(3-индолил)-аланин
Слайд 49Синтез Фишера
в присутствии кислотных катализаторов – хлористого цинка, трехфтористого бора, полифосфорной кислоты
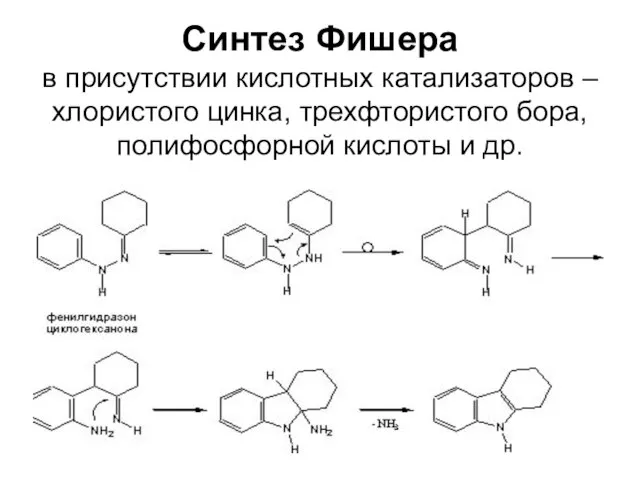
и др.
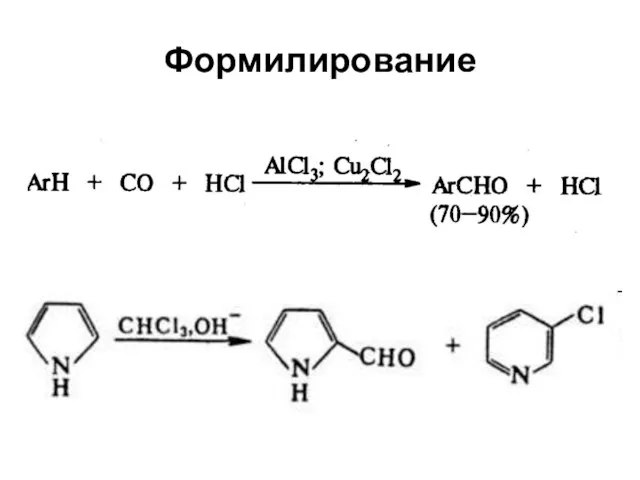
Слайд 51Электрофильное замещение в пиррольном кольце индола
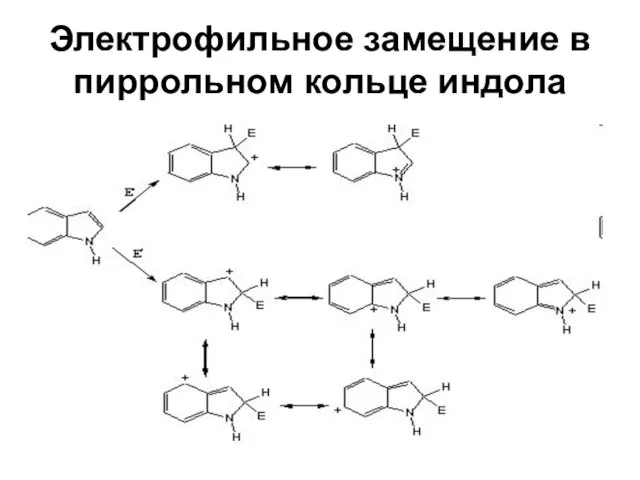
Слайд 53Электрофильное замещение
Нитрование осуществляется бензоилнитратом
Сульфирование – пиридинсульфотриоксидом
Бромирование - диоксандибромидом, хлорирование - SO2Cl2

Слайд 55Спектральные исследования и спектроскопия ЯМР имеют чрезвычайно важное значение для оценки степени

ароматичности соединений
Слайд 56УФ-спектроскопия
Фуран – 200 нм
Пиридазин – 340 нм

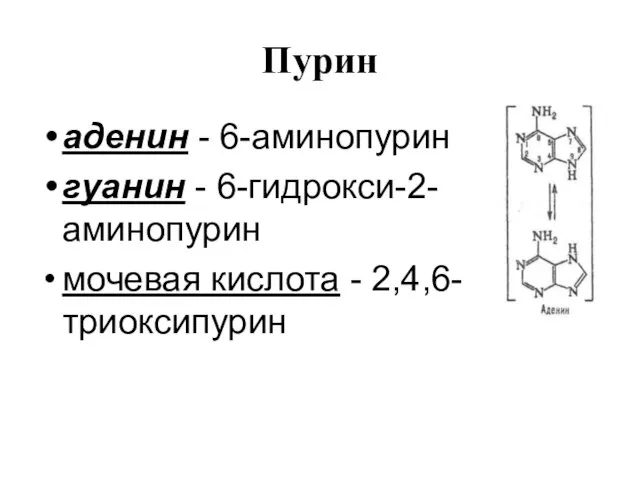
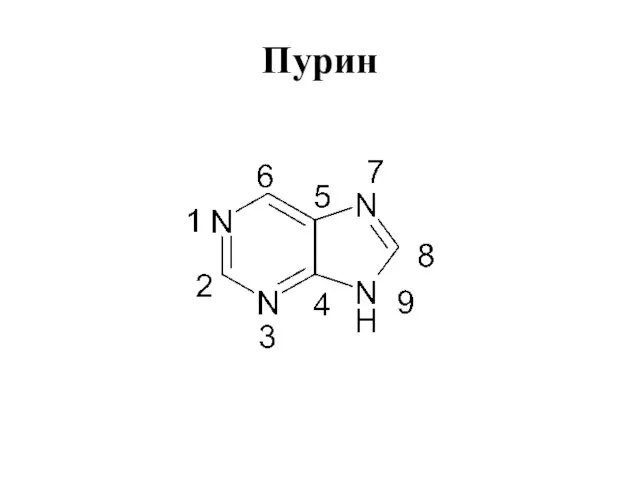
Слайд 58Пурин
аденин - 6-аминопурин
гуанин - 6-гидрокси-2-аминопурин
мочевая кислота - 2,4,6-триоксипурин































 Презентация ремонтов. Ремонт вагонов
Презентация ремонтов. Ремонт вагонов Схема жизни бетонной конструкции 3 года30-35 лет40 лет 0-3 года – набор бетоном проектной прочности 3-40 лет – незначительное уменьшение
Схема жизни бетонной конструкции 3 года30-35 лет40 лет 0-3 года – набор бетоном проектной прочности 3-40 лет – незначительное уменьшение понятливый понятой
понятливый понятой Природный газ
Природный газ Музыка и изобразительное искусство
Музыка и изобразительное искусство Старший кассир, кассир
Старший кассир, кассир Комнатные растения в интерьере 7 класс
Комнатные растения в интерьере 7 класс Тьюторская тема
Тьюторская тема Классный час
Классный час Все мы родом из детства Зам.директора ВР Пыжик Т.Е.
Все мы родом из детства Зам.директора ВР Пыжик Т.Е. Психологическое сопровождение
Психологическое сопровождение ПТК Восточной Сибири. Полуостров Таймыр
ПТК Восточной Сибири. Полуостров Таймыр ЕГЭ 2010
ЕГЭ 2010 Всемирный День студента
Всемирный День студента Девиантное поведение. 8 класс
Девиантное поведение. 8 класс Профпригодность. Тесты
Профпригодность. Тесты МАСТЕРСКАЯ-ПРАКТИКУМ ПО ЭРГОНОМИЧЕСКИМ ОСНОВАМ ПРОЕКТИРОВАНИЯ ПОЛЬЗОВАТЕЛЬСКИХ ИНТЕРФЕЙСОВ
МАСТЕРСКАЯ-ПРАКТИКУМ ПО ЭРГОНОМИЧЕСКИМ ОСНОВАМ ПРОЕКТИРОВАНИЯ ПОЛЬЗОВАТЕЛЬСКИХ ИНТЕРФЕЙСОВ «У солнышка в гостях»
«У солнышка в гостях» Схема взаимосвязей образовательных понятий
Схема взаимосвязей образовательных понятий Монеты древней руси
Монеты древней руси СССР в годы Хрущевской оттепели 1953-1964
СССР в годы Хрущевской оттепели 1953-1964 «Путь к звездам»
«Путь к звездам» Солнце – вечный огонь Вселенной. Солнечная система
Солнце – вечный огонь Вселенной. Солнечная система Java Script Examples
Java Script Examples Работа на швейной машинке
Работа на швейной машинке Питание растений 6 класс
Питание растений 6 класс Организации вебинара
Организации вебинара Подписки Билайн: масс-медиа нового поколения
Подписки Билайн: масс-медиа нового поколения