Содержание
- 2. Гидролиз – это реакции обменного Взаимодействия вещества с водой, приводящие к их разложению. Гидролизу подвергаются соединения
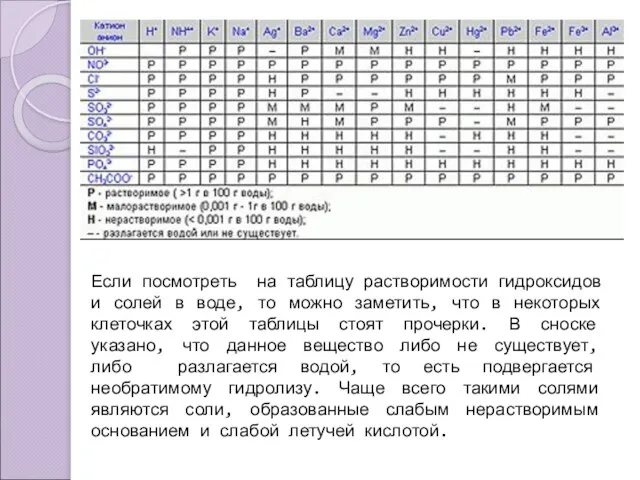
- 3. Если посмотреть на таблицу растворимости гидроксидов и солей в воде, то можно заметить, что в некоторых
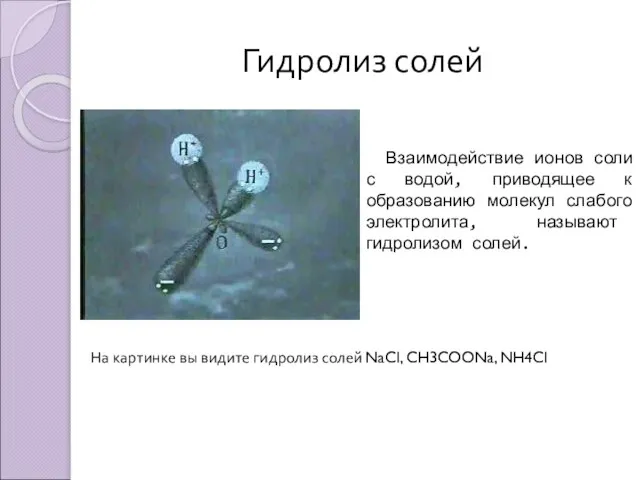
- 4. Гидролиз солей Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
- 5. Количественной характеристикой Гидролиза солей может служить степень гидролиза (a), определяемая отношением концентрации гидролизованной части молекул к
- 6. Частичный Гидролиз трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент).
- 7. Различают несколько вариантов гидролиза солей: 1. Гидролиз соли слабой кислоты и сильного основания: Na2CO3 + Н2О
- 8. Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно
- 9. При гидролизе жиров в присутствии щелочей получают мыла. Гидролиз жиров в присутствии катализаторов применяется для получения
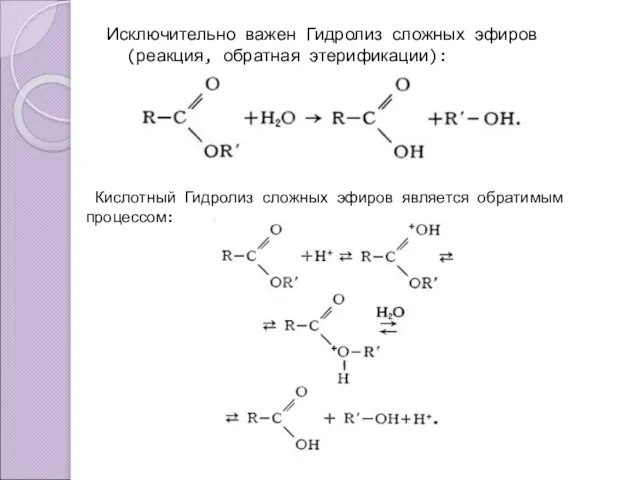
- 10. Исключительно важен Гидролиз сложных эфиров (реакция, обратная этерификации): Кислотный Гидролиз сложных эфиров является обратимым процессом:
- 11. Термин «Гидролиз» обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно
- 13. Скачать презентацию







 Московский городской педагогический университет
Московский городской педагогический университет Теория государства и права. Раздел 1
Теория государства и права. Раздел 1 Урок по роману Ф.М. Достоевского «Преступление и наказание»
Урок по роману Ф.М. Достоевского «Преступление и наказание» Витамины 1 класс
Витамины 1 класс Работа с закрытой картиной. Рисунок по описанию
Работа с закрытой картиной. Рисунок по описанию Живописная музыка и музыкальная живопись
Живописная музыка и музыкальная живопись ЧТО ТАКОЕ НОВЫЙ ОБРАЗОВАТЕЛЬНЫЙ СТАНДАРТ Переход на новые образовательные стандарты - это развитие системы поддержки талантливых
ЧТО ТАКОЕ НОВЫЙ ОБРАЗОВАТЕЛЬНЫЙ СТАНДАРТ Переход на новые образовательные стандарты - это развитие системы поддержки талантливых Формирование навыков культуры гигиены у ребенка.
Формирование навыков культуры гигиены у ребенка. Живопись шерстью
Живопись шерстью 6号地块35/0.4kV供电方案汇报
6号地块35/0.4kV供电方案汇报 Презентация на тему Природный комплекс
Презентация на тему Природный комплекс Деньги их функции и виды
Деньги их функции и виды В разделе представлены объекты коммунальной собственности Жлобинского района, подлежащие продаже путем проведения аукционов. Дл
В разделе представлены объекты коммунальной собственности Жлобинского района, подлежащие продаже путем проведения аукционов. Дл ОБУЧЕНИЕ ГОВОРЕНИЮ монологическая, диалогическая речь
ОБУЧЕНИЕ ГОВОРЕНИЮ монологическая, диалогическая речь Turbo Performance Introduction
Turbo Performance Introduction Нагорный Карабах в коллайдере небополитики
Нагорный Карабах в коллайдере небополитики Государственные (муниципальные) услуги: эволюция института в практике административного управления
Государственные (муниципальные) услуги: эволюция института в практике административного управления Способы завязывания шарфов и платков
Способы завязывания шарфов и платков Кукла в творчестве Д.Д.Шостаковича. Матрешка как разновидность народного творчества
Кукла в творчестве Д.Д.Шостаковича. Матрешка как разновидность народного творчества Презентация на тему Введение в школьную жизнь
Презентация на тему Введение в школьную жизнь Презентация на тему Правила поведения ученика
Презентация на тему Правила поведения ученика Чернобыльская авария. Десятилетия спустя
Чернобыльская авария. Десятилетия спустя Учитель музыки: Щукина Л.Н.
Учитель музыки: Щукина Л.Н. 1882 - 1969
1882 - 1969 Автоматизация процесса управления транспортировкой проб минеральных удобрений
Автоматизация процесса управления транспортировкой проб минеральных удобрений Частный риэлтор
Частный риэлтор Презентация на тему Строение ДНК
Презентация на тему Строение ДНК  Экзамен (квалификационный). ПМ.06 организация работы структурного подразделения
Экзамен (квалификационный). ПМ.06 организация работы структурного подразделения