Содержание
- 2. Завдання уроку: Узагальнити і систематизувати знання про хімічні елементи і будову їх атомів Навчитися характеризувати хімічні
- 3. Це актуально! 1) Чим можна пояснити періодичну зміну властивостей елементів, розташованих у періодичній системі? 2) В
- 4. 3) Як змінюється радіус атомів елементів, розташованих в одному періоді? Чим це можна пояснити? 4) Як
- 5. 6) Як змінюється металічні та неметалічні властивості елементів, розташованих в одній групі головній підгрупі? Чим це
- 6. План характеристики елемента за його положенням у періодичній системі та будовою атома. І. Назва елемента, його
- 7. ІІ. Положення у Періодичній системі: 20 4 великий період ІІ група головна підгрупа
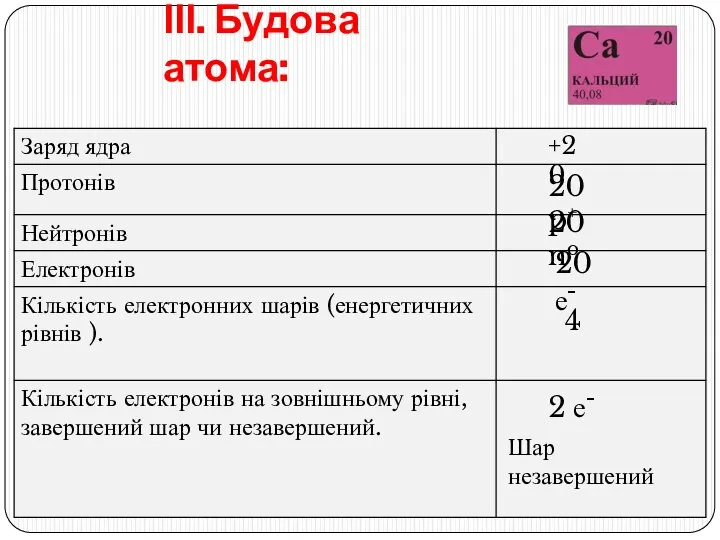
- 8. ІІІ. Будова атома: +20 20 p+ 20 no 20 е- 4 2 е- Шар незавершений
- 9. Графічна електронна формула. Електронна формула Схема будови атома 20Са ) ) ) ) 2е 8е 8е
- 10. ІV. Характер хімічного елемента: s-елемент; металічний елемент V. Назва та формула простої речовини. Кальцій Са -
- 11. VІІ. Порівняння металічних властивостей із властивостями елементів, що стоять поряд у періоді та групі. Са проявляє
- 12. Додаткові вправи для закріплення матеріалу 1. Користуючись планом характеристики хімічного елемента, схарактеризуйте Хлор, Карбон. 2. В
- 13. 5. Обґрунтуйте, чи будуть вищі оксиди елементів з атомними номерами 6, 11, 18 взаємодіяти з кислотою.
- 15. Скачать презентацию











 ES-5844P
ES-5844P Жизнь диких животных зимой
Жизнь диких животных зимой Лекция 3 Безопасная эксплуатация сосудов, работающих под давлением Цель занятия: Изучить основные правила безопасности при эксплу
Лекция 3 Безопасная эксплуатация сосудов, работающих под давлением Цель занятия: Изучить основные правила безопасности при эксплу Этико-эстетическая культура управления в органах внутренних дел. Культура руководителей внутренних дел
Этико-эстетическая культура управления в органах внутренних дел. Культура руководителей внутренних дел Презентация проектаИинтегрированное Управление Персоналом- Федеральная земля Берлин -Референц-визит от 20.10.2005в Берлине
Презентация проектаИинтегрированное Управление Персоналом- Федеральная земля Берлин -Референц-визит от 20.10.2005в Берлине Проект «создание макета экогруппы моря мезозойской эры»
Проект «создание макета экогруппы моря мезозойской эры» Анод + Катод = Электролиз
Анод + Катод = Электролиз Pirates of the Caribbean
Pirates of the Caribbean УРОК ПРАВА В 1-4 КЛАССАХ
УРОК ПРАВА В 1-4 КЛАССАХ  Смысловая цельность, речевая связность и последовательность изложения
Смысловая цельность, речевая связность и последовательность изложения Планируемые результаты начального общего образования
Планируемые результаты начального общего образования Взаимоотношения с Западом
Взаимоотношения с Западом Разложение электромагнитного поля резонатора по пространственно локализованным базисным функциям
Разложение электромагнитного поля резонатора по пространственно локализованным базисным функциям Выпускники ТМИ 1966 года. 30 лет спустя
Выпускники ТМИ 1966 года. 30 лет спустя 20140111_chudesa_sveta
20140111_chudesa_sveta Разработка нормативно-методическихдокументов, регламентирующихинформационный обмен в книжном деле(издатель-книготорговец-пок
Разработка нормативно-методическихдокументов, регламентирующихинформационный обмен в книжном деле(издатель-книготорговец-пок Формирование информационной основы для проведения сплошного наблюдения субъектов малого и среднего предпринимательства
Формирование информационной основы для проведения сплошного наблюдения субъектов малого и среднего предпринимательства Современные средства поражения и их поражающие факторы
Современные средства поражения и их поражающие факторы По дорогам права. Онлайн-викторина
По дорогам права. Онлайн-викторина Управленческая мысль в эпоху Европейского средневековья
Управленческая мысль в эпоху Европейского средневековья Team_7
Team_7 Технология лесозаготовок. Клён остролистый
Технология лесозаготовок. Клён остролистый Планирование собственного развития. Персональный предпринимательский проект
Планирование собственного развития. Персональный предпринимательский проект ИЗОЛЯЦИЯ И ПЕРЕНАПРЯЖЕНИЯ
ИЗОЛЯЦИЯ И ПЕРЕНАПРЯЖЕНИЯ Презентация на тему Один день из жизни Обломова «Один день – и вся жизнь» Н.А.Добролюбов
Презентация на тему Один день из жизни Обломова «Один день – и вся жизнь» Н.А.Добролюбов  Символизм в искусстве
Символизм в искусстве Презентация на тему Обучение учащихся с разной функциональной асимметрией полушарий
Презентация на тему Обучение учащихся с разной функциональной асимметрией полушарий Школа дошкольника «Первые шаги»2 год обучения
Школа дошкольника «Первые шаги»2 год обучения