Содержание
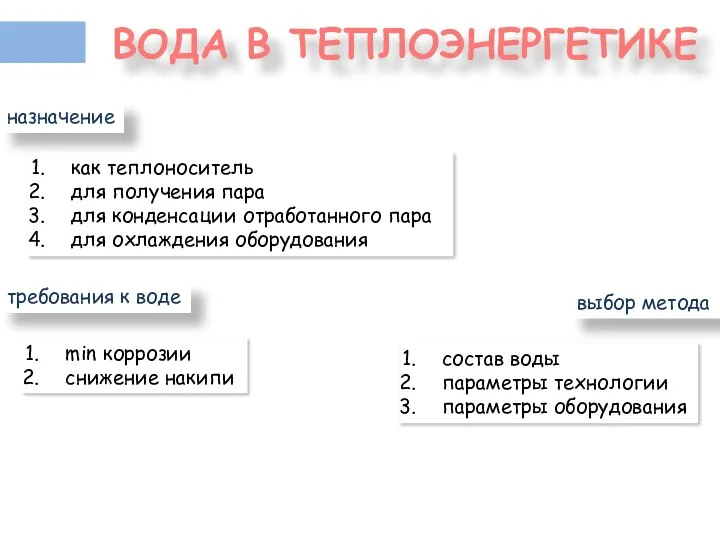
- 2. ВОДА В ТЕПЛОЭНЕРГЕТИКЕ назначение как теплоноситель для получения пара для конденсации отработанного пара для охлаждения оборудования
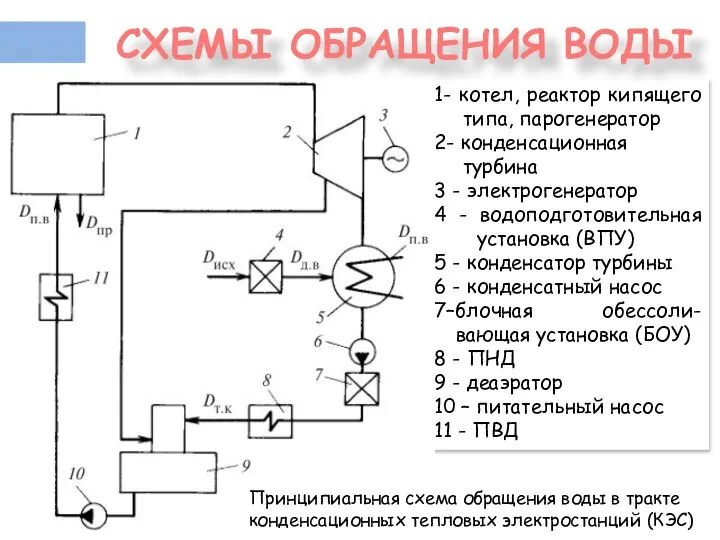
- 3. 1- котел, реактор кипящего типа, парогенератор 2- конденсационная турбина 3 - электрогенератор 4 - водоподготовительная установка
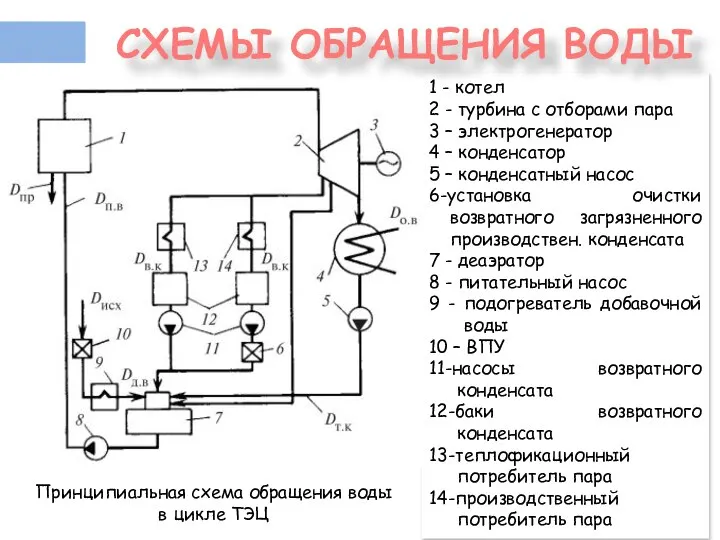
- 4. 1 - котел 2 - турбина с отборами пара 3 – электрогенератор 4 – конденсатор 5
- 5. СХЕМЫ ОБРАЩЕНИЯ ВОДЫ
- 6. СХЕМЫ ОБРАЩЕНИЯ ВОДЫ Dт.к.+ Dв.к.+Dд.в.
- 7. СХЕМЫ ОБРАЩЕНИЯ ВОДЫ
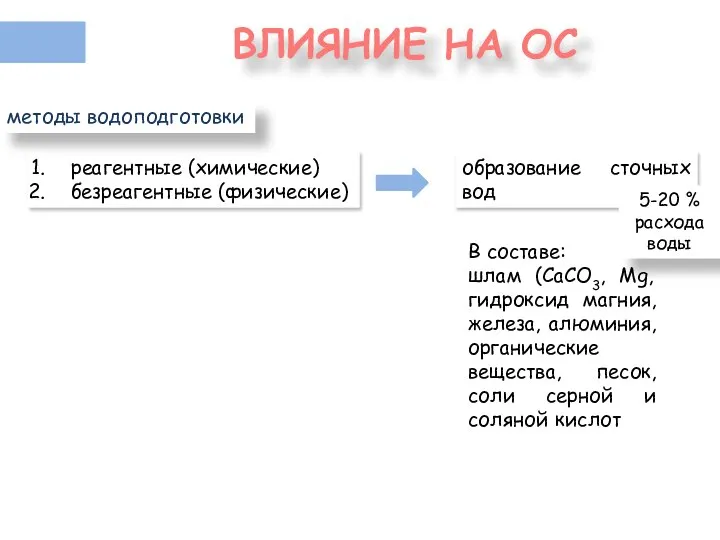
- 8. ВЛИЯНИЕ НА ОС реагентные (химические) безреагентные (физические) методы водоподготовки образование сточных вод 5-20 % расхода воды
- 9. ВЛИЯНИЕ НА ОС
- 10. КЛАССИФИКАЦИЯ ПРИРОДНЫХ ВОД по степени минерализации пресная (до 1 г/л) солоноватая (1-25 г/л) морской солености (26-50
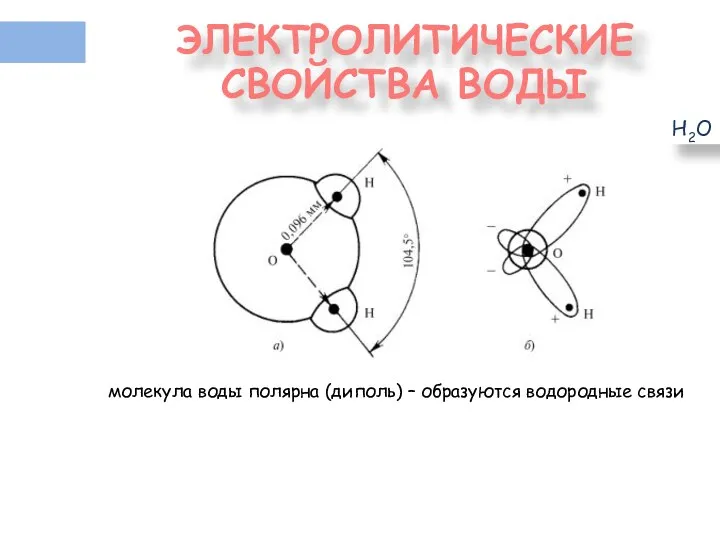
- 11. ЭЛЕКТРОЛИТИЧЕСКИЕ СВОЙСТВА ВОДЫ Н2О молекула воды полярна (диполь) – образуются водородные связи
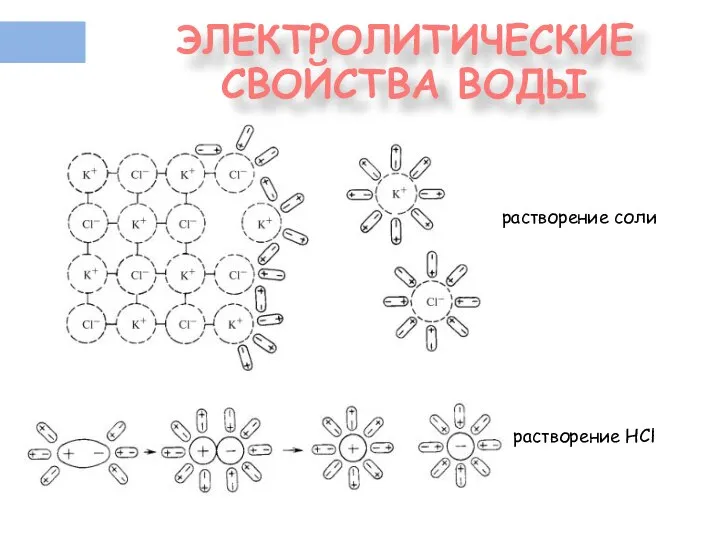
- 12. ЭЛЕКТРОЛИТИЧЕСКИЕ СВОЙСТВА ВОДЫ растворение соли растворение HCl
- 13. ЭЛЕКТРОЛИТИЧЕСКИЕ СВОЙСТВА ВОДЫ эффективная концентрация в растворе, которая в результате взаимодействия ионов (электростатического притяжения и отталкивания)
- 14. ЭЛЕКТРОЛИТИЧЕСКИЕ СВОЙСТВА ВОДЫ А = 1,823·106/(εT)3/2; μ — ионная сила; zi — валентность ионов данного вида;
- 15. ЭЛЕКТРОЛИТИЧЕСКИЕ СВОЙСТВА ВОДЫ Ионная сила μ характеризует меру интенсивности электрического поля, возникающего в растворе из-за наличия
- 16. ЭЛЕКТРОЛИТИЧЕСКИЕ СВОЙСТВА ВОДЫ Зависимость ионного произведения воды от температуры В любом водном растворе всегда присутствуют оба
- 17. ПРИМЕСИ ПРИРОДНЫХ ВОД по степени дисперсности истинно-растворенные коллоидно-дисперсные (d 1-100 нм) грубодисперсные (d > 100 нм)
- 18. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ основные ионы
- 19. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ Na + K+ Устойчивые примеси (не образуют трудно-растворимые соли, не гидролизуются) Концентрация меняется в
- 20. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ Fe2+ Не образуют трудно-растворимых солей В малой степени гидролизуются При повышенных концентрациях растворенного О2
- 21. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ Cl - SO42- Устойчивые примеси (не образуют трудно-растворимые соли, не гидролизуются) В присутствии большого
- 22. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ кремниевая кислота Находится в природной воде в недиссоциированном состоянии Ангидрид кремниевой кислоты SiO2 образует
- 23. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ HCO3- CO32- Важнейшие анионы, определяющие поведение различных примесей в них, а также в технологических
- 24. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ стабильная Если содержание СО2 соответствует расчетному агрессивная Если СО2 больше равновесного, избыток его способен
- 25. ХАРАКТЕРИСТИКА ПРИМЕСЕЙ индекс стабильности 0 – стабильная > 0 - нестабильная контактирование пробы воды с карбонатом
- 26. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ концентрация грубодисперсных примесей (ГДП) концентрация истинно-растворенных примесей (ионный состав) концентрация коррозионно-активных газов концентрация
- 27. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ 1. определяется фильтрованием воды через бумажный фильтр с последующим его высушиванием при температуре
- 28. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ определяется методами химического анализа Концентрация отдельных ионов должен выполняться закон электронейтральности погрешность 1
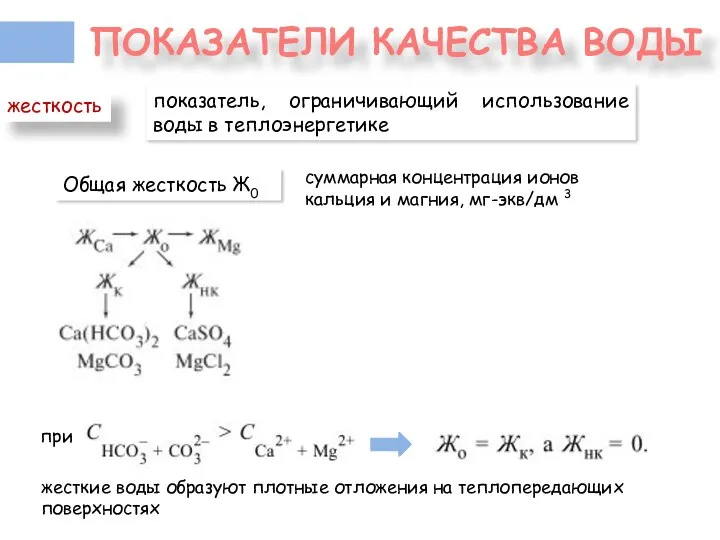
- 29. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ показатель, ограничивающий использование воды в теплоэнергетике жесткость Общая жесткость Ж0 суммарная концентрация ионов
- 30. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ суммарная концентрация всех анионов слабых кислот и ионов гидроксила за вычетом концентрации Н+
- 31. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ численное выражение способности воды проводить электрический ток удельная электропроводность См/м В чистой воде
- 33. Скачать презентацию























 Новый сотрудник. Шаблон
Новый сотрудник. Шаблон Перспективы развития последипломного образования врачей.
Перспективы развития последипломного образования врачей. Калла из фоамирана
Калла из фоамирана Жак Луи Давид
Жак Луи Давид Презентация на тему Шолохов – человек и писатель
Презентация на тему Шолохов – человек и писатель Презентация на тему Лекарства дома
Презентация на тему Лекарства дома Globální navigační satelitní systémy (GNSS)
Globální navigační satelitní systémy (GNSS) На глубине
На глубине "Друзья мои! Прекрасен наш союз..."
"Друзья мои! Прекрасен наш союз..." Киноприз за осенний каприз. Покупайте Милка, Орео или Дирол
Киноприз за осенний каприз. Покупайте Милка, Орео или Дирол Презентация на тему Устное народное творчество
Презентация на тему Устное народное творчество  Предпрофильный курс«Видеооператор. Оператор видеомонтажа»А.В. Бурдаев, заместитель директора по ИТМОУ Просветской СОШ м.р. Волж
Предпрофильный курс«Видеооператор. Оператор видеомонтажа»А.В. Бурдаев, заместитель директора по ИТМОУ Просветской СОШ м.р. Волж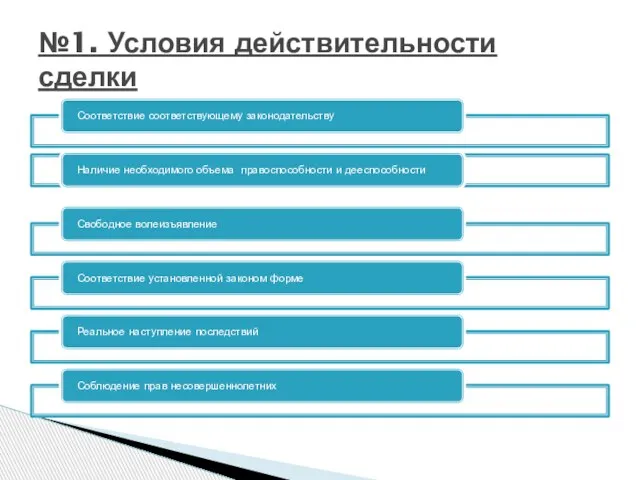 №1. Условия действительности сделки
№1. Условия действительности сделки Документирование как основа тестирования
Документирование как основа тестирования Тема 2_270922
Тема 2_270922 Подготовка к написанию сочинения по картине Виктора Васнецова «Три богатыря»
Подготовка к написанию сочинения по картине Виктора Васнецова «Три богатыря» История психологии
История психологии Болезнь Виллебранда
Болезнь Виллебранда  Стиль самоприукрашивания и образования слепых пятен в самовосприятии
Стиль самоприукрашивания и образования слепых пятен в самовосприятии ОБРАЩЕНИЕ И ЕГО ВЫДЕЛЕНИЕ НА ПИСЬМЕ
ОБРАЩЕНИЕ И ЕГО ВЫДЕЛЕНИЕ НА ПИСЬМЕ СВОЯ ИГРА
СВОЯ ИГРА Федеральный закон 221 о государственном кадастре недвижимости
Федеральный закон 221 о государственном кадастре недвижимости Военно-патриотическое воспитание
Военно-патриотическое воспитание Сколиоз
Сколиоз Рекламная кампания
Рекламная кампания Чередующиеся гласные в корне слова
Чередующиеся гласные в корне слова Судебная власть
Судебная власть The museum. Услуги
The museum. Услуги