Содержание
- 2. Содержание Актуальность исследования Цель и задачи Материалы и методы Результаты Выводы V V V V V
- 3. Актуальность темы Свободные радикалы неминуемо образуются в клетке в процессе жизнедеятельности и, присутствуя в живых системах,
- 4. Цели и задачи Цель настоящей работы: изучение антиоксидантных и прооксидантных свойств структурно близких флавоноидов в процессах,
- 5. Материалы и методы В работе использовались следующие вещества и ферменты: 3,3’,5,5’-тераметилбензидин, кверцетин, гесперетин, эпикатехин, лецитин соевый
- 6. Основная часть Общая структура флавоноидов Флавоноиды – это фенольные соединения, широко распространённые в природе. Общая структура
- 7. Механизмы антиоксидантной активности флавоноидов могут быть следующие : Подавление формирования активных форм кислорода путем ингибирования ферментов
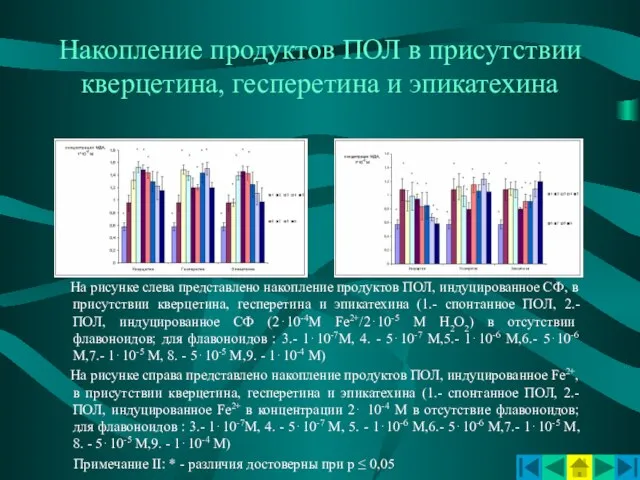
- 8. Накопление продуктов ПОЛ в присутствии кверцетина, гесперетина и эпикатехина На рисунке слева представлено накопление продуктов ПОЛ,
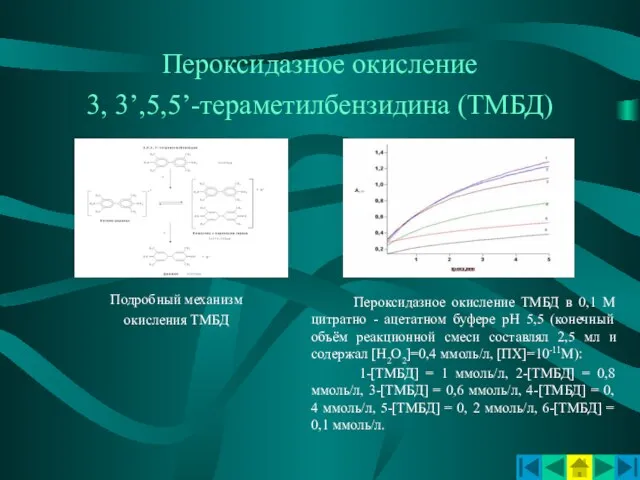
- 9. Пероксидазное окисление 3, 3’,5,5’-тераметилбензидина (ТМБД) Подробный механизм окисления ТМБД
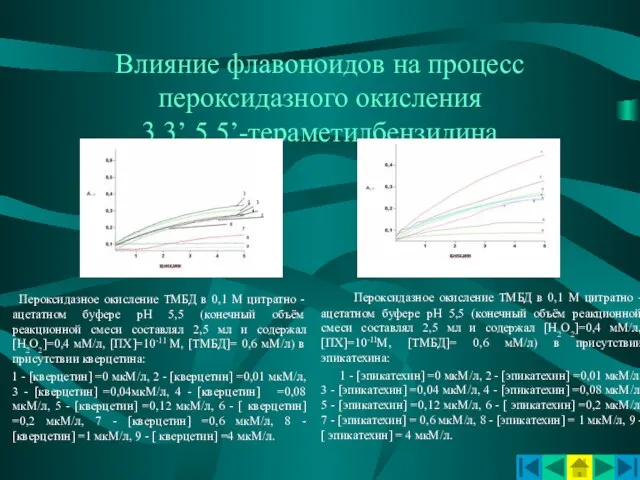
- 10. Влияние флавоноидов на процесс пероксидазного окисления 3,3’,5,5’-тераметилбензидина Пероксидазное окисление ТМБД в 0,1 М цитратно - ацетатном
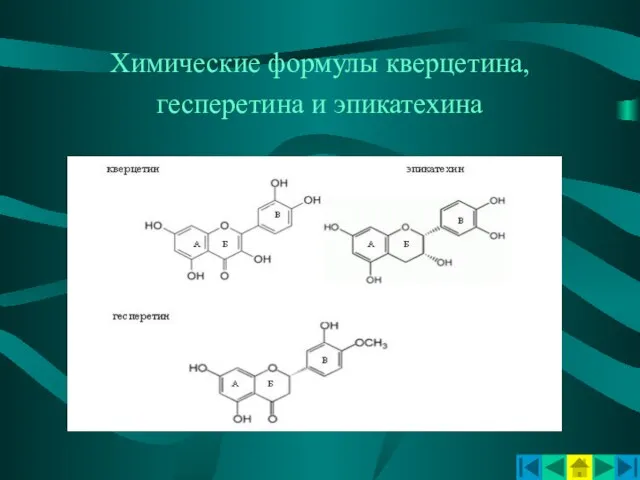
- 11. Химические формулы кверцетина, гесперетина и эпикатехина
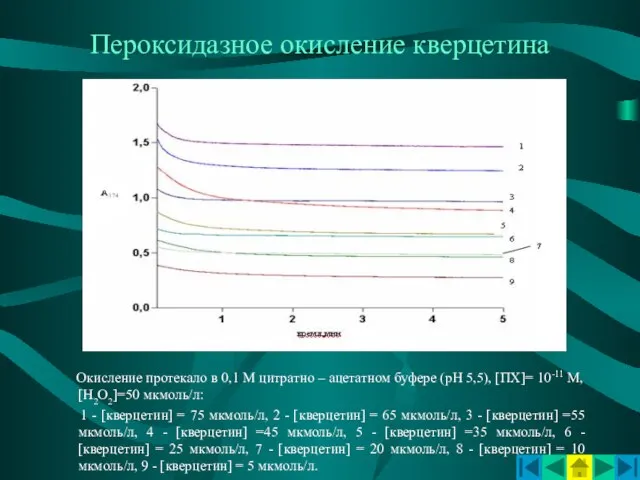
- 12. Пероксидазное окисление кверцетина Окисление протекало в 0,1 М цитратно – ацетатном буфере (рН 5,5), [ПХ]= 10-11
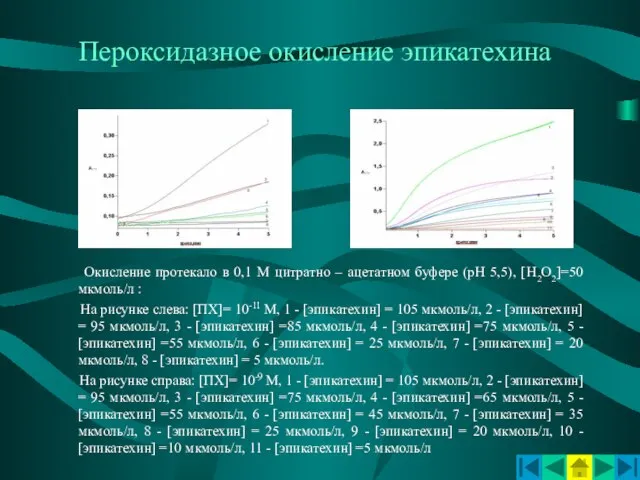
- 13. Пероксидазное окисление эпикатехина Окисление протекало в 0,1 М цитратно – ацетатном буфере (рН 5,5), [Н2О2]=50 мкмоль/л
- 14. Электрофореграмма ДНК фага λ, инкубированной в системе пероксидазного окисления о-дианизидина Электрофореграмма ДНК фага λ, инкубированной в
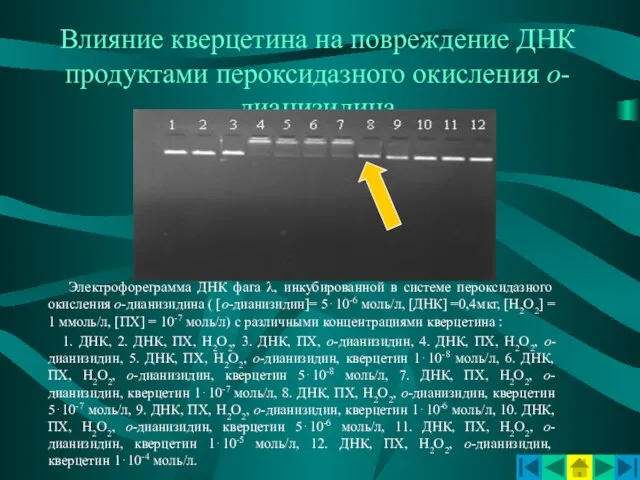
- 15. Влияние кверцетина на повреждение ДНК продуктами пероксидазного окисления о-дианизидина Электрофореграмма ДНК фага λ, инкубированной в системе
- 16. Влияние эпикатехина на повреждение ДНК продуктами пероксидазного окисления о-дианизидина Электрофореграмма ДНК фага λ, инкубированной в системе
- 17. Влияние гесперетина на повреждение ДНК продуктами пероксидазного окисления о-дианизидина Электрофореграмма ДНК фага λ, инкубированной в системе
- 18. Выводы Было показано, что в процессе перекисного окисления лецитина, индуцированного системой Фентона ([Fe2+]= 2⋅10-4 моль/л, ([Н2О2]=
- 19. Показано, что кверцетин и эпикатехин в концентрациях 1 мкмоль/л и 4 мкмоль/л проявляют антиоксидантные свойства в
- 20. Установлено, что все три флавоноида – кверцетин, эпикатехин и гесперетин - проявляют антиоксидантные свойства и ингибируют
- 22. Скачать презентацию












 Художественный мир и его компоненты
Художественный мир и его компоненты Оформление и дизайн
Оформление и дизайн prezentatsia_menedzhment (1)
prezentatsia_menedzhment (1) Презентация на тему Военные профессии в стихах и картинках
Презентация на тему Военные профессии в стихах и картинках Личность. Темперамент. Характер. Презентация
Личность. Темперамент. Характер. Презентация Ley de Propiedad Horizontal (LPH)
Ley de Propiedad Horizontal (LPH) Презентация на тему Повышение конкурентоспособности предприятия
Презентация на тему Повышение конкурентоспособности предприятия Как организовать школьный пресс-центр
Как организовать школьный пресс-центр Гондурас
Гондурас Тема 5. Международные морские перевозки грузов
Тема 5. Международные морские перевозки грузов Деньги их функции и виды
Деньги их функции и виды Жестокое обращение с ребенком
Жестокое обращение с ребенком РЕГУЛИРОВАНИЕ КАЧЕСТВА УСЛУГ В ОБЛАСТИ ЭЛЕКТРОЭНЕРГИИ В ИТАЛИИ
РЕГУЛИРОВАНИЕ КАЧЕСТВА УСЛУГ В ОБЛАСТИ ЭЛЕКТРОЭНЕРГИИ В ИТАЛИИ DER VOGEL
DER VOGEL 20.02.2012 года в старшей группе»Смородинка» прошел конкурс «Все дело в шляпе!»
20.02.2012 года в старшей группе»Смородинка» прошел конкурс «Все дело в шляпе!» Экономическое устройство России
Экономическое устройство России «Спасибо за жизнь!»
«Спасибо за жизнь!» Презентация на тему Петровские реформы
Презентация на тему Петровские реформы Эмпирическая методология. Научный метод и исследовательское мышление
Эмпирическая методология. Научный метод и исследовательское мышление О РАЗРАБОТКЕ СТАНДАРТОВ, ОБЕСПЕЧИВАЮЩИХ РЕАЛИЗАЦИЮ ПОСТАНОВЛЕНИЯ ПРАВИТЕЛЬСТВА РФ ОТ 31 ДЕКАБРЯ 2009 Г. № 1222
О РАЗРАБОТКЕ СТАНДАРТОВ, ОБЕСПЕЧИВАЮЩИХ РЕАЛИЗАЦИЮ ПОСТАНОВЛЕНИЯ ПРАВИТЕЛЬСТВА РФ ОТ 31 ДЕКАБРЯ 2009 Г. № 1222 Ведущая свадебных церемоний. Свадебная ведущая
Ведущая свадебных церемоний. Свадебная ведущая Как животные готовятся к зиме?
Как животные готовятся к зиме? Судебное разбирательство в первой инстанции
Судебное разбирательство в первой инстанции Показатели развития общей моторики малыша
Показатели развития общей моторики малыша Улица Панфилова
Улица Панфилова Киномания. Блиц
Киномания. Блиц Электронный университет КГЭУ - виртуальная образовательная среда
Электронный университет КГЭУ - виртуальная образовательная среда Семейство кошачьих
Семейство кошачьих