Содержание
- 2. H Cl = H+ + Cl – H2 SO 4 = 2 H+ + SO42- Кислоты
- 3. Состав кислот H Cl H2SO4 H3PO4 1. Кислоты – это простые или сложные вещества? 2. Что
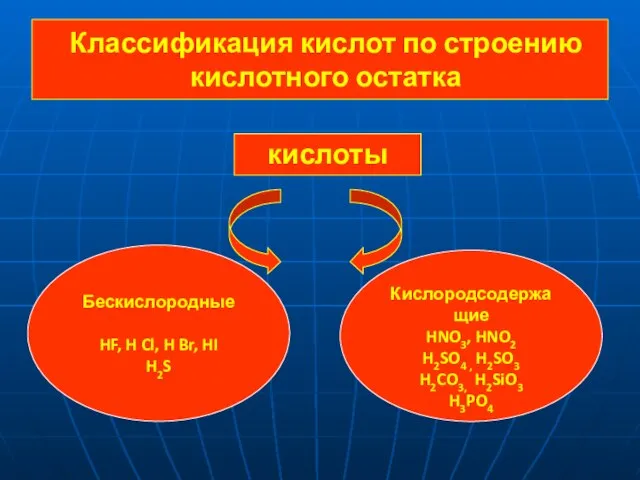
- 4. Классификация кислот по строению кислотного остатка кислоты Бескислородные HF, H Cl, H Br, HI H2S Кислородсодержащие
- 5. Нахождение кислот в природе Лимонная кислота содержится в лимонах, яблочная кислота - в яблоках, щавелевая кислота
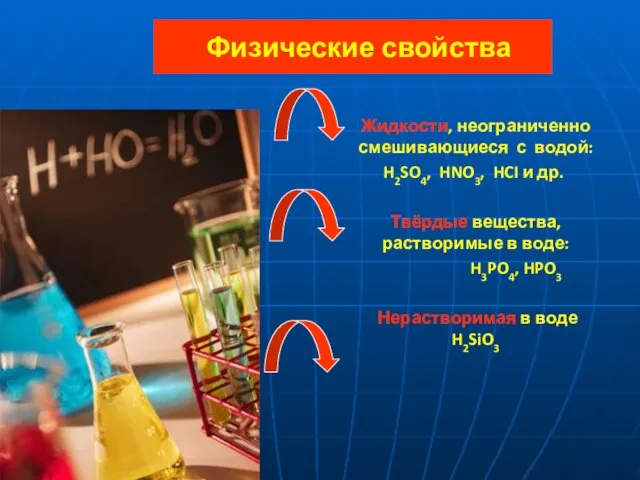
- 6. Физические свойства Жидкости, неограниченно смешивающиеся с водой: H2SO4, HNO3, HCI и др. Твёрдые вещества, растворимые в
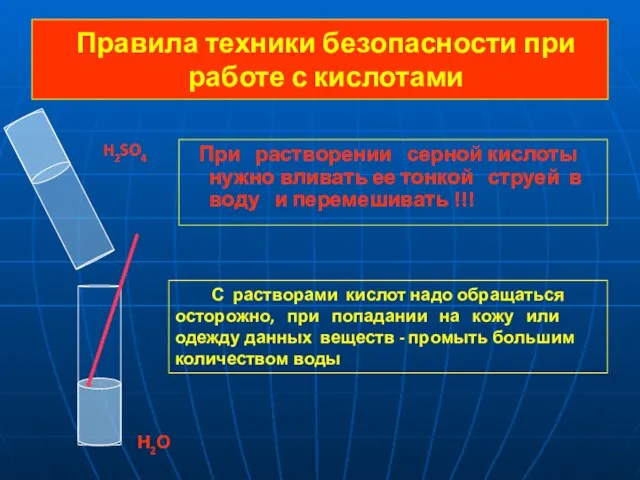
- 7. Правила техники безопасности при работе с кислотами При растворении серной кислоты нужно вливать ее тонкой струей
- 8. Действие кислот на растворы индикаторов фиолетовый красный оранжевый розовый лакмус метилоранж обусловлено наличием в них ионов
- 9. Взаимодействие кислот с металлами Zn + 2 HCI = ZnCI2 + H2 + Q Zn +2H+
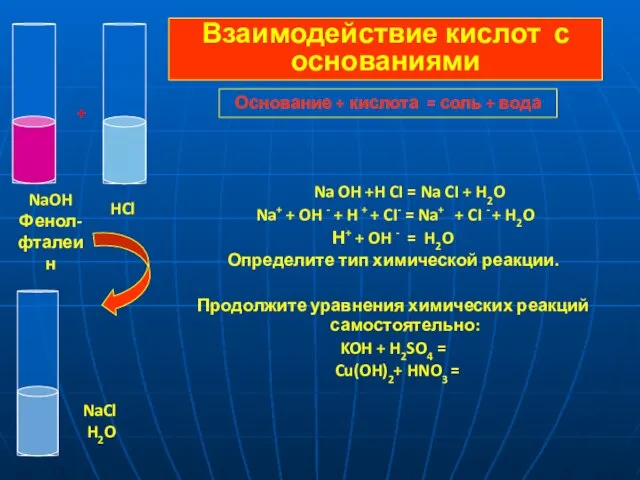
- 10. Na OH +H CI = Na CI + H2O Na+ + OH - + H +
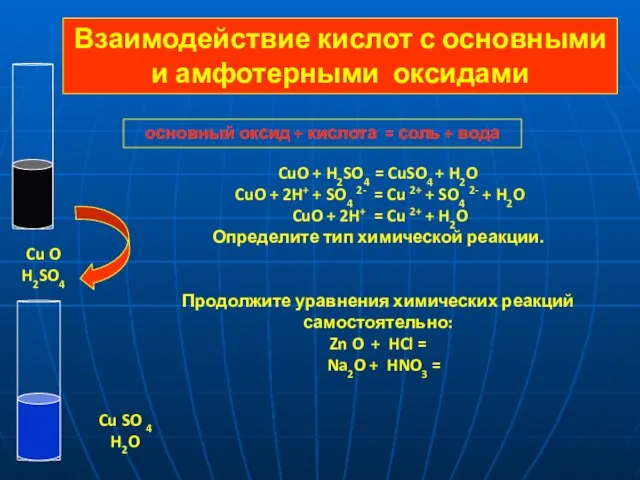
- 11. основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O CuO
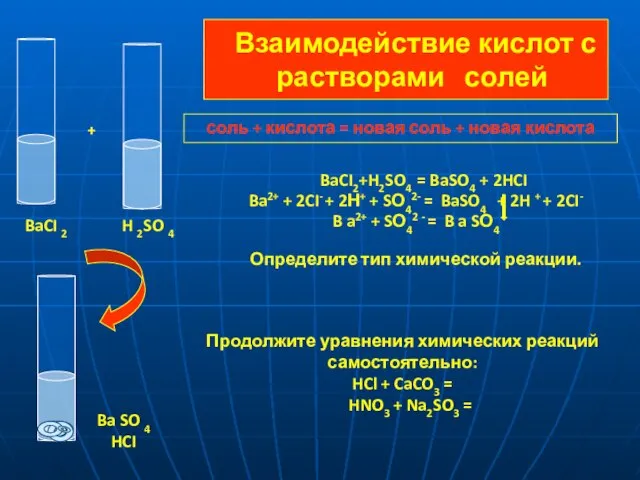
- 12. Взаимодействие кислот с растворами солей BaCI2+H2SO4 = BaSO4 + 2HCI Ba2+ + 2CI- + 2Н+ +
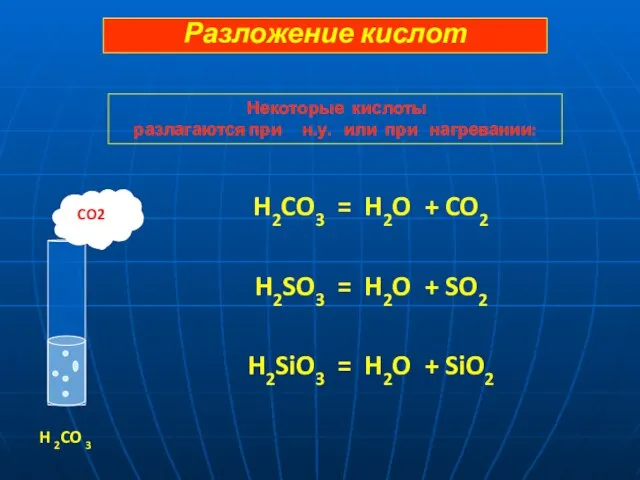
- 13. H2CO3 = H2O + CO2 H2SO3 = H2O + SO2 H2SiO3 = H2O + SiO2 CO2
- 14. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой: P2O5+ 3H2O = 2H3PO4 SO3 + H2O
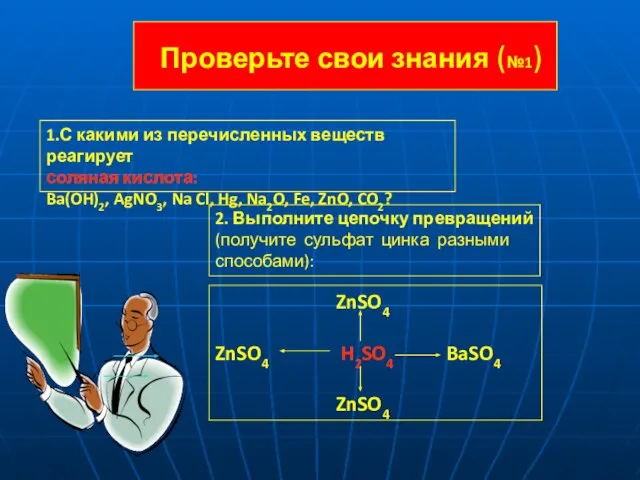
- 15. Проверьте свои знания (№1) 1.С какими из перечисленных веществ реагирует соляная кислота: Ba(OH)2, AgNO3, Na Cl,
- 17. Скачать презентацию






 Поколение молодости REV 7-2014
Поколение молодости REV 7-2014 Взаимодействие агентов в многоагентных системах
Взаимодействие агентов в многоагентных системах ФАКТОГРАФИЧЕСКИЕ БАЗЫ ДАННЫХ НАЦИОНАЛЬНОЙ БИБЛИОТЕКИ БЕЛАРУСИ КАК ИСТОЧНИК ИНФОРМАЦИИ О НАЦИОНАЛЬНЫХ ОБЪЕКТАХ Кузьминич Т. Нац
ФАКТОГРАФИЧЕСКИЕ БАЗЫ ДАННЫХ НАЦИОНАЛЬНОЙ БИБЛИОТЕКИ БЕЛАРУСИ КАК ИСТОЧНИК ИНФОРМАЦИИ О НАЦИОНАЛЬНЫХ ОБЪЕКТАХ Кузьминич Т. Нац Филиппова Елена Константиновна – учитель Филиппова Елена Константиновна – учитель русского языка и литературы Квалификационная
Филиппова Елена Константиновна – учитель Филиппова Елена Константиновна – учитель русского языка и литературы Квалификационная Новости недели. Новосибирск
Новости недели. Новосибирск Художники Сенгилеевского района
Художники Сенгилеевского района ПрезентацияРаздел 2.2
ПрезентацияРаздел 2.2 Международные модели управления персоналом
Международные модели управления персоналом Цели внедрения системы бюджетирования
Цели внедрения системы бюджетирования Деление плоскости на четыре части, в зарисовке
Деление плоскости на четыре части, в зарисовке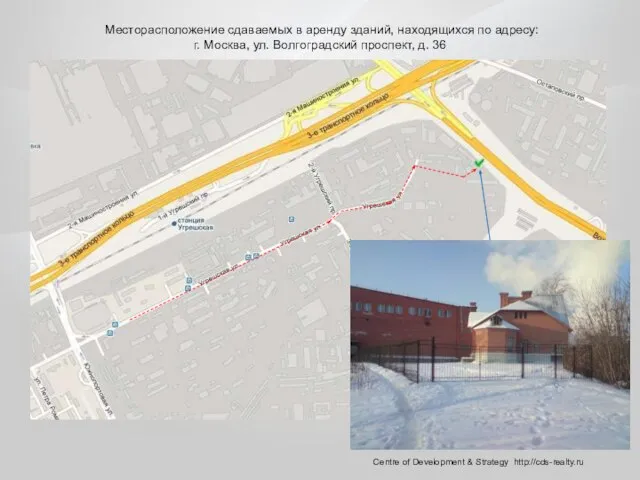 Месторасположение сдаваемых в аренду зданий, находящихся по адресу: г. Москва, ул. Волгоградский проспект, д. 36
Месторасположение сдаваемых в аренду зданий, находящихся по адресу: г. Москва, ул. Волгоградский проспект, д. 36 Филимоновская игрушка. Фотоотчет
Филимоновская игрушка. Фотоотчет Фридрих Шиллер
Фридрих Шиллер Презентация на тему Особые экономические зоны стран мира
Презентация на тему Особые экономические зоны стран мира  Фотоэлектрические модули. (Лекция 5)
Фотоэлектрические модули. (Лекция 5) The Victorian Era 1837 -1901
The Victorian Era 1837 -1901 Династический кризис 1825 г. Выступление декабристов
Династический кризис 1825 г. Выступление декабристов ВЕЛИКАЯ ОТЕЧЕСТВЕННАЯ ВОЙНА СОВЕТСКОГО СОЮЗА.
ВЕЛИКАЯ ОТЕЧЕСТВЕННАЯ ВОЙНА СОВЕТСКОГО СОЮЗА. Электронное взаимодействие между организациями ислужбой занятости населения
Электронное взаимодействие между организациями ислужбой занятости населения Порядок подачи заявления о преступлении
Порядок подачи заявления о преступлении Избушка
Избушка Сказочный мир Шарля Перро
Сказочный мир Шарля Перро ПОП-АРТ
ПОП-АРТ Осенние поделки
Осенние поделки Управление эмоциями
Управление эмоциями КОТЕЛЬНАЯ 4 Х 15 МВт
КОТЕЛЬНАЯ 4 Х 15 МВт Основные этапы разработки ООП
Основные этапы разработки ООП «Свирель серебряного века»
«Свирель серебряного века»