Содержание
- 2. Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с образованием катионов водорода
- 3. Классификация кислот
- 4. Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с основаниями; Взаимодействие с
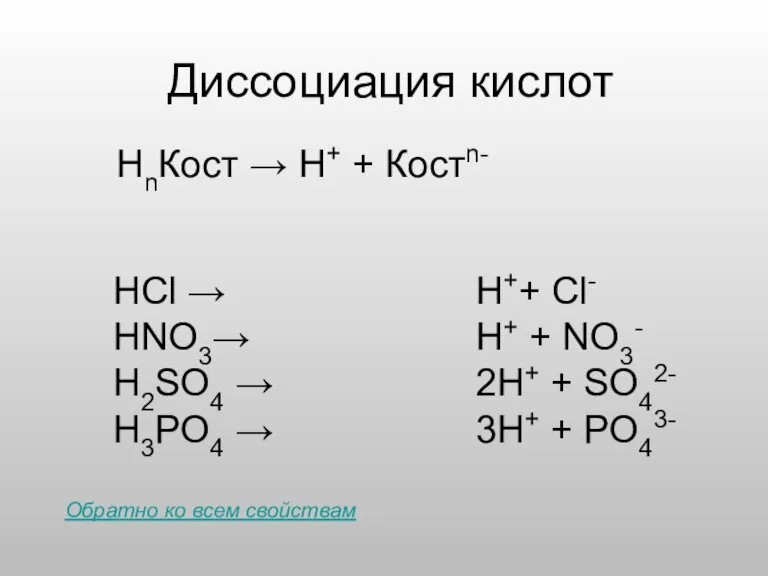
- 5. Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl-
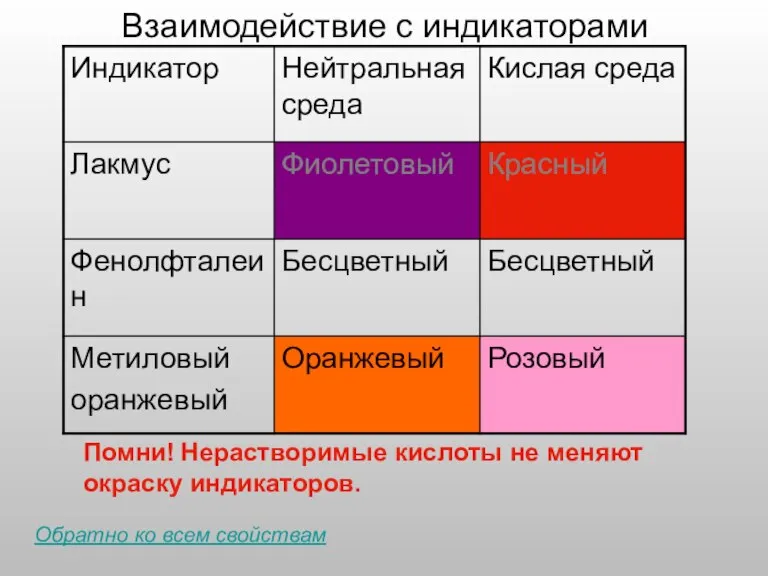
- 6. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов. Обратно ко всем свойствам
- 7. Взаимодействие с металлами Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al
- 8. Взаимодействие с основными оксидами МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота →
- 9. Взаимодействие с основаниями Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль +
- 10. Взаимодействие с солями МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота
- 11. Лимонная кислота содержится в лимонах. Яблочная- в яблоках. Щавелевая - в листьях щавеля. Муравьиная содержится в
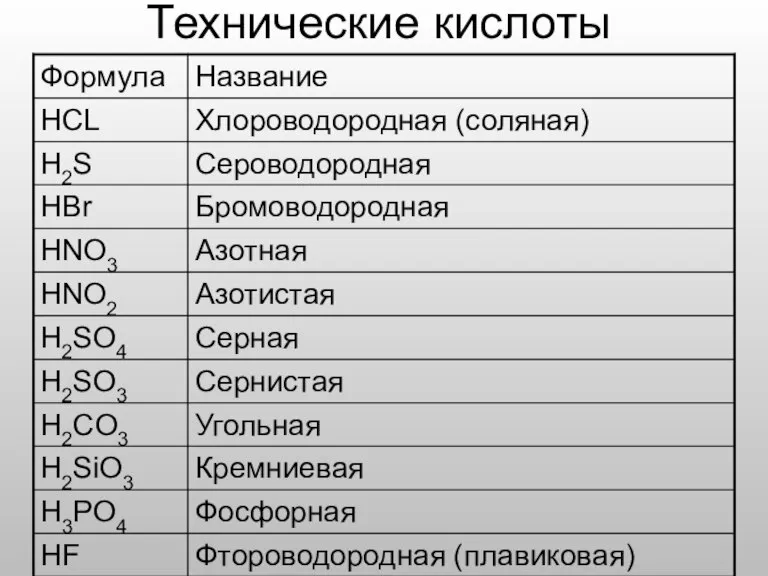
- 12. Технические кислоты
- 13. Представители кислот Серная кислота Н2SО4 бесцветная вязкая жидкость, без запаха ,вдвое тяжелее воды, поглощает влагу из
- 14. Соляная кислота Бесцветная, дымящаяся на воздухе жидкость, имеет специфический запах, несколько тяжелее воды. Содержится в желудке
- 15. Немного загадок) нажмите! А точнее сказать одна!
- 16. Ну что ему та кислота? Как минеральная вода! Сто двадцать дней в ней просидел, Ни капли
- 17. ТИТАН
- 19. Скачать презентацию













 Для чего нам фитнес?
Для чего нам фитнес? Пищевые связи
Пищевые связи Японское чаепитие
Японское чаепитие Кафедры оптической физики и современного естествознания Санкт-Петербург 2011г.
Кафедры оптической физики и современного естествознания Санкт-Петербург 2011г. Элементы психологического воздействия 2
Элементы психологического воздействия 2 «Говорящие» находки
«Говорящие» находки Проектная деятельность учащихся на уроках физики и астрономии
Проектная деятельность учащихся на уроках физики и астрономии Четыре живописца
Четыре живописца Новые оттенки Revlonissimo
Новые оттенки Revlonissimo Проектная деятельность как средство формирования метапредметных умений и навыков
Проектная деятельность как средство формирования метапредметных умений и навыков Программа: фотограф. Настройки фотоаппарата
Программа: фотограф. Настройки фотоаппарата Новое видение. Конфликт
Новое видение. Конфликт Масса тела. Плотность вещества
Масса тела. Плотность вещества Преимущества электронных ресурсов EBSCO для академических библиотек
Преимущества электронных ресурсов EBSCO для академических библиотек Правила использования лого ФЦК_спецодежда
Правила использования лого ФЦК_спецодежда Внедрение системы SAP в «Техносиле»
Внедрение системы SAP в «Техносиле» Новые технологии при тестоведении
Новые технологии при тестоведении Презентация на тему "Школьная система специального образования" - скачать презентации по Педагогике
Презентация на тему "Школьная система специального образования" - скачать презентации по Педагогике Загадки трудных слов
Загадки трудных слов  История российской благотворительностив документах Российского государственного исторического архива
История российской благотворительностив документах Российского государственного исторического архива Психология больших социальных групп
Психология больших социальных групп Как даются географические названия
Как даются географические названия  Изобразительное искусство реализма
Изобразительное искусство реализма Гелевая линия.
Гелевая линия. Внедрение ПЭУ в Узбекистане
Внедрение ПЭУ в Узбекистане Здоровые интимные отношения и способы их построения
Здоровые интимные отношения и способы их построения Дієслово. Діагностувальна робота
Дієслово. Діагностувальна робота Материаловедение. Классификация текстильных волокон
Материаловедение. Классификация текстильных волокон