Слайд 2Цели урока.
Познакомить учащихся с составом, названиями, классификацией и представителями класса кислот.
Продолжить знакомство

со сложными ионами на примере кислотных остатков кислородных кислот.
Продолжить формирование знаний о различиях между зарядами ионов и с.о. элементов, об индикаторах.
Слайд 3Актуализация опорных ЗУНов.
Что называется основаниями?
Какие реакции называются качественными?
Как изменяют окраску индикаторы в

щелочной среде?
Работа по группам:
1 группа – проверочная робота по теме «Основания».
2 группа – по учебнику выполнить упр 4, 6 стр. 70.
Слайд 4Развитие новых ЗУНов
Попробуйте кристаллики лимонной кислоты на вкус.
Он кислый, отсюда

и название класса (кислоты).
Но ни один химик и не один грамотный человек даже и не подумает распознавать таким образом кислоты –это может быть смертельно опасно!
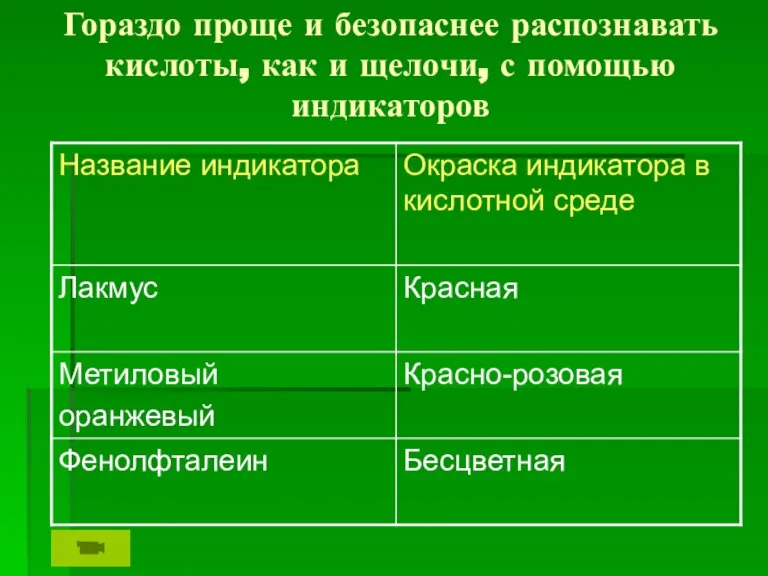
Слайд 5Гораздо проще и безопаснее распознавать кислоты, как и щелочи, с помощью индикаторов
Слайд 6Кислоты
HCL – хлороводородная (соляная)
HNO3 - азотная
HNO2 - азотистая
H2SO4 - серная
H2SO3 - сернистая
H2S

- сероводородная
H3PO4 - фосфорная
H2CO3 - угольная
H2SiO3 - кремниевая
HBr - бромоводородная
HI - иодоводородная
HF – фтороводородная (плавиковая)
Слайд 7Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и

кислотных остатков
Слайд 8Классификация кислот
По числу атомов водорода:
а) одноосновные – HCL, HNO3, HNO2, HBr, HI,
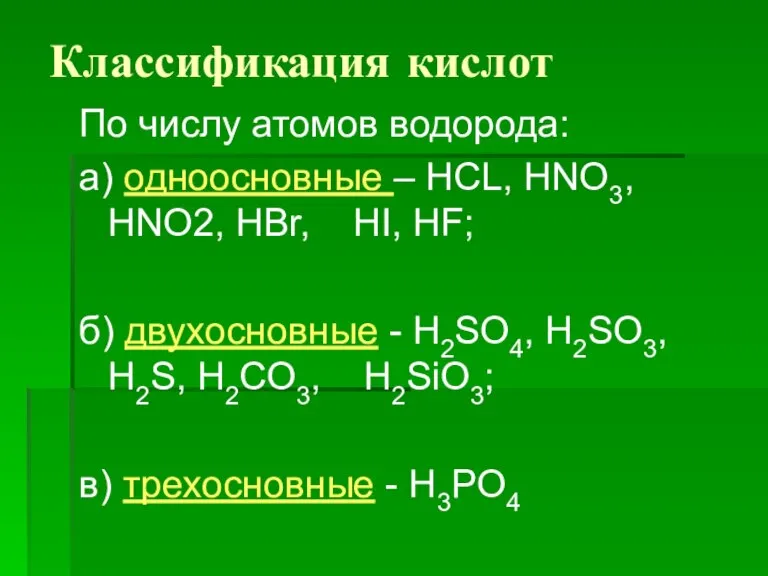
HF;
б) двухосновные - H2SO4, H2SO3, H2S, Н2CO3, H2SiO3;
в) трехосновные - H3PO4
Слайд 9 По наличию атомов кислорода в кислотных остатках:
а) кислородсодержащие - HNO3, HNO2,

H2SO4, H2SO3, Н2CO3, H3PO4, H2SiO3;
б) бескислородные - HCL, HBr, H2S.
Слайд 10По признаку растворимости:
а) растворимые - HNO3, HNO2, H2SO4, H2SO3, Н2CO3, H3PO4,

HCL, HBr, H2S;
б) нерастворимые - H2SiO3.
Слайд 11Степени окисления элементов и заряды ионов кислот
Кислоты это своеобразный мостик, который связывает

полярную ковалентную связь с ионной.
В растворах между водородом и кислотным остатком ковалентная связь переходит в ионную.
Кислоты образуют ионы двух видов: простые – ионы водорода Н+ и сложные – ионы кислотного остатка (SO42-, NO3-, PO43-)
Слайд 12Отличия между степенью окисления и зарядом иона.
Число видов степени окисления элементов

в соединениях равно числу элементов в составе вещества, число видов ионов равно числу частей вещества. Так, для H2SO4:
а) заряды ионов H2+SO42-;
б) с.о. элементов H2+1S+6O42-.
Слайд 13Представители кислот.
Техника безопасности при работе с кислотами.
HCL – хлороводородная (соляная)
HNO3 – азотная
H2SO4

- серная
Слайд 14Развитие новых ЗУНов.
Определите для кислоты: а) заряды ионов; б) с.о. элементов; в)

соответствующий ей оксид.
2. Какое количество вещества содержится в













 Виктор Мойсеенко
Виктор Мойсеенко Тема урока: Коренной перелом в ходе Великой отечественной войны.
Тема урока: Коренной перелом в ходе Великой отечественной войны. Этот удивительный мир симметрии
Этот удивительный мир симметрии Один из моих любимых видов спорта - Лыжный
Один из моих любимых видов спорта - Лыжный Правила, которые следует помнить студенту
Правила, которые следует помнить студенту Презентация на тему День памяти Пушкина
Презентация на тему День памяти Пушкина Исихиастические учения
Исихиастические учения Сенсуализм Джона Локка
Сенсуализм Джона Локка Цифровая трансформация. Цифровой бизнес
Цифровая трансформация. Цифровой бизнес Возможные пути получения профессии
Возможные пути получения профессии Лучшая практика: проект по открытию IT классов на базе детских садов и школ
Лучшая практика: проект по открытию IT классов на базе детских садов и школ Магазин Медкнига и медодежда
Магазин Медкнига и медодежда ABBYY TestReaderDesktop
ABBYY TestReaderDesktop Отчет председателя правления
Отчет председателя правления Спортивный туризм Руководитель: Гусева Ю.В.
Спортивный туризм Руководитель: Гусева Ю.В. Презентация на тему Основы оказания первой помощи при переломах 7 класс
Презентация на тему Основы оказания первой помощи при переломах 7 класс  VIP-стажировки. Программа развития карьеры
VIP-стажировки. Программа развития карьеры Военно-специальная подготовка
Военно-специальная подготовка Pravki_illyustrator
Pravki_illyustrator Практика строительства лесных дорог постоянного действия. Динамика ценообразования лесоматериалов на примере ОАО Группа Илим
Практика строительства лесных дорог постоянного действия. Динамика ценообразования лесоматериалов на примере ОАО Группа Илим Достопримечательности Южно – Зауральского края. Определите по описанию.
Достопримечательности Южно – Зауральского края. Определите по описанию. Русские фразеологизмы
Русские фразеологизмы 3 Электрические разряды и их использование в электротехнологиях
3 Электрические разряды и их использование в электротехнологиях Почему донорство полезно?
Почему донорство полезно?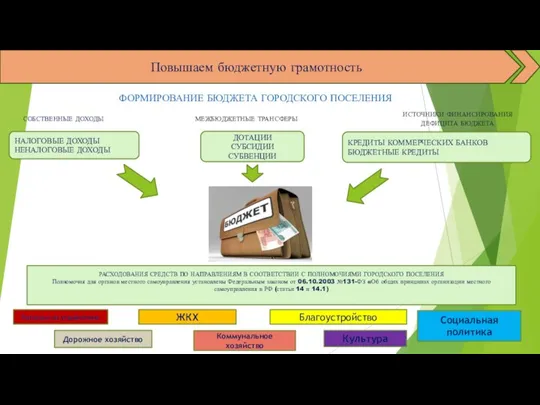 Повышаем бюджетную грамотность
Повышаем бюджетную грамотность Организация исследовательской деятельности в
Организация исследовательской деятельности в Presentation Title
Presentation Title  Уголь – черное золото Земли
Уголь – черное золото Земли