Содержание
- 2. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ R – X + Y → R – Y
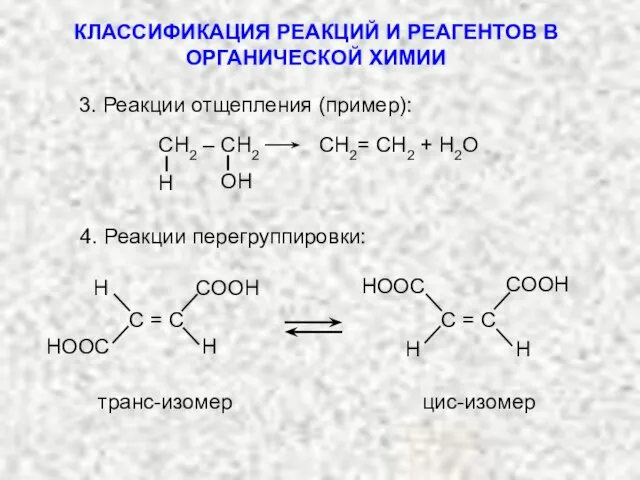
- 3. СН2 – СН2 СН2= СН2 + H2O 4. Реакции перегруппировки: транс-изомер цис-изомер 3. Реакции отщепления (пример):
- 4. Реакции замещения характерны для всех классов органических соединений. Реакции присоединения характерны только для соединений с кратной
- 5. ТИПЫ РЕАГЕНТОВ: 1. Электрофильные (Е+). 2. Нуклеофильные (Nu-). 3. Радикальные (R∙). КЛАССИФИКАЦИЯ РЕАКЦИЙ II. по электронной
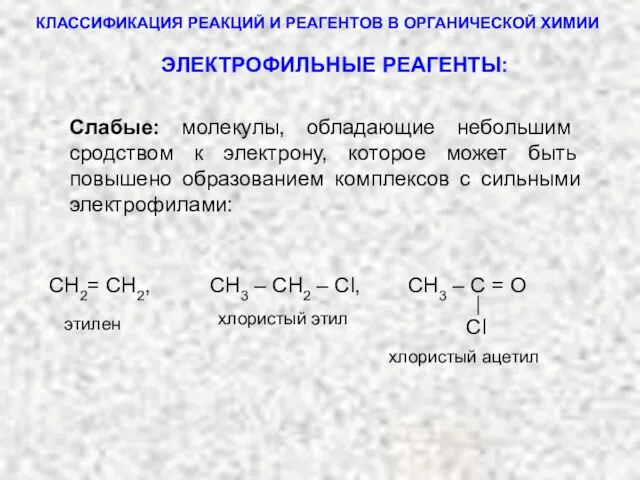
- 6. 1. ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ (электрофилы) Электрофилы можно подразделить на сильные и слабые: Электрофилы – это частицы, обладающие
- 7. ТИПЫ РЕАГЕНТОВ Сильные: H+, Me+, HgCl+, FeCl2+, AlCl3 , FeBr3, SbCl5, BF3, ZnCl2 и другие частицы,
- 8. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ Сl СН2= СН2, СН3 – СН2 – Cl, СН3
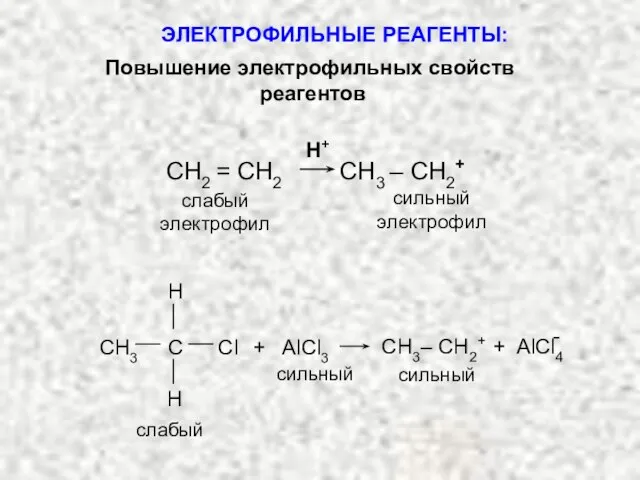
- 9. СН2 = СН2 СН3 – СН2+ Н+ - слабый электрофил С H H CН3 Cl +
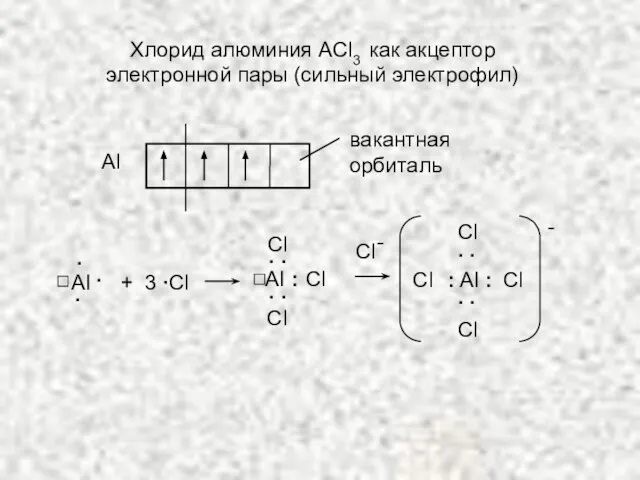
- 10. Аl вакантная орбиталь AI . . . + 3 ∙Сl Сl AI : . . .
- 11. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ Сильные нуклеофилы: к ним относятся :ОН− , анионы с
- 12. К ним относятся анионы, являющиеся остатками сильных кислот: Сl− , Br−, HSO3−, NO3−, CNS−, H2PO42− и
- 13. Классификация реакций и реагентов в органической химии Как видно из рассмотренных примеров, нуклеофилы в то же
- 14. Нуклеофильность зависит от электронной плотности на атакуемом атоме. Нуклеофильность – это функция зависящая от основности и
- 15. 2. Если нуклеофильные центры разные, то в этом случае нуклеофильность будет функцией поляризуемости, на пример, в
- 16. ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ РЕАКЦИЙ (ИНТЕРМЕДИАТЫ) Ионы – частицы, несущие электрический заряд; их два сорта: Карбкатионы – органические
- 17. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ МЕТОДЫ ГЕНЕРИРОВАНИЯ (ОБРАЗОВАНИЯ) ИОНОВ И РАДИКАЛОВ: (X = F,
- 18. III. КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО МЕХАНИЗМУ ЭЛЕМЕНТАРНЫХ СТАДИЙ Это наиболее сложный тип, классифицирующий реакции. Он соответствует двум
- 19. Гомологический (радикальный) разрыв ковалентной связи: А : В А• + •В радикалы Из схемы видно, что
- 20. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ Реагенты, в органической химии, вступающие в реакцию, подразделяют на
- 21. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ IV. Классификация реакций по частным признакам. Реакции называют в
- 22. ПО МЕХАНИЗМУ РЕАКЦИЙ. Под механизмом реакций понимают реальный путь, то которому протекает реакция. Реакция может протекать
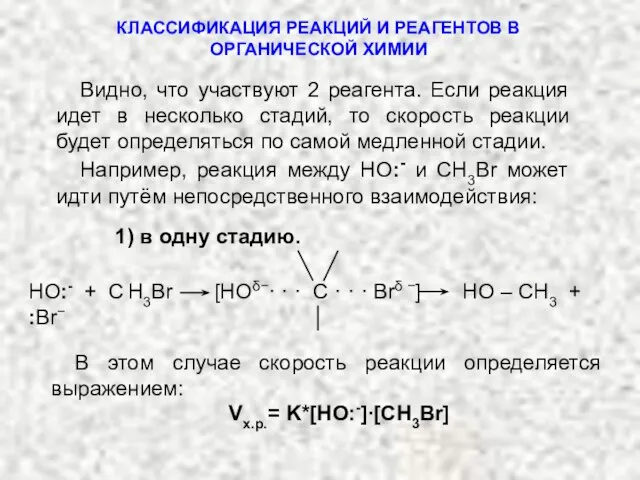
- 23. Видно, что участвуют 2 реагента. Если реакция идет в несколько стадий, то скорость реакции будет определяться
- 24. 2) Или в две стадии. В этом случае скорость реакции будет задаваться выражением: Vх.р.= K∙[ СН3Br]
- 25. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ End
- 27. Скачать презентацию



















 Активизация деятельности учащихся с помощью интерактивных технологий
Активизация деятельности учащихся с помощью интерактивных технологий ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ
ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ Грибы. Общая характеристика грибов. Шляпочные грибы
Грибы. Общая характеристика грибов. Шляпочные грибы Правила устройства и безопасной эксплуатации сосудов, работающих под давлением
Правила устройства и безопасной эксплуатации сосудов, работающих под давлением Санкт-Петербургский государственный университетинформационных технологий, механики и оптики
Санкт-Петербургский государственный университетинформационных технологий, механики и оптики Геометрия корпуса судна
Геометрия корпуса судна Ознакомление с технологией изготовления витража
Ознакомление с технологией изготовления витража Достопримечательности Зарубежной Азии - Япония
Достопримечательности Зарубежной Азии - Япония Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека
Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека УСТРОЙСТВА ПЛАВНОГО ПУСКА
УСТРОЙСТВА ПЛАВНОГО ПУСКА Презентация на тему Теллур
Презентация на тему Теллур  Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны
Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны Художник в театре
Художник в театре VoevodinskaiaIndustrijaMesa
VoevodinskaiaIndustrijaMesa Творческое объединение лего-мастерская Шелезяка. Робототехника
Творческое объединение лего-мастерская Шелезяка. Робототехника Александр Иванович Куприн
Александр Иванович Куприн Рассказ на свободную тему
Рассказ на свободную тему Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Дворцово-парковые ансамбли
Дворцово-парковые ансамбли Статистические методы в параметрическом анализе
Статистические методы в параметрическом анализе Параллельное и последовательное соединения проводников
Параллельное и последовательное соединения проводников Зерновые культуры (7 класс)
Зерновые культуры (7 класс) Ой, да Краснодарский край!
Ой, да Краснодарский край! Россия в условиях Первой мировой войны и общенационального кризиса
Россия в условиях Первой мировой войны и общенационального кризиса Кроссворд по сказкамГанса Христиана Андерсена
Кроссворд по сказкамГанса Христиана Андерсена Проект Free Way Кучер Максим Краснодар
Проект Free Way Кучер Максим Краснодар Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот
Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот ПФХД_Закуупки_Бухгалтерия
ПФХД_Закуупки_Бухгалтерия