Содержание
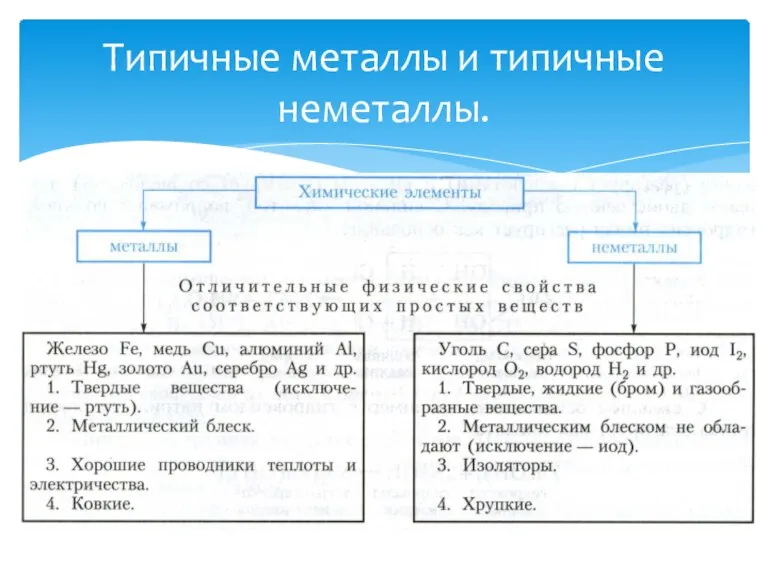
- 3. Типичные металлы и типичные неметаллы.
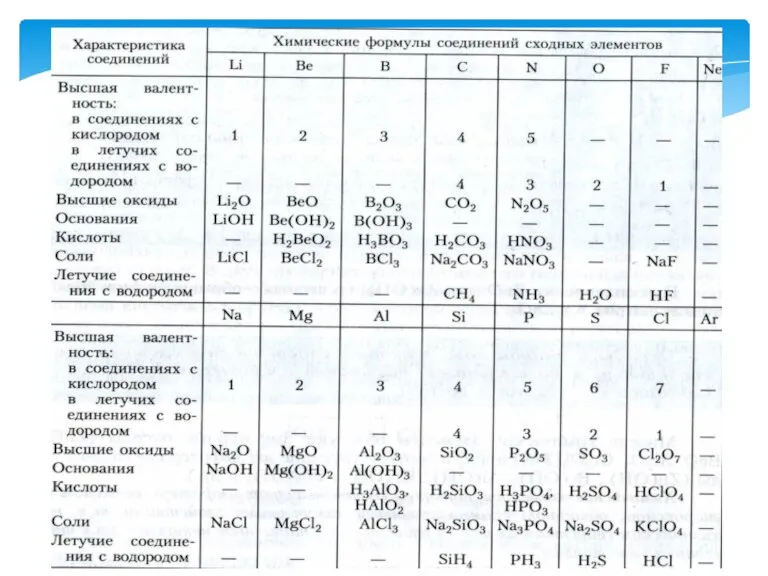
- 4. Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca +
- 5. Найди соответствие, для этого выбери каждому номеру букву верного утверждения: 1.Ртуть А. Твердое вещество 2.сера Б.
- 6. 1- Б, В, Ж. 2 – А, Д. 3 – А, Б, Г, Ж. 4 -
- 7. Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые
- 8. Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид
- 9. Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH
- 10. Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия Al2O3 + 6HNO3 =2 Al(NO3)3 +
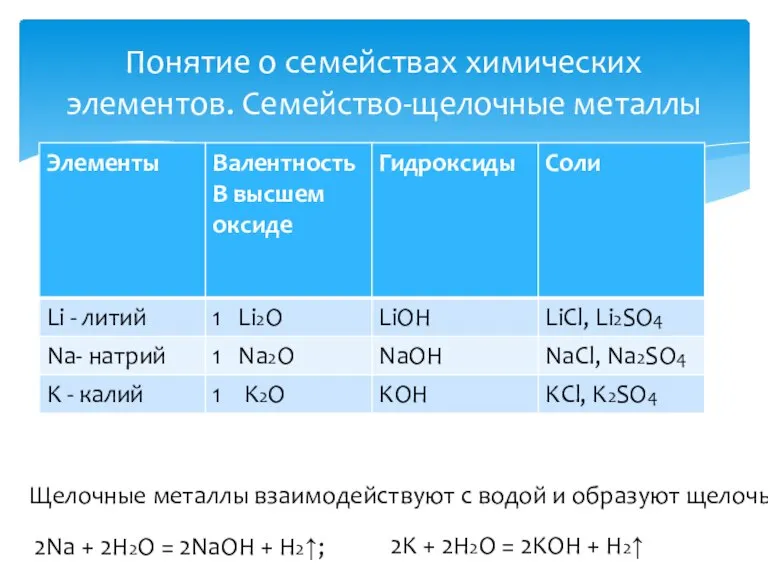
- 11. Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na
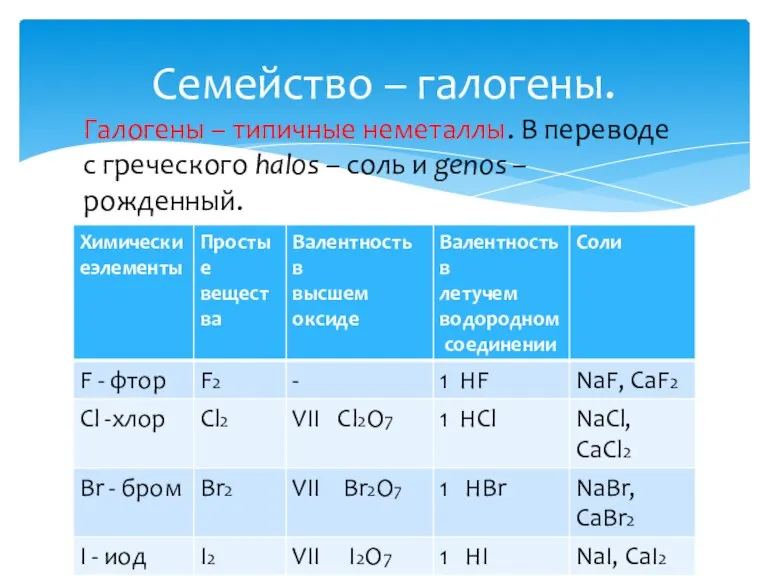
- 12. Семейство – галогены. Галогены – типичные неметаллы. В переводе с греческого halos – соль и genos
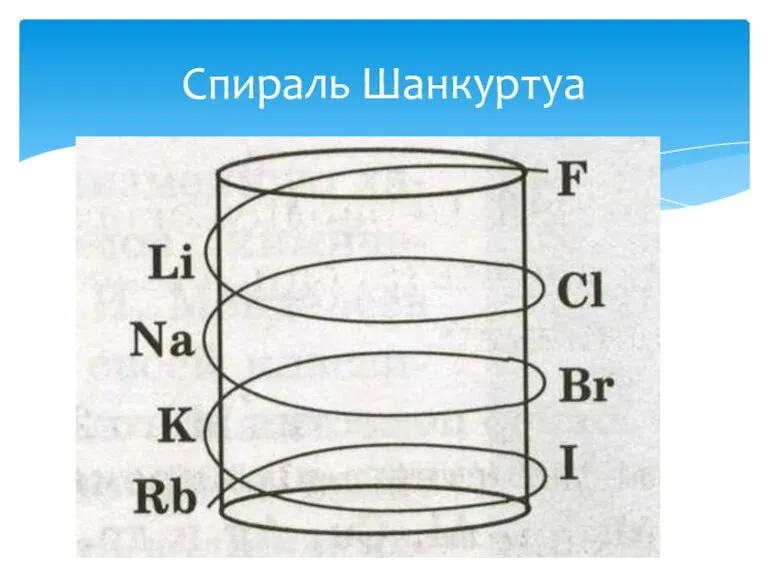
- 13. Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и
- 14. Спираль Шанкуртуа
- 15. Закон октав Дж. Ньюлендса
- 16. Триады Дёберейнера Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на
- 17. Таблица химических элементов Л. Мейера
- 21. С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si,
- 22. Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины
- 23. Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых
- 25. Скачать презентацию

















 Первый питательный крем от Anew - Ультра-Питание
Первый питательный крем от Anew - Ультра-Питание American Society Demographics
American Society Demographics  Презентация на тему Бородинская битва 4 класс
Презентация на тему Бородинская битва 4 класс Девиантное поведение
Девиантное поведение КУЛЬТУРА РОССИИ XIV — XVI ВЕКА
КУЛЬТУРА РОССИИ XIV — XVI ВЕКА Дефекты в кристаллах
Дефекты в кристаллах «Разработка Единой медицинской информационной системы на платформе 1С:Предприятие»
«Разработка Единой медицинской информационной системы на платформе 1С:Предприятие» Разработка и вывод на рынок аппарата плазменной коагуляции, на основе низкотемпературной плазмы
Разработка и вывод на рынок аппарата плазменной коагуляции, на основе низкотемпературной плазмы Презентация на тему Модест Петрович Мусоргский
Презентация на тему Модест Петрович Мусоргский Компьютерные вирусы
Компьютерные вирусы Дополнительные цвета
Дополнительные цвета Конституция Российской Федерации: государственные символы России
Конституция Российской Федерации: государственные символы России урок 15_ — копия _2_
урок 15_ — копия _2_ В землянке
В землянке Самсон
Самсон Моя наука
Моя наука Назарларыңызға әлемдегі 10 сәнді банкноттар жайлы
Назарларыңызға әлемдегі 10 сәнді банкноттар жайлы Французское искусство XVII века
Французское искусство XVII века Презентация на тему кпд тепловых двигателей 8 класс
Презентация на тему кпд тепловых двигателей 8 класс  Организационно-правовые основы деятельности первичной профсоюзной организации
Организационно-правовые основы деятельности первичной профсоюзной организации Кошки и собаки
Кошки и собаки Эффективное обшение
Эффективное обшение Права ребенка
Права ребенка Презентация на тему Природное и культурное наследие России
Презентация на тему Природное и культурное наследие России  Между парадигмами. Особенности исследования того, что еще не стало мейнстримом
Между парадигмами. Особенности исследования того, что еще не стало мейнстримом Культурология как наука
Культурология как наука Что изучает ФИЗИКА ?
Что изучает ФИЗИКА ? Звукопоглощающие материалы и конструкции
Звукопоглощающие материалы и конструкции