Содержание
- 2. Классификация неорганических веществ; Классификация оксидов; Получение оксидов; Получение пероксида водорода; Химические свойства пероксида водорода. Содержание:
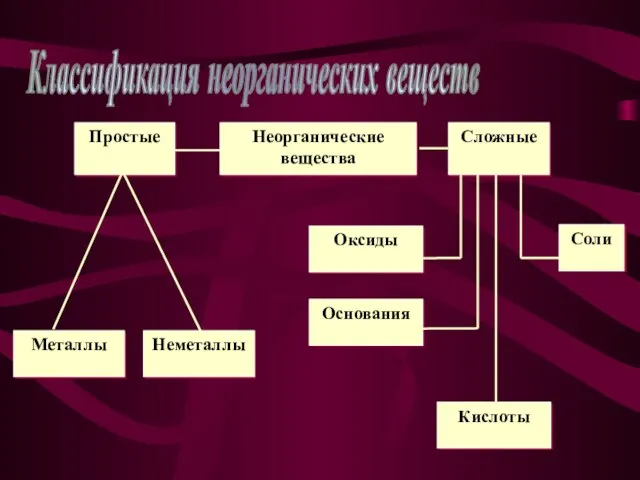
- 3. Классификация неорганических веществ
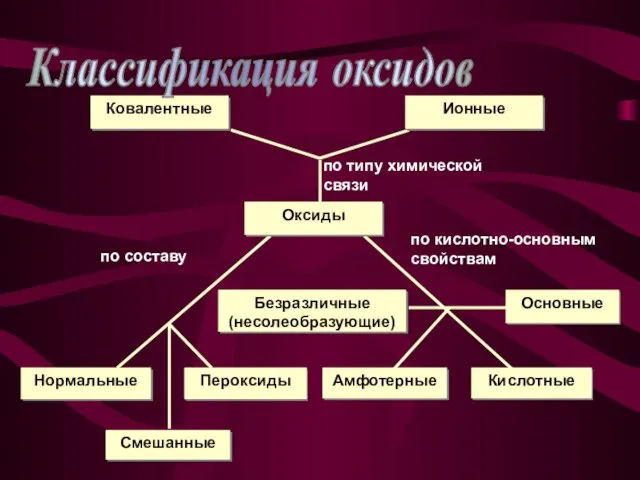
- 4. Классификация оксидов
- 5. Нормальные оксиды – оксиды, в которых есть только связи между кислородом и каким-нибудь элементом. Примеры: MgO,
- 6. Основные оксиды – оксиды, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют
- 7. Оксид хрома и периклаз
- 8. Циркон
- 9. Взаимодействие простых веществ с кислородом. Примеры: S + O2—› SO2; 4Al + 3O2 —› 2Al2O3; Термическое
- 10. Получение оксидов металлов (установка)
- 11. Взаимодействие пероксида бария с разбавленной серной кислотой. Примеры: BaO2 +H2SO4 —› BaSO4 + H2O2; Взаимодействие надсерной
- 12. Получение пероксида водорода
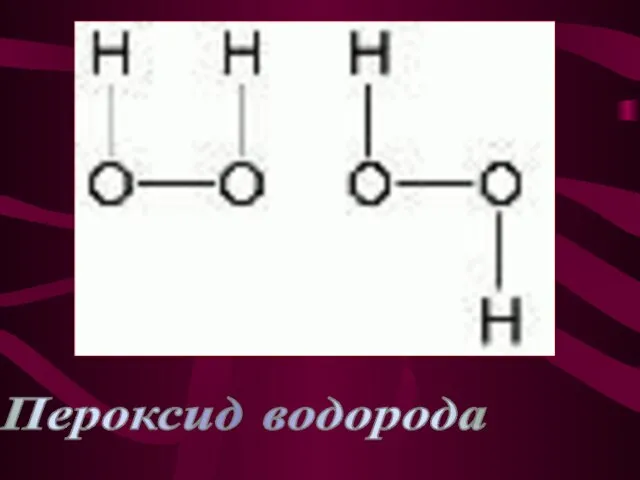
- 13. Пероксид водорода
- 14. Разложение. Пример: H2O —› H2O + 1/2O2; Окисление. Пример: PbS + 4H2O2 —› PbSO4 + 4H2O;
- 16. Скачать презентацию










 Правила перевозок железнодорожным транспортом подкарантинных грузов
Правила перевозок железнодорожным транспортом подкарантинных грузов Компетентностный подход в обучении
Компетентностный подход в обучении Равновесие реакции
Равновесие реакции Одна из достопримечательностей нашего города
Одна из достопримечательностей нашего города Презентация на тему Климат России Климатообразующие факторы
Презентация на тему Климат России Климатообразующие факторы Ячменев Александр Александрович
Ячменев Александр Александрович Крестовые походы
Крестовые походы Полиуретаны, силиконы
Полиуретаны, силиконы Система подготовки к ГИА по математике в 9 кл.
Система подготовки к ГИА по математике в 9 кл. Создание системы общественного экологического мониторингав Московской области
Создание системы общественного экологического мониторингав Московской области Arete outdoor centre
Arete outdoor centre Либеральные работы 60-70 годов 19 века
Либеральные работы 60-70 годов 19 века  На арене цирка
На арене цирка Средник для лучковой пилы
Средник для лучковой пилы Личная гигиена. Гигиена кожи, одежды.
Личная гигиена. Гигиена кожи, одежды. На сколько больше? На сколько меньше?
На сколько больше? На сколько меньше? Формирование ключевых компетентностей у учащихся в процессе преподавания математики с использованием И К Т
Формирование ключевых компетентностей у учащихся в процессе преподавания математики с использованием И К Т Холодные супы
Холодные супы Химический состав и свойства крови
Химический состав и свойства крови  Нарезание резьб плашками
Нарезание резьб плашками What king of sport is it?
What king of sport is it? 7. Монитор Хоара7.1. Общее описание
7. Монитор Хоара7.1. Общее описание Я-концепция как основа жизненного стиля
Я-концепция как основа жизненного стиля Лесные опасности
Лесные опасности Потребление воды и минеральных ресурсов
Потребление воды и минеральных ресурсов Чертежи деталей из сортового проката
Чертежи деталей из сортового проката Этические и правовые нормы информационной деятельности
Этические и правовые нормы информационной деятельности Универсальный гибридный вездеход Пионер-III для малого бизнеса (модель для трубопроводов)
Универсальный гибридный вездеход Пионер-III для малого бизнеса (модель для трубопроводов)