Содержание
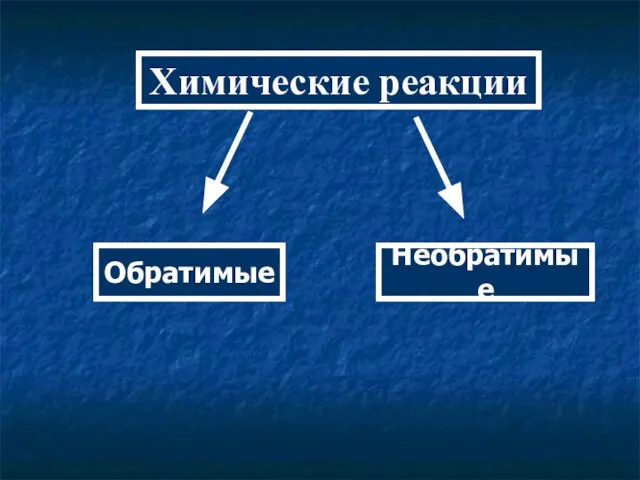
- 2. Химические реакции Обратимые Необратимые
- 3. Задание 1: Написать факторы, влияющие на скорость химических реакций
- 4. Задание 2 : Написать кинетические уравнения для химических реакций II вариант H2S + SO2 ⬄ S
- 5. Состояние системы, при котором скорость образования новых продуктов равна скорости их превращения в исходные вещества, называется
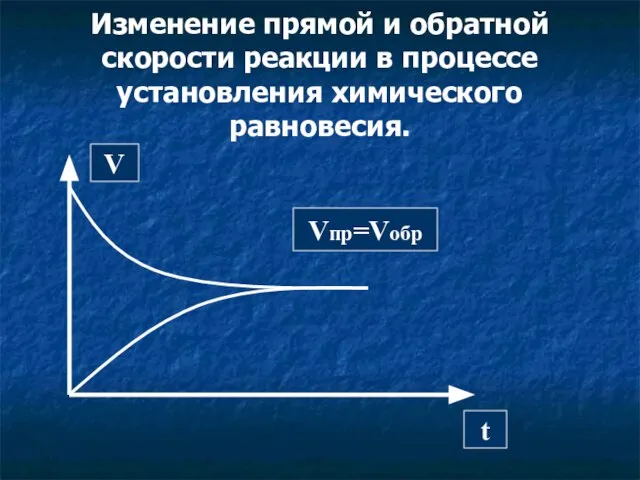
- 6. Изменение прямой и обратной скорости реакции в процессе установления химического равновесия. V t Vпр=Vобр
- 7. Равновесными концентрациями называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия
- 8. Константа равновесия – это отношение произведений концентраций продуктов реакций к произведению концентраций исходных веществ
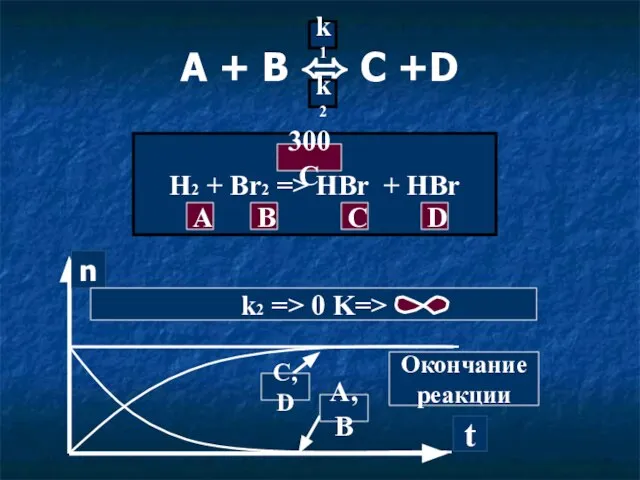
- 9. A + B ⬄ C +D k1 k2 H2 + Br2 => HBr + HBr A
- 10. K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 ⬄ HI + HI A B C
- 11. Условия смещения химического равновесия - принцип Ле - Шателье «Бегство от насилия»
- 12. Если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие, то оно благоприятствует протеканию такой реакции,
- 13. A + B ⬄ C + Q t+ t-
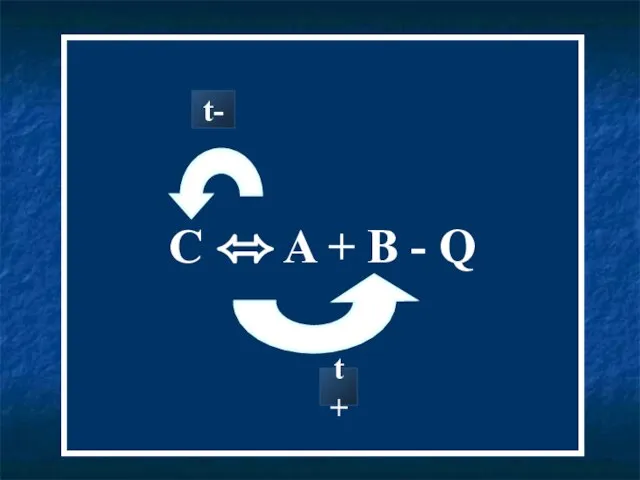
- 14. C ⬄ A + B - Q t- t+
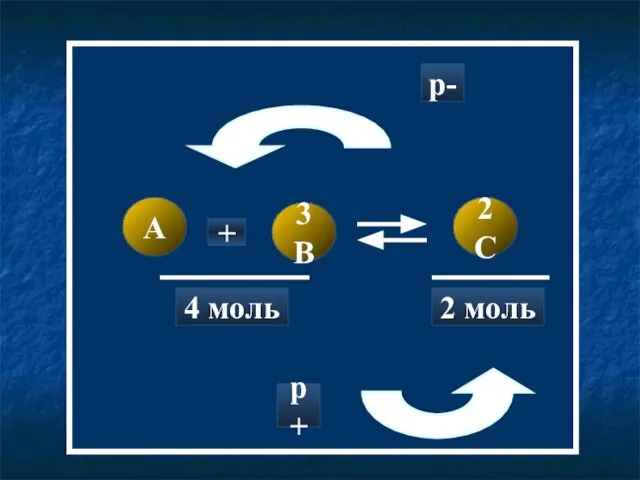
- 15. A 3B 2C + 4 моль 2 моль p- p+
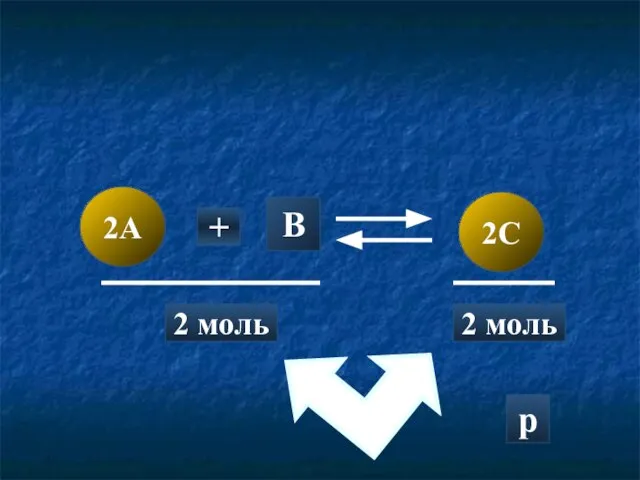
- 16. 2A 2C + B 2 моль 2 моль p
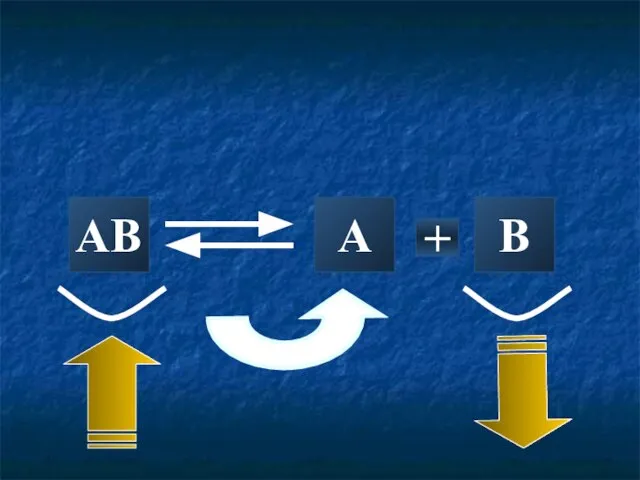
- 17. AB A + B
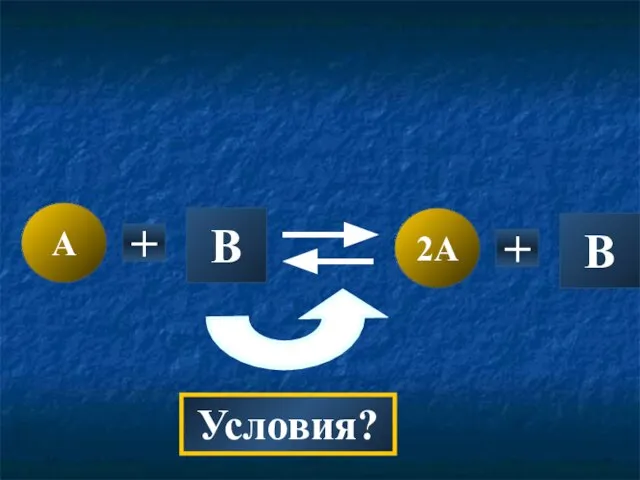
- 18. A 2A + B B + Условия?
- 20. Скачать презентацию





![K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 ⬄ HI +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/373075/slide-9.jpg)



 Центр образования,исследований и разработок «ИНО Томск’2020»
Центр образования,исследований и разработок «ИНО Томск’2020» London's architectural ensembles of the XI-XX centuries as the fixed music
London's architectural ensembles of the XI-XX centuries as the fixed music На зарядку становись!
На зарядку становись! Планы на счастье. Ведущая тренинга
Планы на счастье. Ведущая тренинга Культура и быт народов Северного Кавказа
Культура и быт народов Северного Кавказа Как слово наше отзовется
Как слово наше отзовется ПРИРОДНЫЕ ГЕПАТОПРОТЕКТОРЫ
ПРИРОДНЫЕ ГЕПАТОПРОТЕКТОРЫ g?c суперфрукт Содержит липокаротины tm
g?c суперфрукт Содержит липокаротины tm Стекло
Стекло Историческое культурное наследие Белгородской области в 19 веке
Историческое культурное наследие Белгородской области в 19 веке Презентация на тему Строение электронных оболочек атомов
Презентация на тему Строение электронных оболочек атомов Этнокультурные особенности Германии
Этнокультурные особенности Германии Викторина. Году театра посвящается. Г. Сыктывкар
Викторина. Году театра посвящается. Г. Сыктывкар ВЕГЕТАТИВНЫЕ ОРГАНЫ РАСТЕНИЙ
ВЕГЕТАТИВНЫЕ ОРГАНЫ РАСТЕНИЙ Проверка домашнего задания
Проверка домашнего задания Межрегиональный фестиваль чувашской эстрадной песни Виръял Шевлисем, 25 летие
Межрегиональный фестиваль чувашской эстрадной песни Виръял Шевлисем, 25 летие A day in London
A day in London Приоритетный национальный проект «Образование» в нашей школе
Приоритетный национальный проект «Образование» в нашей школе ИНФОРМАЦИОННО-ТЕХНИЧЕСКОЕ УСТРОЙСТВО – СИСТЕМА МОВС-1-АФИ ГНУ АФИ РОССЕЛЬХОЗАКАДЕМИИ Система МОВС-1-АФИ – малогабаритная оптимиз
ИНФОРМАЦИОННО-ТЕХНИЧЕСКОЕ УСТРОЙСТВО – СИСТЕМА МОВС-1-АФИ ГНУ АФИ РОССЕЛЬХОЗАКАДЕМИИ Система МОВС-1-АФИ – малогабаритная оптимиз Використання МОБІЛЬНИХ ЗАСТОСУНКІВ ДЛЯ РЕЄСТРАЦІЇ ПОКАЗНИКІВ ФІЗИЧНОГО СТАНУ Кардаш
Використання МОБІЛЬНИХ ЗАСТОСУНКІВ ДЛЯ РЕЄСТРАЦІЇ ПОКАЗНИКІВ ФІЗИЧНОГО СТАНУ Кардаш Умножение и деление чисел (2 класс)
Умножение и деление чисел (2 класс) Курс семинаров. Интернет-маркетинг. Старт
Курс семинаров. Интернет-маркетинг. Старт Всемирный фестиваль молодёжи и студентов 2017
Всемирный фестиваль молодёжи и студентов 2017 пороки разв уха детей
пороки разв уха детей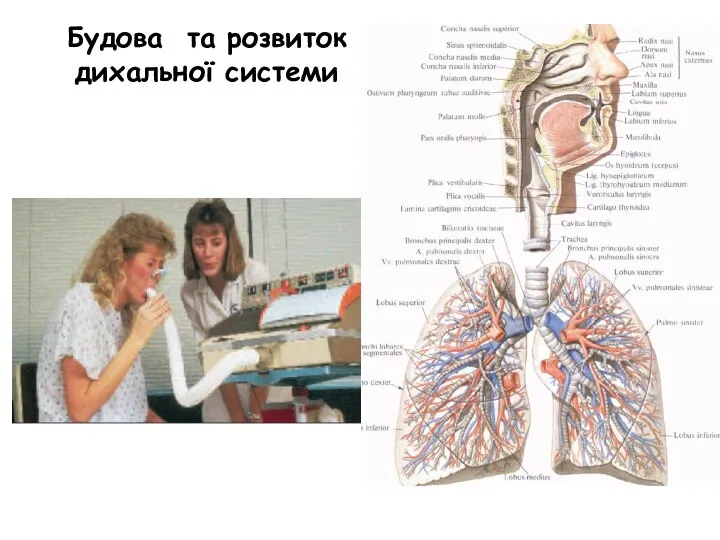 № 1-2-2 Будова та розвиток дихальної системи
№ 1-2-2 Будова та розвиток дихальної системи Общаться с ребенком. Как?
Общаться с ребенком. Как? Трансформация природной формы в дизайн-форму
Трансформация природной формы в дизайн-форму Моё хобби - ГЕОГРАФИЯ
Моё хобби - ГЕОГРАФИЯ